盐酸小檗碱增强美沙拉嗪在治疗溃疡性结肠炎中的作用机制*
2019-05-08李洪梅张君红黄雪井洁张湘莲余明华石榴
李洪梅, 张君红, 黄雪, 井洁, 张湘莲, 余明华, 石榴
广西医科大学第一附属医院消化内科(广西南宁 530011)
溃疡性结肠炎(ulcerative colitis,UC)以结肠黏膜层和黏膜下层连续性炎症病变为主,通常先累及直肠,逐渐向全结肠蔓延[1]。主要以反复腹泻、腹痛、解黏液脓血便等消化道症状为主,电子肠镜检查以结肠黏膜糜烂、溃疡为主,随着社会的不断进步,UC患者日益增多[2]。目前治疗该疾病的药物有:糖皮质激素、5-氨基水杨酸、免疫抑制剂、生物制剂等,其中后3种药物治疗UC疗程长,易反复,且费用高。由于西药的限制性,研发新药或寻找替代药物迫在眉睫。研究表明,中药治疗UC不仅不良反应小、疗效明显,而且价格低廉。盐酸小檗碱具有抗炎、抑菌、抗血小板聚集等作用[3],在辅助治疗该疾病有着一定的疗效,且价格便宜,因此,研究该药的作用机制,可为辅助治疗UC提供新的理论基础,为广大经济困难的UC患者带来希望,给社会带来一定的价值。Toll样受体(Toll-like receptors,TLRs)是天然免疫受体,它可表达于肠道黏膜细胞,并参与识别炎症产物及传导炎症信号[4]。许多研究证实,TLRs与UC的发病关系密切,其中,Toll样受体2 (toll-like receptor 2, TLR2) 是重要的家族成员之一,其很少表达于正常机体,但在炎症肠道中表达则明显偏高[5]。TLR2能够识别病原体相关分子模式(pathogen-associated molecular pattern,PAMP)[6],通过激活下游信号传导分子,激活核因子κB(nuclear factor kappa B,NF-κB),导致炎症因子的表达,最终引发肠道黏膜免疫反应[7]。也有研究表明,白细胞介素-9(interleukin 9,IL-9)可参与机体的炎症反应,而且不同浓度的IL-9可诱导产生不同数量的炎症因子[8]。2015年6月至2018年5月本研究探讨盐酸小檗碱的作用机制:是否具有通过调节IL-9、TLR2的表达而发挥治疗溃疡性结肠炎的作用。
1 材料与方法
1.1 材料与试剂 清洁级SD大鼠40只,雌雄各半,体重180~220 g, DSS(分子量36 000~50 000)及盐酸小檗碱、美沙拉嗪等药品分别购买于美国MP公司及桂中大药房。DAB试剂盒、ELISA试剂盒、逆转录试剂盒、扩增试剂盒、生理盐水分别购买于中杉金桥公司、华美公司、Thermo公司、TaKaRa公司、广西医科大学第一附属医院,4%多聚甲醛、水合氯醛、大便隐血测定试剂盒(干化学法)、EP管、盖玻片等其他试剂耗材购自南宁市品胜实验用品经营店。人与大鼠给药剂量的换算[9]:按照200 g大鼠用药剂量等于70 kg人的临床用药剂量,大鼠的剂量=人临床用药剂量(mg/kg)×70 kg×0.018/200 g=6.3×人临床用药剂量mg/kg。重度UC患者,美沙拉嗪用量可达4 000 mg/d,换算成大鼠美沙拉嗪用量为420 mg/kg;盐酸小檗碱成人用量为900 mg/d,换算成大鼠用量约100 mg/kg。
1.2 试验方法
1.2.1 造模 将大鼠分为5组(n=8):正常对照组、DSS模型组、美沙拉嗪组、盐酸小檗碱组、盐酸小檗碱联合美沙拉嗪组。溃疡性结肠炎大鼠模型建立参考文献[10],并结合2次预实验结果,第1~7天正常对照组大鼠自由饮用蒸馏水,其余4组大鼠自由饮用蒸馏水配制的浓度为5.5%的DSS溶液,使其诱导形成溃疡性结肠炎大鼠模型。
1.2.2 药物干预 第8天予停止饮用DSS溶液,改饮用蒸馏水,美沙拉嗪组及盐酸小檗碱组大鼠分别予美沙拉嗪420 mg/kg(0.2 mL/10 g wt)、盐酸小檗碱100 mg/kg(0.2 mL/10 g wt)灌胃,联合用药组予美沙拉嗪420 mg/kg(0.1 mL/10 g wt)+盐酸小檗碱100 mg/kg(0.1 mL/10g wt)联合灌胃,而正常对照组及DSS模型组大鼠均1次/d予蒸馏水灌胃(0.2 mL/10 g wt),连续7 d。
1.2.3 标本采集 给予药物灌胃治疗1周后,予10%的水合氯醛(0.3 mL/100 g)进行腹腔麻醉,固定大鼠肢体,用酒精消毒腹部后修剪毛发,沿正中线切开腹部,逐层分离,从下腔静脉采血,室温静置2 h,离心(27℃ 2 000 r/min离心10 min)后,移液枪吸取上清液,放置-80℃冰箱低温保存。并将取下的整段结肠,用冰冷生理盐水冲洗干净,剪取病变明显处的结肠组织约1 cm放入4%的甲醛溶液中固定;其余结肠组织放置-80℃冰箱低温保存。
1.2.4 疾病活动指数(DAI)评分 参考文献[11]的DAI评分方法,每天观察记录大鼠的一般情况,如体重、大便性状、隐血、毛发光泽度、精神状态、是否易激惹等变化,用干化学法测定各组大鼠大便出血情况。具体评分标准见表1。
注:DAI=(体重下降分数+大便性状分数+大便隐血情况分数)/3
1.2.5 结肠组织病理学评分 将保存在4%的甲醛溶液中的结肠组织取出做成病理切片,苏木素-伊红染色后,观察病理切片,进行结肠组织病理学评分,具体评分[11]标准见表2。

表2 结肠组织病理学评分
注:结肠组织病理学评分=炎症评分×损伤深度评分×隐窝损伤评分×炎症范围(%)评分
1.2.6 检测指标 酶联免疫吸附测定试验(Enzyme linked immunosorbent assay,ELISA)检测大鼠血清IL-9水平,严格按照试剂盒要求操作。用免疫组织化学法检测大鼠结肠组织TLR2蛋白的表达水平,按照试剂盒要求操作,严格执行。显微镜镜下观察大鼠结肠组织TLR2蛋白表达情况。每张切片选取5个棕黄色颗粒最多且互不重叠的视野,每个视野计数200个细胞,计算阳性细胞所占百分率[12]。
RT-PCR方法测定各组结肠组织TLR2 mRNA水平: (1)用Trizol方法提取RNA;(2)分光光度计检测RNA浓度;(3)按照Thermo试剂盒的操作要求,严格执行,进行逆转录反应合成cDNA;(4)扩增:引物由TaKaRa公司合成,内参GAPDH引物序列为:上游引物:5′-TGACCTCAACTACATGGTCTACA-3′,下游引物:5′-CTTCCCATTCTCGGCCTTG-3′。TLR-2上游引物序列(F):5′-AGCAGGATTCCTATTGGGTGGAG-3′,下游引物序列(R):5′-ATGATCCATTTGCCCGGAAC-3′,产物长度112 bp。扩增反应体系为20 μL,其中cDNA 1 μL,下游引物0.8 μL,上游引物0.8 μL,无酶水7 μL,反应条件:95℃,30 s;95℃,5 s ;60℃,34 s;共40个循环。

2 结果
2.1 各组大鼠一般情况比较 除正常对照组外,盐酸小檗碱组及盐酸小檗碱联合美沙拉嗪组大鼠于造模第1天即出现黏液便及松软大便;造模第2天,DSS模型组大鼠出现松软大便及大便潜血+,盐酸小檗碱联合美沙拉嗪组可见肉眼血便;随着DSS的自由饮用,各组大鼠陆续出现软便、烂便及血便,肛周污秽,毛发晦暗凌乱,精神萎靡,体重不同程度地下降;第7天,自由饮用DSS溶液的各组大鼠DAI评分均明显高于正常对照组,差异有统计学意义(P<0.01);盐酸小檗碱组、美沙拉嗪组及盐酸小檗碱联合美沙拉嗪组大鼠分别予相应药物灌胃后,解稀烂便及解血便症状逐渐消失,体重呈逐渐上升趋势,精神状态好转,毛发逐渐恢复光泽。第14天,与DSS模型组对比,盐酸小檗碱组、美沙拉嗪组DAI评分稍降低,差异有统计学意义(P<0.05),而盐酸小檗碱联合美沙拉嗪组大鼠DAI评分明显降低,差异有统计学意义(P<0.01)。见表3。
2.2 大鼠结肠组织肉眼观察 正常对照组大鼠结肠皱襞纹理清晰,结构正常,无黏膜水肿、糜烂;DSS模型组大鼠结肠组织肉眼可见黏膜充血、水肿,靠近肛门处肠壁明显变薄,甚至可见巨结肠及糜烂、浅表溃疡;其余3组大鼠结肠组织靠近肛门处可见肠壁明显变薄,部分可见愈合的溃疡瘢痕。
2.3 大鼠结肠组织病理学观察 正常对照组大鼠结肠黏膜结构完整、腺体排列规整;DSS模型组大鼠结肠组织腺体结构紊乱或消失,甚至黏膜糜烂,有大量炎性细胞浸润,杯状细胞消失;美沙拉嗪组大鼠结肠组织可见黏膜缺损,腺体排列不整齐,及中等量炎性细胞浸润;盐酸小檗碱组大鼠结肠组织腺体排列紊乱、可见炎性细胞浸润及隐窝结构变形,甚至萎缩;盐酸小檗碱联合美沙拉嗪大鼠结肠组织腺体结构排列相对整齐,可见少量炎性细胞浸润,可见到大量杯状细胞(图1)。与DSS模型比较,正常对照组、美沙拉嗪组、盐酸小檗碱联合美沙拉嗪组大鼠组结肠组织病理学评分明显降低,差异有统计学意义(P<0.01),而盐酸小檗碱组评分有所下降,差异有统计学意义(P<0.05);与美沙拉嗪组、盐酸小檗碱组对比,盐酸小檗碱联合美沙拉嗪组结肠组织病理学评分有所下降,差异有统计学意义(P<0.05)。见表3。
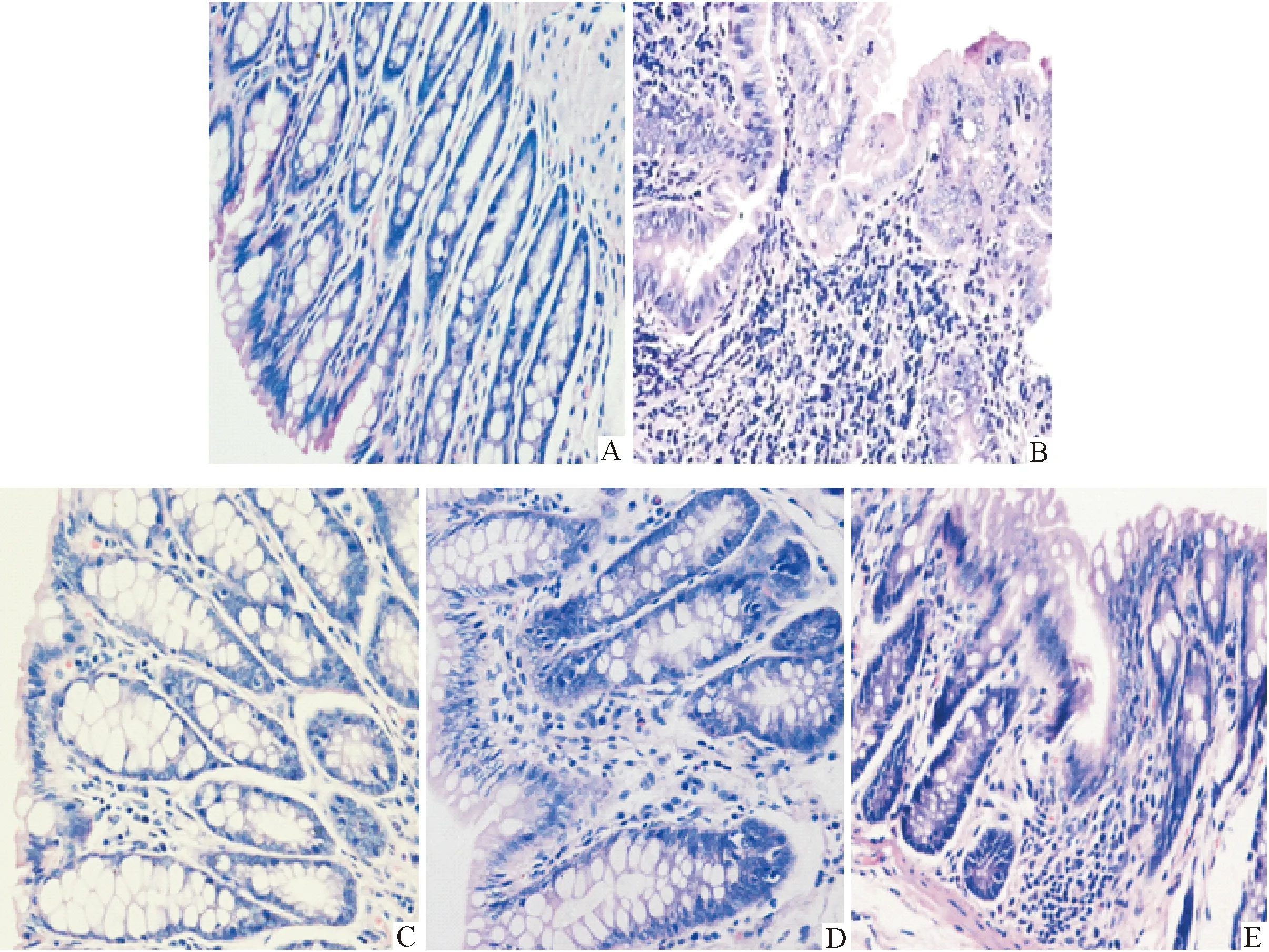
A:正常对照组;B:DSS模型组;C:盐酸小檗碱联合美沙拉嗪组;D:盐酸小檗碱组;E:美沙拉嗪组

组别nDAI评分第7天第14天结肠组织病理学评分正常对照组80.000±0.0000.000±0.0000.440±0.315△△DSS模型组82.251±0.661∗2.584±0.3465.325±1.466美沙拉嗪组82.419±0.556∗1.916±0.586△2.975±1.626△△▲盐酸小檗碱组82.333±0.618∗2.041±0.517△3.703±1.861△▲盐酸小檗碱联合美沙拉嗪组82.209±0.563∗1.625±0.486△△1.525±1.233△△
*与正常对照组比较P<0.01; 与DSS模型组比较△P<0.05,△△P<0.01;▲与盐酸小檗碱联合美沙拉嗪组比较P<0.05
2.4 酶联免疫吸附法测定各组大鼠血清中IL-9含量 与DSS模型组对比,正常对照组、盐酸小檗碱联合美沙拉嗪组大鼠血清IL-9的含量明显偏低,差异有统计学意义(P<0.01),而美沙拉嗪组、盐酸小檗碱组血清IL-9表达有所偏低(P<0.05)。见表4。
2.5 免疫组织化学法检测各组大鼠结肠组织TLR2蛋白表达 Olympus光学显微镜下观察结肠组织病理学切片,细胞质和(或)细胞核出现棕黄色颗粒为阳性细胞,正常对照组、DSS模型组及其他3组药物治疗组阳性细胞表达量各不同,DSS模型组大鼠结肠黏膜、黏膜下层、黏膜肌层等细胞核及细胞质可见到明显棕黄颗粒,盐酸小檗碱组、美沙拉嗪组及盐酸小檗碱联合美沙拉嗪组可见到多少不等的棕黄色颗粒,而正常对照组大鼠结肠组织可见少量散在棕黄色颗粒,炎性细胞仅弱表达(图2)。与DSS模型组比较,正常对照组、盐酸小檗碱组、美沙拉嗪组及盐酸小檗碱联合美沙拉嗪组阳性细胞表达率明显偏低,差异有统计学意义(P<0.01);与盐酸小檗碱组、美沙拉嗪组比较,盐酸小檗碱联合美沙拉嗪组表达量偏低,差异有统计学意义(P<0.05)。见表4。
2.6 各组大鼠结肠组织TLR2 mRNA的表达 用相对定量方法处理数据,GAPDH作为内参基因, 结果用2-ΔΔCT值表示。相对DSS模型组,正常对照组、美沙拉嗪组、盐酸小檗碱组及盐酸小檗碱联合美沙拉嗪组大鼠结肠组织TLR2 mRNA表达明显下降,差异有统计学意义(P<0.01);与美沙拉嗪组、盐酸小檗碱组比较,盐酸小檗碱联合美沙拉嗪组大鼠结肠组织TLR2 mRNA表达有所下降,差异有统计学意义(P<0.05)。见表5。
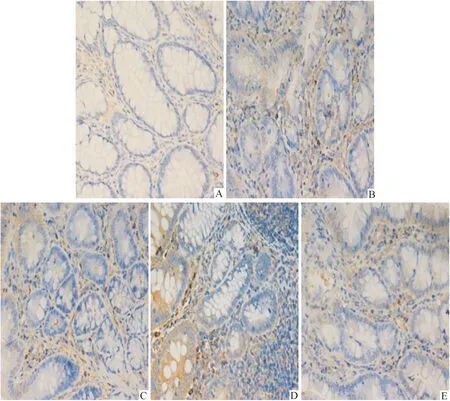
A:DSS模型组;B:正常对照组;C:盐酸小檗碱联合美沙拉嗪组;D:盐酸小檗碱组;E:美沙拉嗪组
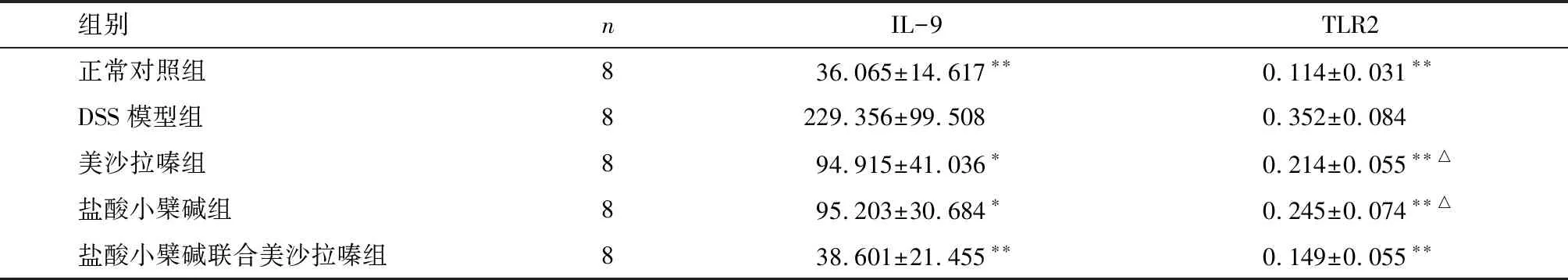
组别nIL-9TLR2正常对照组836.065±14.617∗∗0.114±0.031∗∗DSS模型组8229.356±99.5080.352±0.084美沙拉嗪组894.915±41.036∗0.214±0.055∗∗△盐酸小檗碱组895.203±30.684∗0.245±0.074∗∗△盐酸小檗碱联合美沙拉嗪组838.601±21.455∗∗0.149±0.055∗∗
与DSS模型组比较*P<0.05,**P<0.01;△与盐酸小檗碱联合美沙拉嗪组比较P<0.05
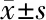

组别nTLR2 mRNA正常对照组80.067±0.023∗DSS模型组80.449±0.089美沙拉嗪组80.279±0.083∗△盐酸小檗碱组80.311±0.070∗△盐酸小檗碱联合美沙拉嗪组80.206±0.071∗
*与DSS模型组比较P<0.01;△与盐酸小檗碱联合美沙拉嗪组比较P<0.05
3 讨论
UC发病机制尚不明确,可能与遗传因素、环境因素、感染因素、免疫因素及个人心理因素等有关[13]。目前西医治疗该病具有规律性、快速性及高效性等优点,但难以根治,且部分患者治疗效果欠佳,易反复。研究表明,中医中药治疗UC具有鲜明的特色,不仅能长期缓解症状,还可减少复发,且疗效显著[1]。
盐酸小檗碱是黄连的主要有效成分,已经被证实具有抗炎、抑菌、抗血小板聚集、降脂、降糖等多种作用[3]。许多研究证实,盐酸小檗碱对UC具有较好的疗效[14-16],其可能通过调整肠道微生态环境、保护肠道结构完整性、调节细胞或体液免疫等来发挥治疗作用[17]。Feng等[18]研究发现盐酸小檗碱可以抑制环氧合酶-2(cyclooxygenase-2,COX-2)活性,而COX-2可催化花生四烯酸(arhaidoincacid,AA)生成前列腺素E2(prostaglandin E2,PGE2),过量的PGE2可导致黏膜通透性增加及血管扩张,使结肠组织潮红肿胀[19],导致炎症发生。盐酸小檗碱可能是通过抑制COX-2的活性从而使生成的前列腺类似物减少,减轻炎症反应,进而降低结肠炎症活动度。盐酸小檗碱具有显著的抗血小板聚集作用,能抑制家兔血小板中血栓素A2(thromboxane A2,TXA2)的合成,而TXA2可通过聚集血小板、收缩血管平滑肌,导致血管痉挛和微血栓形成,盐酸小檗碱可能是通过抑制血浆TXA2合成,从而改善血液高凝状态,起到治疗UC的作用。因此,盐酸小檗碱具有治疗UC的功效,但其作用机制尚不明确,我们通过检测实验组大鼠血清IL-9、结肠组织TLR2 mRNA、TLR2蛋白的表达来研究盐酸小檗碱治疗UC的作用机制。
炎症的发生,与机体内促炎细胞因子及抗炎细胞因子之间的对等关系被破坏关系密切。研究表明,IL-9参与机体的变态反应及免疫反应[20],也有学者认为IL-9与UC发病密切相关,但相关研究资料甚少。IL-9主要来源于Th9细胞,其中Th9细胞是新发现的CD4+T细胞亚群的一种[21]。Nalleweg 等[22]研究发现IL-9参与UC的发病过程,且与疾病活动程度相关,相对正常人及轻度UC患者,重症UC患者的IL-9水平明显升高。肠上皮细胞上含有大量的IL-9受体,有研究用IL-9抗体中和小鼠体内IL-9,UC小鼠炎症指标下降,消化道症状及结肠组织病理变化改善[21, 23-24],此研究结果支持IL-9参与UC发病的观点。IL-9是通过紧密连接分子改变结肠组织屏障性质来参与炎症反应,使构成紧密连接的结构蛋白发生变化,导致肠道黏膜通透性增加,肠道菌群结构紊乱,炎症反应扩大,最终影响结肠组织溃疡的愈合[25-26]。此外,研究表明,低浓度的IL-9可起到增强原代巨噬细胞对PAMPs的诱导作用,导致炎症因子的产生,而在高浓度IL-9的作用下,同样可致使原代巨噬细胞产生炎症因子,由此说明,IL-9参与巨噬细胞PAMPs激活信号的传导[8]。
作为炎性反应链的启动蛋白,TLR2主要表达于Th1细胞、Th2细胞、巨噬细胞、单核细胞及部分肠道黏膜细胞等,可识别革兰阳性菌的肽聚糖、磷壁酸等。研究发现UC模型组大鼠结肠组织TLR2基因及TLR2蛋白的表达水平明显偏高,予药物干预治疗后,大鼠体内的TLR2基因及TLR2蛋白的表达水平降低,消化道症状缓解,炎症评分下降,考虑TLR2在对肠道PAMPs进行模式识别的过程中,可触发对NF-κB的激活,过量的TLR2会大规模激活NF-κB,使得炎性因子过度表达,导致炎症的扩大发生。也有研究表明,激活的NF-κB又可促进 TLR2的表达,形成 TLR2 -NF-κB-TLR2循环,从而产生持续扩大的炎症反应[27-29]。TLR2/NF-κB通路的阐明,表明 TLR2在UC发展中占有重要地位。
本研究采用DSS诱导建立UC大鼠模型,采用ELISA、免疫组织化学法、RT-PCR等方法检测各组大鼠血清IL-9及结肠组织TLR2 mRNA、TLR2蛋白的表达水平。实验结果表明给予美沙拉嗪、盐酸小檗碱及盐酸小檗碱联合美沙拉嗪治疗UC大鼠后,大鼠腹泻、便血、体重下降等症状得到改善,毛发恢复光泽,精神状态好转。与DSS模型组对比,盐酸小檗碱联合美沙拉嗪组大鼠第14天DAI评分、结肠组织病理学评分、血清IL-9表达量明显下降(P<0.01),而美沙拉嗪组、盐酸小檗碱组第14天DAI评分、血清IL-9表达量有所下降(P<0.05);与美沙拉嗪组、盐酸小檗碱组对比,盐酸小檗碱联合美沙拉嗪组结肠组织病理学评分、血清IL-9、结肠组织TLR2 mRNA、TLR2蛋白表达均有所下降(P<0.05)。通过本研究,猜测盐酸小檗碱可能是通过降低UC大鼠结肠组织TLR2 mRNA、TLR2蛋白的表达来影响TLRs/NF-κB通路,以及TLR2-NF-κB-TLR2的自循环,最终减弱NF-κB的激活,减少由NF-κB引起的炎症因子含量,减轻其造成的结肠炎症反应。此外,盐酸小檗碱也可能是通过减少血清IL-9的表达,改变肠道黏膜通透性,维持肠道菌群平衡,防止炎症反应扩大,加快结肠损伤组织的愈合;也可能是通过减少血清IL-9的表达从而减弱对原代巨噬细胞和(或)PAMPs的诱导作用,从而减少炎症因子对肠道黏膜的刺激。这可能是盐酸小檗碱治疗UC的作用机制之一。目前盐酸小檗碱治疗UC的作用机制尚未明确,仍需广大研究者在临床及实验中进一步深入研究。
