非小细胞肺癌免疫治疗不良反应及疗效预测指标研究进展
2019-05-08
青海大学附属医院肿瘤内科(青海西宁 810000)
肺癌是当代中国发病率、病死率最高的恶性肿瘤[1]。其中非小细胞肺癌(non small cell lung cancer,NSCLC)是最常见的病理类型,占80%~90%[2]。多数患者确诊时已为晚期,失去手术机会,放化疗成为主要治疗手段,但效果欠佳。NSCLC标准含铂双药化疗有效率仅为25%~35%,5年生存率约为5%,中位生存期8~10个月[3-4],对于表皮生长因子受体(epidermal growth factor receptor,EGFR)基因突变患者,口服靶向治疗药物,总生存期有所提高,但患者多在9~13个月产生耐药导致病情进展[4]。随着分子生物学、免疫学研究的发展,免疫治疗为当代肺癌患者提供了新的治疗方法。
1 免疫治疗概述
免疫治疗分为主动免疫和被动免疫[5],主动免疫治疗的关键是抗原识别,要求机体有完整的免疫系统,它包括以下3种类型:强化免疫细胞功能的细胞因子,抗原依赖性疫苗(包括细胞疫苗、分子疫苗及基因疫苗),以及非抗原依赖性的调节T细胞功能的药物。被动免疫是指通过体外免疫活性物质,不通过机体免疫系统而起到治疗作用,包括抗肿瘤单克隆抗体及过继免疫治疗。研究发现[6-7]影响肿瘤免疫治疗的因素中,以肿瘤微环境中调节性细胞(Tregs细胞)所介导的免疫抑制作用较为突出,针对细胞负性调控分子的单克隆抗体为肺癌的治疗带来新的突破,故我们现在所说的免疫治疗特指狭义意义的免疫治疗即免疫检查点(check point)的治疗。
目前研究火热的免疫治疗靶点主要有细胞毒性T淋巴细胞相关蛋白4(cytotixic T-lymphocyte associated protein 4,CTLA-4)、程序性死亡受体-1(programmed death receptor-1,PD-1)及程序性死亡配体-1(programmed death ligand-1,PD-L1)。激活的T淋巴细胞会表达CTLA-4,与同时表达于T细胞表面的B28分子竞争抗原提呈细胞(antigen presenting cell,APC)细胞上的B7分子,抑制CD28与B7分子结合,从而向胞内传递抑制信号,抑制T细胞的活化,降低其杀伤功能。PD-1表达于活化的 T 细胞、B 细胞、树突状细胞及髓系细胞,PD-L1是其主要配体,它可以在APC细胞和肿瘤细胞上表达,当PD-1与配体PD-L1结合时,会通过抑制细胞毒性T细胞反应来避免抗肿瘤活性,而PD-1、PD-L1抑制剂可破坏这种抑制信号重新激活细胞毒性T细胞[8],见图1。
2 NSCLC的免疫治疗
既往认为肺癌作为一种免疫原性较弱的恶性肿瘤,难以通过免疫治疗获益,但多种研究成果为其免疫治疗提供了依据[12]。CheckMate-017、Keynote-010等[13-14]试验奠定了免疫靶向抑制剂用于二线NSCLC的治疗地位,Keynote-024[15]试验证明了Pembrolizumab可用于NSCLC的一线治疗。目前FDA批准的治疗NSCLC的有作用于CTLA-4的Ipilimumab,分别作用于PD-1的Nivolumab、Pembrolizumab,PD-L1的Atezolizumab等。CTLA-4单独使用时效果不理想,一般需要与其他药物联合使用[16],目前应用于NSCLC治疗的主要是PD-1/PD-L1抑制剂。
在使用免疫检查点抑制剂时,会有独特的不良反应,被称为免疫相关不良事件[13],它可以发生在全身的任何器官,包括结肠、肺、肝脏、内分泌系统或肾脏。 PD-1/PD-L1抑制剂在NSCLC的Ⅲ期临床试验[15]中显示,使用Nivolumab时不良反应发生率为32%~58%,而使用Pembrolizumab时不良反应发生率为29%。使用免疫抑制剂时主要的不良反应包括皮肤表现(如皮疹和瘙痒)、甲状腺功能减退和肺炎。Khunger等[17]比较了PD-1和PD-L1抑制剂之间的肺炎的发生率,收集了19个临床试验,(12个PD-1抑制剂,n=3 232,7个PD-L1抑制剂,n=1 806),与使用PD-L1抑制剂相比,PD-1抑制剂更易发生肺炎(3.6%vs1.3%,P=0.001)。
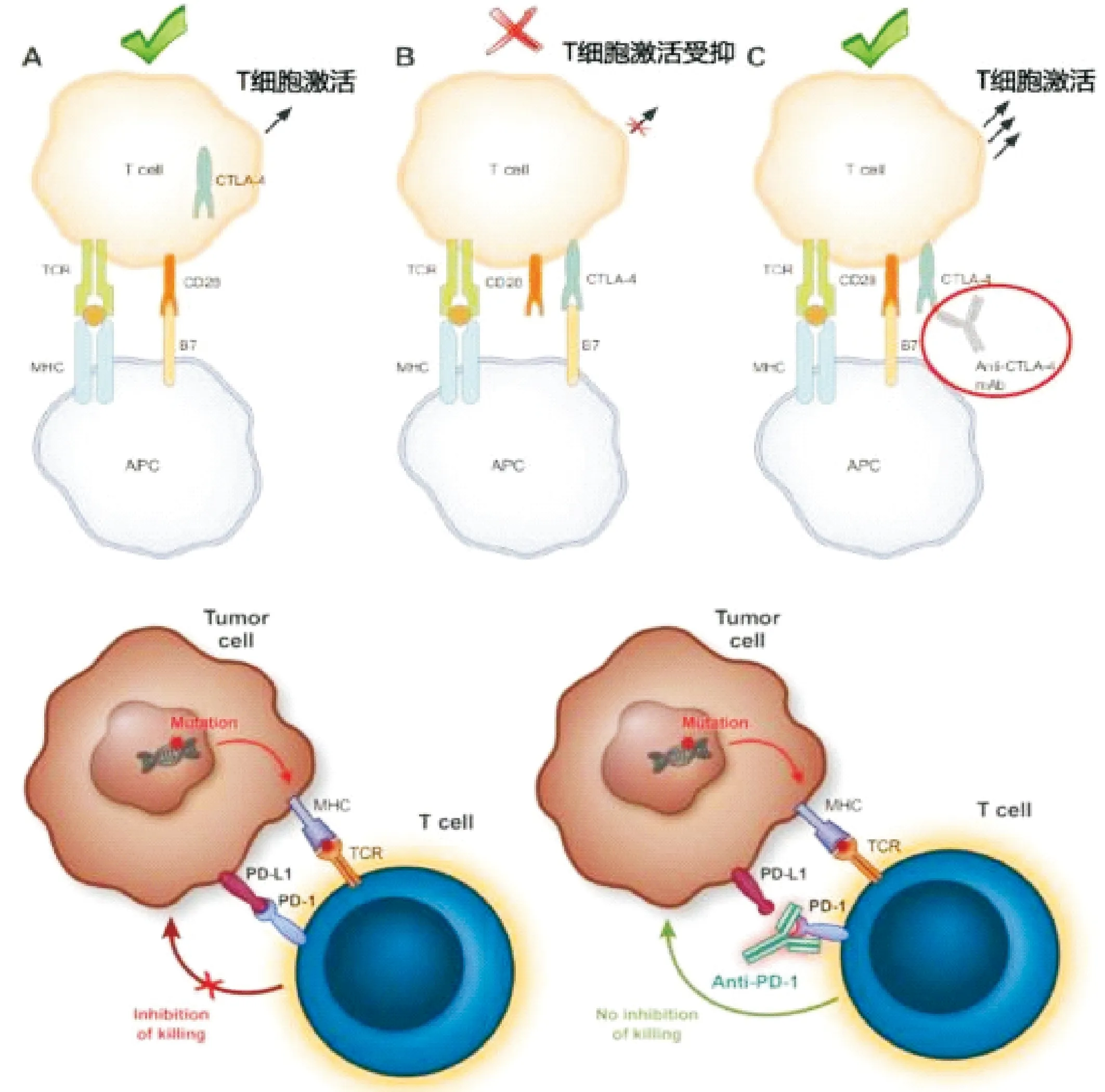
图1 CTLA-4 PD-1/PD-L1抗体的作用机制[9-11]
除了上述常见不良反应外,还有相关文献报道的罕见并发症,有助于对免疫治疗的不良事件有更深入的了解。与免疫检查点抑制剂治疗相关的自身免疫性糖尿病(diabetes mellitus,DM)是极其罕见的。Godwin等[18]报道了第1例肺癌患者在一线使用化疗失败后给予Nivolumab治疗,在2个疗程后,患者突然出现高血糖和糖尿病酮症酸中毒。在这之后Semper等[19]发现在患者使用免疫抑制剂时引发了心肌炎。Abe等[20]报道了1例复发性肺腺癌患者使用Nivolumab治疗,在服药后4 d,患者出现静坐不能,病情难以控制并逐渐恶化,且通过影像学及脑脊液细胞学检查均未发现可能引起神经病变的原因。
3 疗效预测指标
即使报道称免疫治疗疗效显著,但有效率不超过45%[6]。免疫检查点抑制剂的应用虽然为肺癌的治疗带来了新的曙光,但面对巨额的费用及众多不良反应,当代精准医学,如何筛选优势人群,通过何种方式预测治疗效果尤为重要。CheckMate-017[13]研究表明,在鳞癌患者中,使用Nivolumab治疗,无病进展生存期(progression-free survival,PFS)、总生存期(overall survival, OS)均优于多西他赛,疗效与PD-L1的表达多少无关。CheckMate-227[21]同样表明在突变负荷高的肿瘤患者中无论PD-L1的表达水平如何,免疫治疗与化疗相比明显延长PFS。而Sepesi等[22]认为PD-L1可以作为免疫治疗疗效预测指标。他们纳入了113例可手术切除的Ⅰ期NSCLC,数据显示PD-L1表达<4.7%的患者OS要好于>4.7%的患者(P=0.001)。在巨噬细胞中PD-L1表达<6.3%的患者预后也明显好于>6.3%的患者(P=0.005)。在肿瘤细胞及巨噬细胞中PD-L1均低表达的患者,5年OS为94%。相反,在肿瘤细胞及巨噬细胞中PD-L1均高表达的患者,5年OS为20%,证明PD-L1在肿瘤细胞及肿瘤浸润的巨噬细胞(tumor infiltrated macrophages,TIMs)中的表达可作为一种预后生物标记。最近的荟萃分析[14,23]也证实了PD-L1在Pembrolizumab和Atezolizumab使用中作为预测生物标记的作用。
3.1 PD-L1作为预测指标的局限性 尽管多个临床试验证明PD-L1可以作为免疫治疗疗效预测指标,但也有数据显示PD-L1高表达患者未获益,而低表达患者有效率为10%~16%[24],故不能仅靠PD-L1的表达水平预测疗效,且PD-L1的表达受多种因素的影响。
3.1.1 PD-L1的表达可能与标本储存时间、标本来源等因素相关 研究[25]表明标本长期储存会使PD-L1的表达比例明显降低,在原本表达阳性的标本中,储存6周或更长时间后,会有50%出现染色阴性。Grigg等[26]报道,在新鲜标本中使用免疫治疗效果更佳。而2015年数据[27]分析显示PD-L1表达的频率和强度在新鲜和储存标本中相同。Kim 等[28]从146例患者身上提取原发及转移灶标本共161个,发现原发性和转移性肿瘤之间PD-L1表达的总体一致率为75.2%(121/161),认为在难以获取原发病灶标本时可检测转移灶的PD-L1的表达情况,从而指导免疫治疗。而Mansfield等[29]报道PD-L1在原发病灶和转移病灶中表达不同。
3.1.2 PD-L1的表达与患者既往是否接受治疗可能相关 关于患者治疗后会不会影响PD-L1的表达报道很少。Mansfield等[30]报道PD-L1在化疗、放疗、靶向治疗或不治疗后没有显著差异。而Haratake等[31]在试验中发现有3个案例PD-L1的表达在使用Nivolumab治疗后都发生了转变,认为在免疫治疗时需要再次评估标本。
基于PD-L1的表达受众多因素的影响,且其对临床疗效的评价存在众多争议,所以我们需要探索发现更多与疗效相关的指标。
3.2 新的预测指标
3.2.1 肿瘤突变负荷(tumor mutation burden,TMB) TMB是指基因组中体细胞突变的数目,也被认为是免疫治疗疗效预测的指标之一。在CheckMate-227[21]研究中招募Ⅳ期或既往未使用化疗的复发性NSCLC患者,PD-L1的表达水平以1%为界分为两组,证明肿瘤突变负荷高的患者使用Nivolumab+Pembrolizumab明显优于化疗组(PFS为42.6%vs13.2%,中位无进展生存期为7.2个月vs5.5个月,ORR为45.3%vs26.9%,差异有统计学意义)。
3.2.2 CYFRA21-1 CYFRA21-1即细胞角蛋白19的可溶性片段,是NSCLC最有价值的血清肿瘤标志物。CYFRA21-1水平升高说明有向肺鳞癌分化的趋势,肺鳞癌比腺癌有更高的肿瘤负荷,肿瘤突变负荷被认为是疗效预测指标[32],故提出对于CYFRA21-1高表达患者可能采用免疫治疗有更好的疗效。Shirasu等[33]证明血清CYFRA 21-1水平是一个独立的预测因子,在CYFRA21-1表达>2.2 ng/mL患者中使用免疫治疗可明显获益。
3.2.3 癌胚抗原(carcino-embryonic antigen,CEA) Kataoka 等[34]发现在189例NSCLC患者中使用Nivolumab治疗,体力状况(performance state,PS)评分2分及以上、乳酸脱氢酶(lactic dehydrogenase,LDH)高于217 mg/mL,CEA>13.8 ng/mL都会缩短PFS。对血清CEA水平高的患者使用Nivolumab效果欠佳。证明CEA可以作为Nivolumab治疗NSCLC疗效的预测指标,CEA高、PS评分低的患者不适合使用Nivolumab。
3.2.4 催乳素(prolactin,PRL) PRL是一种肽激素,作为一种细胞因子在人类T细胞介导免疫中发挥重要作用,它通过对T细胞调控可降低Nivolumab的疗效。有报道[35]称使用Nivolumab治疗NSCLC,PRL可能是其预测指标。该试验中纳入了26个使用Nivolumab治疗的NSCLC患者,分别在治疗前测血液PRL水平。其中20例患者(77%)在治疗期间出现高泌乳素血症,6例患者(23%)在治疗过程中PRL在正常水平(P=0.001)。在20例高泌乳素血症患者中,有95%的患者病情进展(progressive disease, PD),在6例激素水平正常患者中,有2例(33%)有PD(P=0.004),故对于NSCLC患者使用Nivolumab时高泌乳素血症可能是不良临床结果的早期预测指标。
3.2.5 淋巴细胞比值(neutrophil to lymphocyte ratio,NLR) 现已证明转移性黑色瘤患者使用Ipilimumab,NLR<5与预后相关,故推测在使用免疫检查点抑制剂治疗NSCLC时可否通过NLR推测其预后。Bagley 等[36]收集了所有在2015年3月至2016年3月期间接受Nivolumab治疗的病例,将患者依据NLR>5、<5分为两组,分析其与OS、PFS、客观有效率(objective response rate,ORR)的关系。分析显示,治疗前NLR>5的患者OS差一些(5.5个月vs8.4个月,P=0.002),中位PFS (1.9个月vs2.8个月,P=0.04)。推测用Nivolumab治疗的NSCLC患者中,治疗前NLR> 5与不良预后有关。
3.2.6 毛发的改变 在使用免疫抑制剂治疗黑色素瘤时,有患者会出现皮肤、毛发变白的情况。Rivera等[37]描述了14例患者使用免疫治疗后毛发的变化。其中有13例患者头发的颜色变暗,在这14例患者中,有13例病情稳定,只有1例因为严重不良反应在4周期后停止治疗。故推测在接受抗PD-1、PD-L1单抗治疗的患者中,毛发颜色的恢复可能是一个很好的反应标记。
此外还有报道[38]称循环肿瘤DNA(circulating tumor DNA,ctDNA)可以作为预测指标,对于肿瘤体积大的患者,可以通过ctDNA来预测使用Nivolumab的疗效。相关研究[39-41]表明基因BINI、TP53、KRAS、EGFR等基因也有疗效有一定相关性。
4 小结
NSCLC的免疫治疗是近几年的新热潮,其在将来的治疗中前景广阔。但免疫治疗费用昂贵,有效率不足45%[6],且免疫治疗也会引起众多不良反应,为了更好地筛选优势人群,使患者更好获益,需要了解更多的疗效预测指标。中国的NSCLC患者与其他国家相比EGFR基因突变患者比例更高,驱动基因的差异是否影响免疫治疗效果仍需进一步探讨。免疫治疗药物使用时间、是否需要与其他药物联合使用需要在今后的临床试验中进一步验证,还需更深入明确免疫治疗的耐药问题。相信通过不懈的努力,免疫治疗会在NSCLC精准治疗中占有一席之地。
