拟轮枝镰孢ATMT突变体库的构建及分析
2019-05-08孙华马红霞丁梦军李坡石洁刘树森
孙华,马红霞,丁梦军,李坡,石洁,刘树森
拟轮枝镰孢ATMT突变体库的构建及分析
孙华,马红霞,丁梦军,李坡,石洁,刘树森
(河北省农林科学院植物保护研究所/农业部华北北部作物有害生物综合治理重点实验室/河北省农业有害生物综合防治工程技术研究中心, 河北保定 071000)
【目的】通过建立适用于拟轮枝镰孢()的农杆菌介导遗传转化体系,构建绿色荧光蛋白(green fluorescent protein,GFP)标记的拟轮枝镰孢ATMT(-mediated transformation)突变体库,并对突变体库进行筛选分析,为研究拟轮枝镰孢在玉米果穗上的侵染途径和致病的分子机制打下基础。【方法】筛选头孢噻肟钠(cefotaxime sodium,Cefo)和氨苄青霉素钠(ampicillin sodium,Amp)对根癌农杆菌AGL-1的抑菌浓度和拟轮枝镰孢对潮霉素B(hygromycin B)的敏感浓度;以含有绿色荧光蛋白基因()、潮霉素抗性基因()的穿梭质粒为载体,通过ATMT构建GFP标记的拟轮枝镰孢突变体库;利用潮霉素抗性筛选、的特异性引物进行PCR检测和荧光显微镜观察,检测分析T-DNA插入情况及转化子稳定性;从突变体库中随机挑选9个转化子菌株并进行分析,对其产孢量、分生孢子萌发率、致病力等进行测定。【结果】通过农杆菌抑菌试验发现当Cefo/Amp的浓度为150/150 μg·mL-1时,AGL-1生长受到抑制;当潮霉素B的浓度为150 μg·mL-1时,拟轮枝镰孢完全丧失生长能力。利用优化后的ATMT转化获得了2 465株GFP标记的拟轮枝镰孢转化子;转化子在不含潮霉素B的PDA培养基上连续转接5代再转到含潮霉素B的培养基上仍能正常生长,说明成功插入野生型基因组且稳定遗传;利用特异性引物对转化子进行PCR检测,测序结果显示与NCBI中(登录号:LC420351.1)的同源性为99.26%,表明已成功整合到野生型基因组中;转化子菌丝和孢子在荧光显微镜下观察均呈现绿色,而野生型菌株未观察到任何荧光,表明转移到拟轮枝镰孢野生型菌株基因组中,且能够成功表达。对部分转化子分析发现,与野生型相比转化子54的产孢量明显增多,约为野生型的1.9倍;转化子24的分生孢子萌发率在相同时间内明显下降;转化子13的致病力增强,病害级别达到9级,转化子33和16致病力减弱为3级,转化子4致病力最弱为1级,部分转化子生物学性状未发生明显变化。【结论】构建了农杆菌介导GFP标记的拟轮枝镰孢突变体库,筛选分析获得了产孢量、孢子萌发率、致病力发生变化的突变体,为进一步研究拟轮枝镰孢侵染玉米果穗的途径和致病的分子机制打下了基础。
玉米;拟轮枝镰孢;ATMT;突变体库;绿色荧光蛋白;转化子
0 引言
【研究意义】玉米是世界三大粮食作物之一[1],是重要的饲料和工业原料。近年来,玉米穗腐病的发生日益严重。拟轮枝镰孢()是引起玉米穗腐病的重要致病菌[2-3],常造成严重的产量和经济损失,其产生的毒素还威胁人畜健康[4-5]。目前生产上抗玉米穗腐病的品种较少,对穗腐病的防治主要依靠化学农药,亟需对其侵染途径和致病机理进行研究。构建带绿色荧光蛋白(green fluorescent protein,GFP)标记的拟轮枝镰孢ATMT突变体库,并以此为对象研究穗腐病菌的侵染和致病机理,对寻找防治该病害的新策略、新方法具有重要意义。【前人研究进展】目前,对于拟轮枝镰孢的产毒类型、生物学特征、结构及调控机制、遗传多样性和引起病害的防治等方面已有较为清楚的认识[6-14]。拟轮枝镰孢对玉米果穗的侵染途径也有所报道,但研究结果存在争议。一般认为有3种途径:(1)种传,通过母系传播给下一代,首先通过种子进入初生根,然后朔根向上进入植株的茎髓引起植株的系统侵染[15-16];(2)气传,其分生孢子通过气流落到叶鞘缝隙处侵染叶鞘组织或茎节,病原菌向上侵染引起穗腐,或落到花丝上,进而侵染籽粒[17-18];(3)土传,土壤中的病菌通过菌丝的生长直接侵染玉米植株根系,然后继续向上侵染植株地上组织,直到果穗,引起穗腐[19-20]。由于以上结果的获得大多采用的是组织化学染色法、病菌分离法等传统的方法,需用更有效的方法进一步明确。农杆菌介导的转化(-mediated transformation,ATMT)以其受体广泛、操作简便、转化效率高、单拷贝比例高等优点在真菌研究中被广泛应用[21],目前已有近100种真菌成功实现转化。如黄亚丽[22]以哈茨木霉()孢子为受体,通过ATMT法构建了含有4 500株转化子的突变体库,其中80%为随机单拷贝插入;王梅娟等[23]通过ATMT法构建玉米大斑病菌()突变体库,大部分菌株菌落形态和生长速率没有发生明显改变;许苗苗等[24]通过ATMT法构建了青色荧光标记的禾谷镰孢()转化子。【本研究切入点】拟轮枝镰孢侵染玉米导致穗腐病的侵染途径和致病机理存在争议,采用传统的组织化学染色法病菌分离法无法实时、活体观察病原菌,且检测分辨率低,不能清晰的标记定位病原菌,这也是拟轮枝镰孢侵染机制存在争议的原因之一。利用标记研究其侵染途径,利用反向遗传学克隆致病相关基因,成为研究其致病机制的突破口之一。【拟解决的关键问题】以玉米穗腐病样本上分离到的拟轮枝镰孢为研究对象,通过摸索优化拟轮枝镰孢ATMT转化,构建具有绿色荧光蛋白标记、遗传稳定、致病力变异的转化子突变体库,为拟轮枝镰孢侵染玉米导致穗腐病的过程及致病机制研究打下基础。
1 材料与方法
1.1 材料
1.1.1 供试菌株 拟轮枝镰孢、根癌农杆菌AGL-1(带有双价载体质粒,该质粒将pCAMBIA1300骨架中的 pCaMV35S-hph置换为pTrpc,同时含有和)由河北省农林科学院植物保护研究所玉米综合防控实验室保存。
1.1.2 化学试剂 乙酰丁香酮(AS)、MES、头孢噻肟钠、氨苄青霉素钠、利福平、卡那霉素等产品均购自Sigma公司;潮霉素B购自Roche公司;真菌基因组DNA提取试剂盒,北京艾德莱生物科技有限公司;2×Es Taq MasterMix(含染料),全氏金生物科技有限公司;Biowest Agarose G-10,南京生兴生物技术有限公司;引物由上海生工生物工程有限公司合成。
1.1.3 培养基 PDA培养基:马铃薯200 g,葡萄糖20 g,琼脂粉20 g,蒸馏水1 L;LB固体培养基:胰蛋白胨10 g,酵母提取物5 g,氯化钠10 g,琼脂粉20 g,蒸馏水定容至1 L;LB液体培养基:胰蛋白胨10 g,酵母提取物5 g,氯化钠10 g,蒸馏水定容至1 L;2.5×MM salts:KH2PO43.625 g,K2HPO45.125 g,NaCl 0.375 g,MgSO4·7H2O 1.250 g,CaCl20.125 g,FeSO4·7H2O 0.0065 g,(NH4)2SO41.250 g,蒸馏水定容至1 L,pH 5.2;IM液体培养基:2.5×MM salts 400 mL,无水葡萄糖1.8 g,甘油5 mL,ddH2O定容到940 mL;IM固体培养基:2.5×MM salts 400 mL,无水葡萄糖0.9 g,甘油5 mL,琼脂粉14 g,ddH2O定容到940 mL;CYA培养基:NaNO32 g,K2HPO4·3H2O 1 g,KCl 0.5 g,MgSO4·7H2O 0.5 g,FeSO4·7H2O 0.01 g,蔗糖30 g,蒸馏水定容到1 L,琼脂粉按14 g·L-1分装到三角瓶,pH 7.4。
1.1.4 仪器 PCR仪,东胜龙ETC-811;DYY-11型电泳仪,北京六一仪器厂;GelDoc XR+凝胶成像分析系统,美国Bio-Rad公司;正置荧光显微镜,Olmpus BX63。
1.2 方法
2017年在本实验室优化拟轮枝镰孢突变体构建的条件并构建突变体库,2018年将随机挑选的转化子在实验室内对其进行PCR检测和荧光观察,并对其遗传稳定性、产孢量、孢子萌发率进行测定,在试验田对转化子的致病力进行测定。
1.2.1 头孢噻肟钠和氨苄青霉素钠对根癌农杆菌抑菌浓度的测定 将根癌农杆菌接种于LB液体培养基中,28℃、250 r/min振荡培养至OD600值约为0.6后,取150 μL涂布于含头孢噻肟钠/氨苄青霉素钠分别为0/0、50/50、100/100、150/150、200/200 μg·mL-1的LB培养基上培养,每个浓度设3次重复,28℃黑暗培养4 d后观察菌落生长情况,确定头孢噻肟钠/氨苄青霉素钠的抑菌浓度。
1.2.2 拟轮枝镰孢野生型对潮霉素B的敏感性试验 将在PDA培养基上28℃黑暗培养7 d的拟轮枝镰孢野生型菌株,用打孔器取相同菌龄和直径的菌饼,接种到含潮霉素B浓度分别为0、10、25、50、75、100、150 μg·mL-1的PDA培养基中央,27℃培养7 d后观察菌落生长情况,确定潮霉素B的筛选浓度,每个处理设3次重复。
1.2.3 拟轮枝镰孢突变体库的构建 参照张小飞等[25]拟轮枝镰孢ATMT转化方法,并作部分修改。将农杆菌在LB平板上(含100 μg·mL-1的利福平和卡那霉素)活化2 d,然后挑单菌落到5 mL的LB液体培养基(含100 μg·mL-1的利福平和卡那霉素)28℃、200 r/min振荡培养2 d左右。将活化后的农杆菌转移到1.5 mL的离心管中8 000 r/min离心30 s,弃上清后用IM培养基(含MES 40 mmol·L-1,AS 200 μmol·L-1)冲洗一次,然后溶于0.2 mL的IM培养基内,测定OD600,确定浓度,然后加入IM培养基,使终浓度达到OD600=0.15,29℃、200 r/min振荡培养6 h,使OD600介于0.5—0.6。将拟轮枝镰孢在PDA培养基上活化,用5 mL的IM液体培养基将其冲洗后三层擦镜纸过滤,血球计数板计数后用IM培养基稀释到终浓度 1×106cfu/mL,28℃萌发6 h。将农杆菌与拟轮枝镰孢等量混匀后取200 μL涂IM平板(已加玻璃纸),静置30 min让水分吸干后25℃共培养3 d。将玻璃纸转移到筛选培养基CYA(含头孢噻肟钠、氨苄青霉素钠和潮霉素B,浓度为1.2.1和1.2.2结果显示的最适浓度)上,培养7 d后开始挑选可能的转化子到PDA培养基(含头孢噻肟钠、氨苄青霉素钠和潮霉素B,浓度为1.2.1和1.2.2结果显示的最适浓度)进行培养。
1.2.4 转化子的PCR检测和荧光观察 用真菌基因组提取试剂盒提取拟轮枝镰孢转化子与野生型的DNA,以野生型的基因组DNA为阴性对照,质粒DNA为阳性对照,用绿色荧光蛋白特异性引物[26](Μ61:TAAACGGCCACAAGTTCA;Μ62:TGCTC GGGTAGTGGTTGT)进行PCR扩增,PCR体系为25 μL:DNA 2 μL,10 μmol·L-1上游引物和下游引物各0.5 μL,Tap Mix 12.5 μL,加ddH2O补足至25 μL。PCR反应程序:95℃ 10 min;95℃ 1 min,59℃ 30 s,72℃ 45 s,35个循环;72℃ 10 min。产物在1%的琼脂糖凝胶上电泳,染色,照相。PCR产物由北京诺赛基因组研究中心测序,测序结果在NCBI网站上进行BLASTn比对。在荧光显微镜下观察拟轮枝镰孢转化子的菌丝和孢子。
1.2.5 转化子遗传稳定性检测 随机挑选8个转化子接种到不含潮霉素B的PDA培养基上,培养5 d后转到另一不含潮霉素B的PDA培养基上,如此培养5代后,再转移到含潮霉素B(浓度根据1.2.2结果而定)的培养基上培养,观察其生长情况。
1.2.6 转化子产孢量的测定 将野生型菌株和转化子菌株分别接种到PDA培养基上,28℃黑暗培养7 d后,在菌丝表面滴加20 mL无菌水,用灭菌的载玻片轻轻刮下分生孢子,经三层擦镜纸过滤到50 mL三角瓶中,用血球计数板计分生孢子的数量。
1.2.7 转化子分生孢子萌发率的测定 取浓度为1×105个孢子/mL的孢子悬浮液200 μL到水琼脂培养基上涂布均匀,28℃黑暗培养,每2 h在显微镜下观察分生孢子的萌发率,每处理3次重复,每重复观察200个分生孢子,比较野生型菌株和转化子菌株分生孢子萌发率的差异。
1.2.8 转化子在玉米上的致病力测定 将野生型菌株和转化子菌株分别在PDA培养基上28℃培养7 d后,用无菌水冲洗培养基表面,纱布过滤后,配制成浓度为1×106个孢子/mL的孢子悬浮液,采用花丝喷雾法喷到授粉3 d(吐丝后5—7 d)后的玉米花丝上,套上人工授粉袋。收获后对发病等级进行调查,并将发病籽粒在加有潮霉素B的PDA培养基上进行病原菌分离。
2 结果
2.1 头孢噻肟钠和氨苄青霉素钠对根癌农杆菌抑菌浓度的测定
农杆菌菌液涂于含有不同浓度头孢噻肟钠/氨苄青霉素钠的LB培养基中28℃培养4 d后,在浓度为0/0、50/50、100/100 μg·mL-1的处理中均出现菌落,其他浓度无菌落出现。因此,确定头孢噻肟钠/氨苄青霉素钠浓度为150/150 μg·mL-1作为病原菌ATMT转化时农杆菌抑菌浓度。
2.2 不同浓度潮霉素B对拟轮枝镰孢野生型菌株生长的影响
拟轮枝镰孢在含不同浓度潮霉素B的PDA培养基上培养后,其生长受到不同程度的抑制(图1)。当潮霉素B的浓度为0时,拟轮枝镰孢培养7 d后菌落已覆盖全皿;10—100 μg·mL-1潮霉素B使菌株生长受到强烈抑制,而在150 μg·mL-1潮霉素B上,菌丝完全丧失生长能力,菌株死亡。因此,本研究以150 μg·mL-1潮霉素B来筛选转化子。
2.3 拟轮枝镰孢ATMT突变体库构建及转化子稳定性检测
利用1.2.3的方法进行遗传转化,获得了含有2 465株转化子的拟轮枝镰孢ATMT突变体库。转化子在不含潮霉素B的培养基上培养5代后转移到含潮霉素B的培养基上仍能正常生长,说明成功插入且稳定遗传。
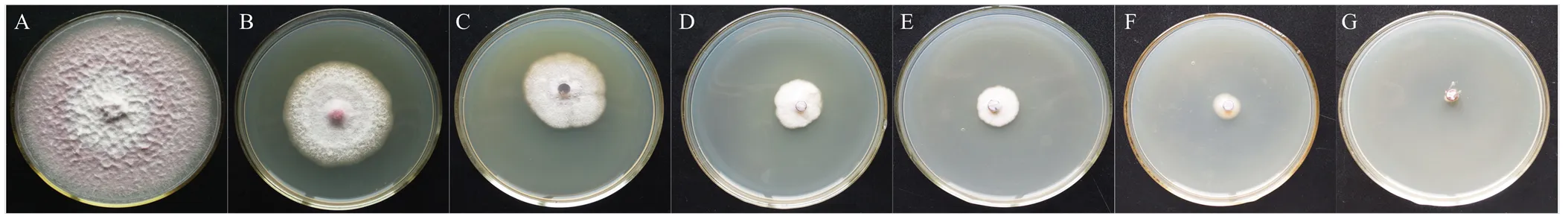
A—G: 0、10、25、50、75、100和150 μg∙mL-1潮霉素B 0, 10, 25, 50, 75, 100 and 150 μg∙mL-1 hygromycin B, respectively
从标记的拟轮枝镰孢突变体库中随机选择10株转化子进行分析,提取转化子基因组DNA,以绿色荧光蛋白特异引物进行PCR检测,以质粒载体为阳性对照,以野生型菌株DNA为阴性对照。结果如图2所示,转化子和质粒载体均能扩增出条带大小为550 bp左右的片段,而野生型菌株未扩出条带,表明这些转化子基因组中确实含有基因序列。将PCR产物测序结果在NCBI网站上BLAST比对,与(登录号:LC420351.1)的同源性为99.26%,再次表明已成功转移到野生型菌株基因组DNA中。
2.4 转化子的荧光观察
因ATMT转化使用的载体含有,如果为阳性转化子,在荧光显微镜下应能观测到绿色荧光。将转化子和野生型菌株分别在荧光显微镜下观察,转化子的菌丝和孢子均可观察到绿色荧光,而野生型菌株未观察到任何荧光,说明已经将转移到拟轮枝镰孢野生型菌株基因组中,且能够成功表达(图3)。
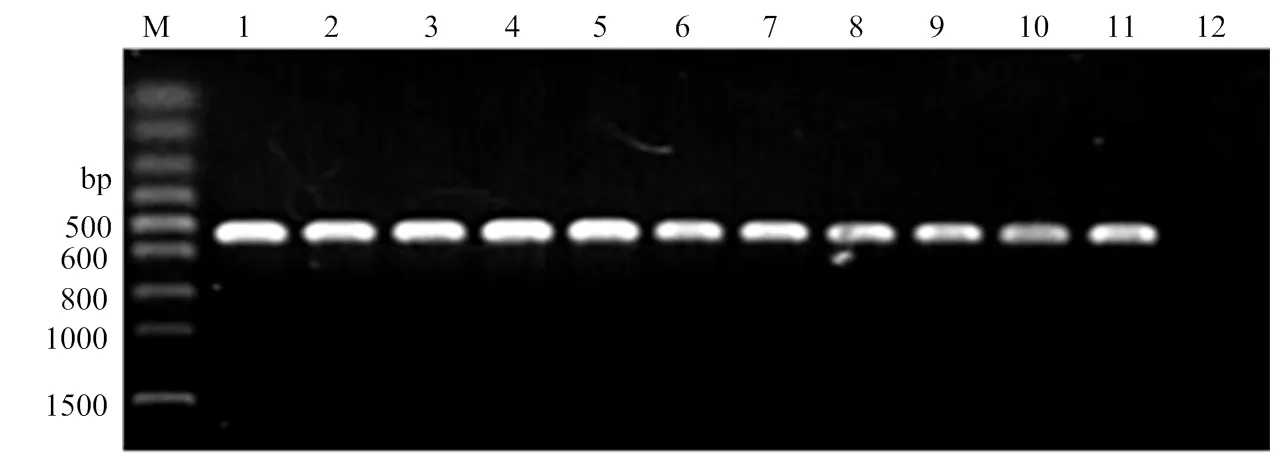
M:100 bp Ladder;1:阳性对照 Positive control;2—11:转化子Transformants;12:阴性对照Negative control
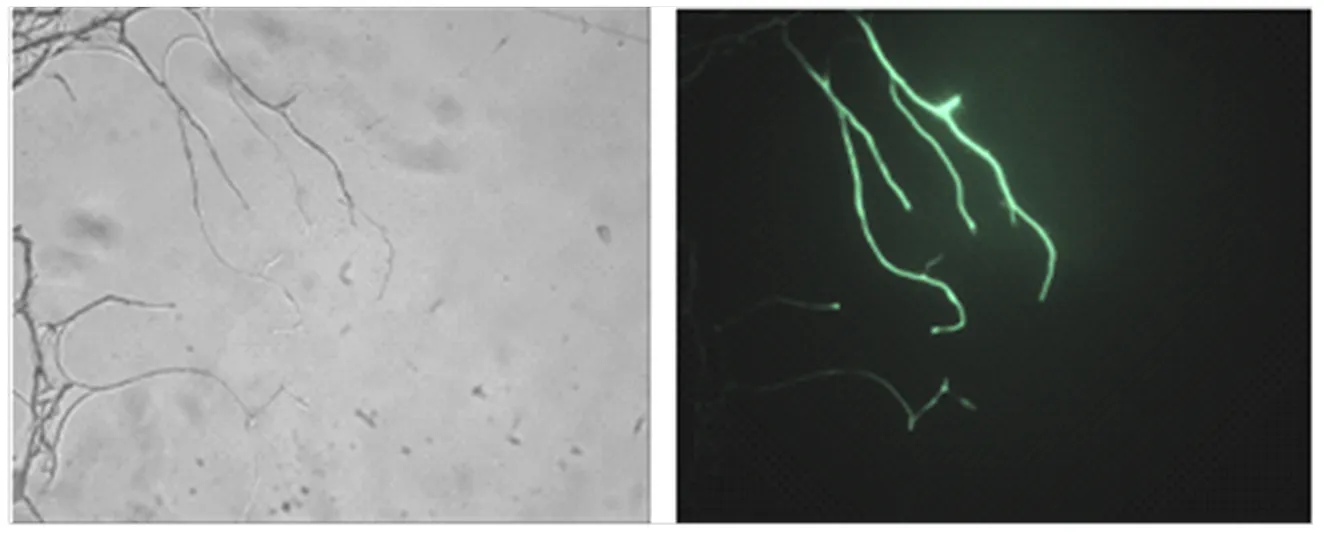
图3 GFP在拟轮枝镰孢中的表达
2.5 转化子产孢量的测定
通过对9种转化子和野生型菌株进行产孢量的测定,转化子54产孢量明显增多,约为野生型菌株的1.9倍;转化子13、24、49产孢量明显减少,约为野生型菌株的60%—70%(图4)。
2.6 转化子分生孢子萌发率的测定
对分生孢子萌发率进行观测(图5),培养6 h时转化子24、48的孢子萌发率不足20%,其他菌株的萌发率在50%左右,萌发率在培养6 h后有大幅度的上升,14 h后,转化子24的孢子萌发率为96.67%,其他菌株均完全萌发。
2.7 转化子在玉米上的致病力测定
为了验证转化子的致病力,对野生型菌株和5株转化子进行了致病力测定。结果表明,转化子13的致病力比野生型菌株强,病害级别达到9级,野生型菌株和转化子24表现出较强的致病力,病害级别达到5—7级;转化子33和16致病力较弱,病害级别为3级,转化子4的致病力最弱,病害级别为1级(图6);对发病籽粒进行病原菌分离纯化及荧光观察,结果显示病原菌仍为携带绿色荧光蛋白基因的拟轮枝镰孢。
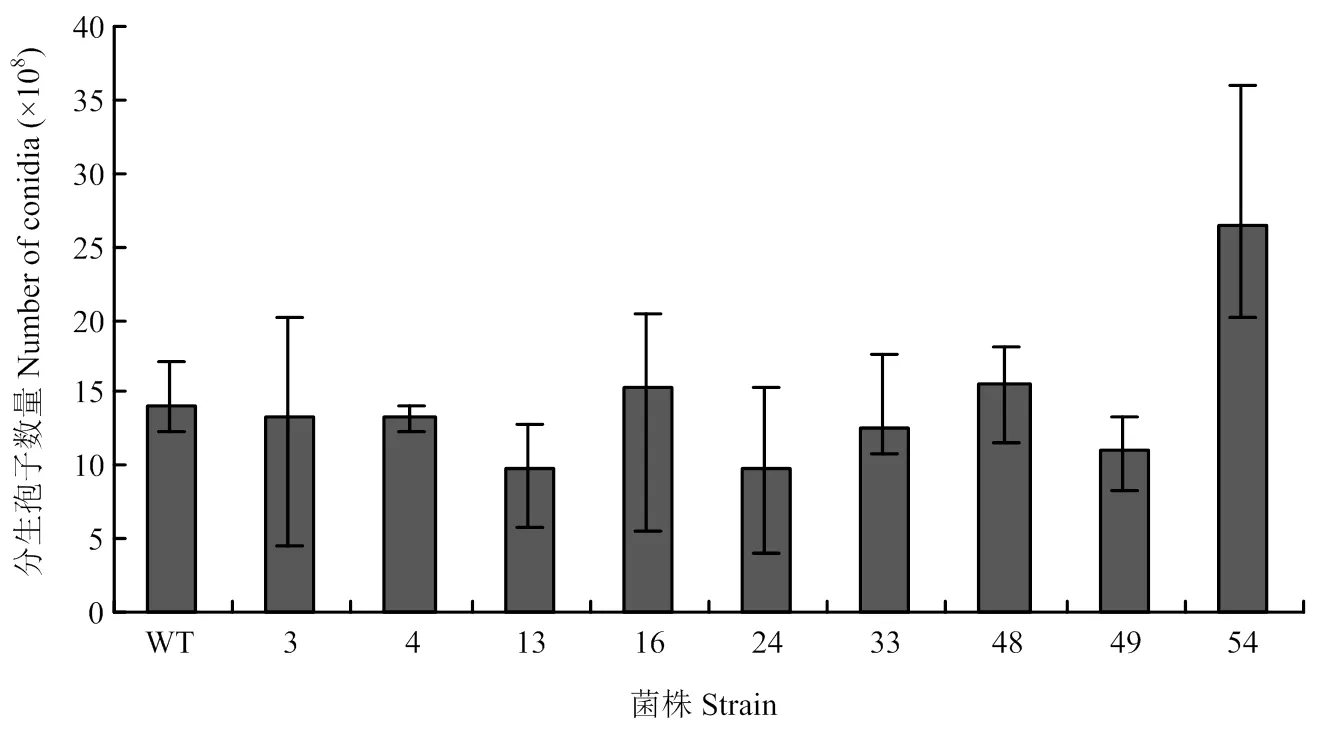
图4 部分拟轮枝镰孢转化子和野生型菌株产孢量比较
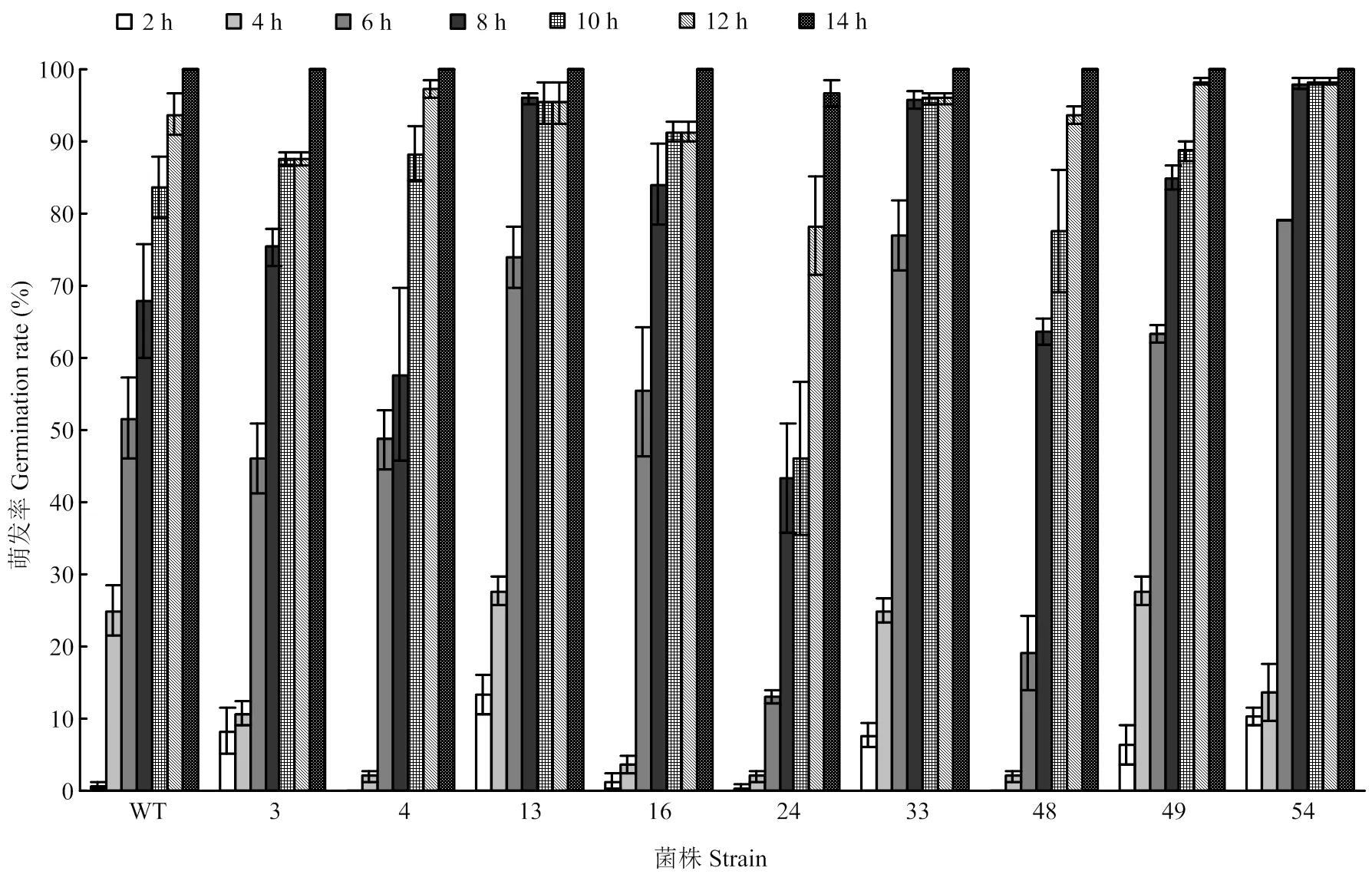
图5 部分拟轮枝镰孢转化子和野生型菌株孢子萌发率的比较
3 讨论
微生物遗传转化方法包括PEG-CaCl2介导的原生质体转化、基因枪法、电激法、农杆菌介导的ATMT转化等。其中农杆菌介导的ATMT转化方法以其操作简单、转化效率高、遗传稳定性好等优点被广泛应用到丝状真菌的研究中,因该技术获得的转化子多为T-DNA单拷贝插入,适于突变体库的构建[27]。目前,该方法已经应用到黑曲霉()、稻瘟病菌()和尖镰孢()等100多种丝状真菌中[28-30]。
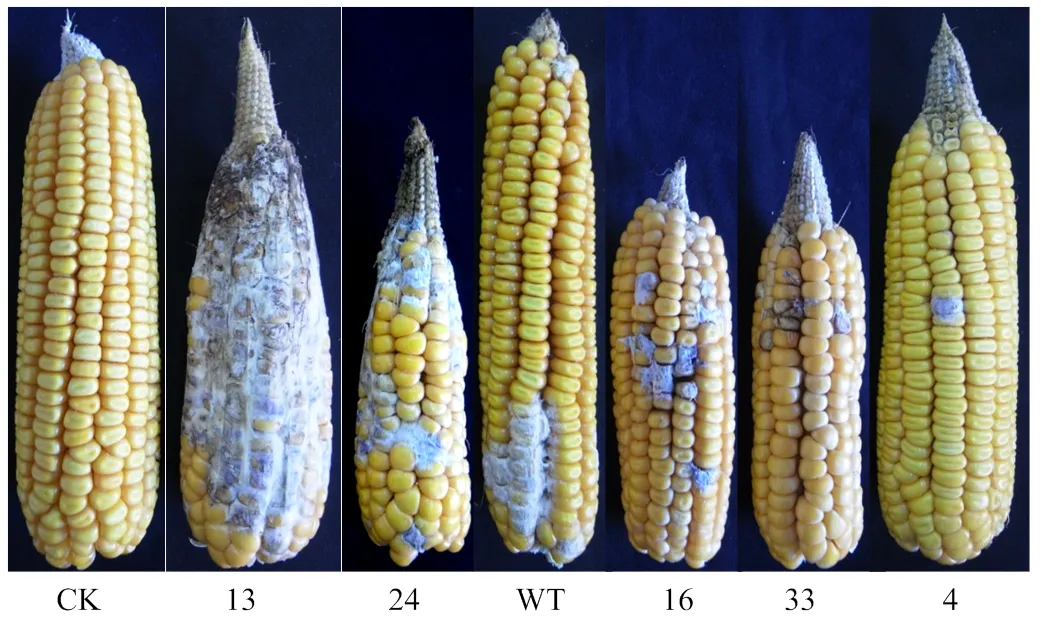
图6 部分拟轮枝镰孢转化子和野生型菌株的致病力测定
绿色荧光蛋白标记技术已广泛应用到病原菌与宿主的互作研究中,其可以直观、实时检测病原菌在宿主内的附着、侵染和定殖过程[31]。目前,国内外利用成功标记了尖镰孢、水稻纹枯病菌()、尖孢炭疽菌()和新月弯孢()等多种真菌[30-33]。
拟轮枝镰孢能够侵染玉米的穗、茎、根等,从而引起玉米穗腐病、茎腐病和根腐病等。吴磊等[34]利用红色荧光蛋白基因()和对引起玉米根腐病的拟轮枝镰孢进行标记,并观察了标记的拟轮枝镰孢在玉米根部的定殖和生长规律;盖晓彤[35]用标记的拟轮枝镰孢接种玉米,以明确拟轮枝镰孢引起玉米茎腐病和穗腐病的关系。拟轮枝镰孢是引起玉米穗腐病的主要病原菌,本研究通过测定头孢噻肟钠和氨苄青霉素钠对根癌农杆菌抑菌浓度,拟轮枝镰孢对潮霉素B敏感浓度的优化,得出头孢噻肟钠和氨苄青霉素钠对根癌农杆菌的最适抑菌浓度为150/150 μg·mL-1,拟轮枝镰孢对潮霉素B的敏感浓度为150 μg·mL-1。利用ATMT转化法成功地将插入到拟轮枝镰孢的基因组中,并通过荧光显微镜观察和PCR分子检测,获得遗传稳定、标记的拟轮枝镰孢突变体库,为拟轮枝镰孢与玉米果穗间互作机制的研究提供了条件。
通过对野生型和随机挑选的突变体菌株进行产孢量、孢子萌发率、致病力测定,发现了与野生型菌株存在明显差异的转化子菌株,但大多数转化子与野生型菌株间没有明显差异。这与玉米大斑病菌、玉米弯孢叶斑病菌的转化子与野生型菌株间大多数无明显差异,少数存在差异的研究结果是一致的[36-37]。这一结果与T-DNA随机整合到基因组中的性质有关,为获得致病力弱或无致病力的菌株提供了可能。目前,笔者实验室正在进一步扩大拟轮枝镰孢ATMT突变体库,以期获得致病力变异的转化子,为研究拟轮枝镰孢在花丝上的侵染过程和致病的分子机理打下基础。
4 结论
优化了拟轮枝镰孢的ATMT转化体系,获得了含有2 465株转化子的绿色荧光蛋白标记且稳定遗传的拟轮枝镰孢突变体库,随机选取部分转化子进行分析,获得了产孢量、孢子萌发率、致病力发生变化的突变体,为进一步研究拟轮枝镰孢侵染玉米果穗的途径和致病的分子机制打下了基础。
[1] 丘卓秋, 吴海燕, 龙彦蓉. 玉米孢囊线虫发生危害和生物学研究进展. 植物保护, 2017, 43(4): 16-20.
QIU Z Q, WU H Y, LONG Y R. Research progress in the occurrence and biology of., 2017, 43(4): 16-20. (in Chinese)
[2] ORTIZ C S, RICHARDS C, TERRY A, PARRA J, SHIM W B. Genetic variability and geographical distribution of mycotoxigenicstrains isolated from maize fields in texas., 2015, 31(2): 203-211.
[3] Duan C X, Qin Z H, Yang Z H, Li W X, Sun S L, Zhu Z D, Wang X M. Identification of pathogenicspp. causing maize ear rot and potential mycotoxin production in China., 2016, 8(6): 186.
[4] LANUBILE A, BERNARDI J, MAROCCO A, LOGRIECO A, PACIOLLA C. Differential activation of defense genes and enzymes in maize genotypes with contrasting levels of resistance to., 2012, 78: 39-46.
[5] ZHOU D N, Wang X M, CHEN G K, Sun S L, YANG Y, Zhu Z D, Duan C X. The majorspecies causing maize ear and kernel rot and their toxigenicity in Chongqing, China., 2018, 10(2): 90.
[6] PROCTOR R H, BROWN D W, PLATTNER R D, DESJARDINS A E. Co-expression of 15 contiguous genes delineates a fumonisin biosynthetic gene cluster in., 2003, 38(2): 237-249.
[7] KIM H, WOLOSHUK C P. Role of, a regulator of nitrogen metabolism, during colonization of maize kernels and fumonisin biosynthesis in., 2008, 45(6): 947-953.
[8] MYUNG K, ZITOMER N C, DUVALL M, GLENN A E, RILEY R T, CALVO A M. The conserved global regulator VeA is necessary for symptom production and mycotoxin synthesis in maize seedlings by., 2012, 61(1): 152-160.
[9] BLUHM B H, KIM H, BUTCHKO R A E, WOLOSHUK C P. Involvement ofofin kernel colonization and the regulation of, a putative sugar transporter gene required for fumonisin biosynthesis on maize kernels., 2008, 9(2): 203-211.
[10] CHOI Y E, SHIM W B. Functional characterization of, a gene encoding a putative protein phosphatase 2A catalytic subunit., 2008, 154(1): 326-336.
[11] 孙华, 郭宁, 石洁, 张海剑, 马红霞, 刘树森. 海南玉米穗腐病病原菌分离鉴定及优势种的遗传多样性分析. 植物病理学报, 2017, 47(5): 577-583.
SUN H, GUO N, SHI J, ZHANG H J, MA H X, LIU S S. Characterization of the maize ear rot pathogens and genetic diversity analysis of dominant species in Hainan., 2017, 47(5): 577-583. (in Chinese)
[12] 任旭. 我国玉米穗腐病主要致病镰孢菌多样性研究[D]. 北京: 中国农业科学院, 2011.
REN X. Diversity analyses ofspp., the main causal agents of maize ear rot in China[D]. Beijing: Chinese Academy of Agricultural Sciences, 2011. (in Chinese)
[13] 李晓鸯, 马周杰, 盖晓彤, 汪浩德, 姚远, 孙艳秋, 高增贵. 东北地区玉米穗腐镰孢菌种类鉴定及拟轮枝镰孢菌遗传多样性. 沈阳农业大学学报, 2018, 49(2): 136-142.
LI X Y, MA Z J, GAI X T, WANG H D, YAO Y, SUN Y Q, GAO Z G. Identification ofspecies causing maize ear rot in northeast China and the diversity of., 2018, 49(2): 136-142. (in Chinese)
[14] 隋韵涵, 肖淑芹, 董雪, 薛春生, 陈捷. 九种杀菌剂对和毒力及玉米穗腐病的防治效果. 玉米科学, 2014, 22(2): 145-149.
SUI Y H, XIAO S Q, DONG X, XUE C S, CHEN J. Toxicity and field control effect of nine fungicides againstear rot., 2014, 22(2): 145-149. (in Chinese)
[15] HEADRICK J M, PATAKY J K. Maternal influence on the resistance of sweet corn lines to kernel infection by., 1991, 81(3): 268-274.
[16] MUNKVOLD G P, CARLTON W M. Influence of inoculation method on systemicinfection of maize plants grown from infected seeds., 1997, 81(2): 211-216.
[17] ALESSANDRA L, LUCA P, ADRIANO M. Differential gene expression in kernels and silks of maize lines with contrasting levels of ear rot resistance afterinfection., 2010, 167(16): 1398-1406.
[18] LESLIE J F, PEARSON C A S, NELSON P E, TOUSSOUN T A.spp. from corn, sorghum, and soybean fields in the central and eastern United States., 1990, 80(4): 343-350.
[19] OREN L, EZRATI S, COHEN D, SHARON A. Early events in the-maize interaction characterized by using a green fluorescent protein-expressing transgenic isolate., 2003, 69(3): 1695-1701.
[20] DASTJERDI R, KARLOVSKY P. Systemic infection of maize, sorghum, rice, and beet seedlings with fumonisin-producing and nonproducingstrains., 2015, 31(4): 334-342.
[21] 陈东亮, 李纪元, 范正琪, 范妙华. 根癌农杆菌介导真菌遗传转化的影响因素及应用. 安徽农业科学, 2010, 38(7): 3317-3320.
CHEN D L, LI J Y, FAN Z Q, FAN M H. Influencing factors of genetic transformation in fungi mediated byand its application., 2010, 38(7): 3317-3320. (in Chinese)
[22] 黄亚丽. 农杆菌介导哈茨木霉转化系统优化及突变体分析[D]. 北京: 中国农业科学院, 2008.
HUANG Y L. The optimization ofmediatedtransformation system and analysis of T-DNA insertional mutants[D]. Beijing: Chinese Academy of Agricultural Sciences, 2008. (in Chinese)
[23] 王梅娟, 李坡, 吴敏, 范永山, 谷守芹, 董金皋. 玉米大斑病菌ATMT突变体库的构建及其分析. 中国农业科学, 2012, 45(12): 2384-2392.
WANG M J, LI P, WU M, FAN Y S, GU S Q, DONG J G. Construction and evaluation of ATMT mutant library of., 2012, 45(12): 2384-2392. (in Chinese)
[24] 许苗苗, 苏前富, 李丽娜, 渠清, 贾娇, 曹志艳, 董金皋. 青色荧光蛋白标记的禾谷镰孢转化子的构建. 微生物学通报, 2018, 45(10): 2191-2199.
XU M M, SU Q F, LI L N, QU Q, JIA J, CAO Z Y, DONG J G. Construction of-labeledtransformants., 2018, 45(10): 2191-2199. (in Chinese)
[25] 张小飞, 李晓, 崔丽娜, 邹成佳, 彭云良, 杨晓蓉. 轮枝镰孢菌的绿色荧光蛋白基因标记. 西南农业学报, 2014, 27(6): 2374-2376.
ZHANG X F, LI X, CUI L N, ZOU C J, PENG Y L, YANG X R. Green fluorescent protein gene transformation on., 2014, 27(6): 2374-2376. (in Chinese)
[26] 吴磊. 轮枝镰孢的荧光标记及其在寄主-病原菌互作中的应用[D]. 秦皇岛: 河北科技师范学院, 2011.
WU L. Fluorescence labelling ofand its application in study of host-fungus interaction[D]. Qinhuangdao: Hebei Normal University of Science and Technology, 2011. (in Chinese)
[27] 赵培宝, 任爱芝, 胡明江, 张秀省, 陈蕾蕾, 宋晓妍, 石梅. 农杆菌介导的拟康氏木霉遗传转化及T-DNA插入突变体的筛选. 植物保护, 2010, 36(6): 74-76.
ZHAO P B, REN A Z, HU M J, ZHANG X S, CHEN L L, SONG X Y, SHI M.-mediated transformation ofSMF2 and isolation of the T-DNA insertion mutant., 2010, 36(6): 74-76. (in Chinese)
[28] 刘玲, 张鸿飞, 张岚, 秦郦, 王德培. 黑曲霉高效敲除体系构建及基因的敲除. 食品研究与开发, 2018, 39(22): 124-130.
LIU L, ZHANG H F, ZHANG L, QIN L, WANG D P. Construction of high efficient gene knockout system inand knockout of trehalose-6-phosphate synthase., 2018, 39(22): 124-130. (in Chinese)
[29] 张俊华, 刘烨, 韩雨桐, 潘春清, 王中业, 张淋淋, 崔凯旋. 农杆菌介导稻瘟病菌绿色荧光蛋白()遗传转化研究. 东北农业大学学报, 2014, 45(11): 1-7.
ZHANG J H, LIU Y, HAN Y T, PAN C Q, WANG Z Y, ZHANG L L, CUI K X.genetic transformation ofmediated by., 2014, 45(11): 1-7. (in Chinese)
[30] 李春强, 梁慧施, 夏亦荠, 彭明. GFP标记的尖孢镰刀菌西瓜专化型侵染西瓜过程观察. 热带作物学报, 2011, 32(10): 1935-1939.
LI C Q, LIANG H S, XIA Y J, PENG M. Observation of the infection process of watermelon byf. sp.using the GFP marker., 2011, 32(10): 1935-1939. (in Chinese)
[31] 张俊华, 牟明, 常浩, 李云鹏, 范琳, 钟庆燕, 潘春清, 邹徳堂. 根癌农杆菌介导基因转化水稻纹枯病菌及其对病原菌稳定性和致病力的影响. 东北农业科学, 2016, 41(6): 67-74.
ZHANG J H, MU M, CHANG H, LI Y P, FAN L, ZHONG Q Y, PAN C Q, ZOU D T.-mediated transformation ofgene and its effects on stability and pathogenicity for., 2016, 41(6): 67-74.(in Chinese)
[32] 林春花, 刘先宝, 蔡吉苗, 李超萍, 李继锋, 黄贵修. 橡胶树尖孢炭疽菌绿色荧光蛋白()标记转化株的获得. 热带作物学报, 2009, 30(10): 1495-1500.
LIN C H, LIU X B, CAI J M, LI C P, LI J F, HUANG G X.tagged transformants generated from-mediated insertional mutagenesis., 2009, 30(10): 1495-1500. (in Chinese)
[33] 陈茂功. 玉米弯孢叶斑病菌的荧光标记及其对玉米侵染过程的研究[D]. 秦皇岛: 河北科技师范学院, 2012.
CHEN M G. Fluorescence labeling ofand its infection in maize[D]. Qinhuangdao: Hebei Normal University of Science and Technology, 2012. (in Chinese)
[34] 吴磊, 李洪杰, 王晓鸣, 朱振东, 段灿星, 武小菲. 农杆菌介导的轮枝镰孢和遗传转化及转化子特性分析//中国植物病理学会2010年学术年会论文集, 2010: 117.
WU L, LI H J, WANG X M, ZHU Z D, DUAN C X, WU X F.-mediated transformation ofandand characterization of transformants in//, 2010: 117. (in Chinese)
[35] 盖晓彤. 玉米茎腐病与穗腐病致病镰孢菌侵染途径及其致病力差异研究[D]. 沈阳: 沈阳农业大学, 2018.
GAI X T. Studies on the infection pathway and pathogenic difference offrom stalk rot and ear rot on maize[D]. Shenyang: Shenyang Agricultural University, 2018. (in Chinese)
[36] 张娇, 谷守芹, 李青为, 韩建民, 董金皋. 根癌农杆菌介导的玉米大斑病菌转化条件的优化. 河北农业大学学报, 2010, 33(4): 85-88, 108.
ZHANG J, GU S Q, LI Q W, HAN J M, DONG J G. Optimization of factors affecting genetic transformation ofvia., 2010, 33(4): 85-88, 108. (in Chinese)
[37] 倪璇, 姜雪, 李雅乾, 陈捷. 玉米弯孢叶斑病菌ATMT突变株构建及致病力分析. 中国生物工程杂志, 2016, 36(1): 23-28.
NI X, JIANG X, LI Y Q, CHEN J. Construction and pathogenicity analysis of ATMT mutant of., 2016, 36(1): 23-28. (in Chinese)
Construction and Evaluation of ATMT Mutant Library of
SUN Hua, MA HongXia, DING MengJun, LI Po, SHI Jie, LIU ShuSen
(Plant Protection Institute, Hebei Academy of Agricultural and Forestry Sciences/Key Laboratory of IPM on Crops in Northern Region of North China, Ministry of Agriculture/IPM Centre of Hebei Province, Baoding 071000, Hebei)
【Objective】The objective of this study is to establish a highly efficient ATMT mutagenesis system of, and to construct ATMT mutant library in which mutant contains green fluorescent protein (GFP). And then this library was used for screening and analysis, which can lay a foundation for studying the infection pathway and molecular pathogenesis ofon maize ear. 【Method】The inhibitory concentration of cefotaxime sodium (Cefo) and ampicillin sodium (Amp) againstAGL-1 and the sensitive concentration of hygromycin B againstwere screened for ATMT mutagenesis system. A shuttle plasmid containingand hygromycin phosphotransferase () genes was used as a vector to construct the ATMT mutants library of. The T-DNA insertion and stability of transformant were detected and analyzed through hygromycin B resistance, PCR identification of-specific primers, and fluorescence microscopy. Nine transformants were randomly selected and the sporulation number, conidial germination rate, and pathogenicity were measured. 【Result】When the concentration of Cefo/Amp was 150/150 μg·mL-1, the growth of AGL-1 was inhibited, and when the concentration of hygromycin B was 150 μg·mL-1, the growth ofwas completely incapacitated. Using the optimized ATMT, a total of 2 465-labeled transformants were obtained, these transformants could still grow normally on PDA medium containing hygromycin B after cultured 5 generations on hygromycin-free PDA medium, which indicated thathad been integrated into wild-type (WT) genome ofand the transformants were stable in their characteristics of genetics. The PCR detection results amplified with-specific primers showed that the homology of transformants with(accession number: LC420351.1) in NCBI was 99.26%, and the hyphae and conidia of transformants showed green fluorescence under the fluorescence microscope, while no fluorescence was observed in WT, indicating thathad been integrated into the WT genome and successfully expressed. Compared with WT strain, the sporulation number of transformant 54 increased significantly, about 1.9 times of that of WT strain, and the conidial germination rate of transformant 24 decreased obviously in the same time. The pathogenicity of transformant 13 was enhanced, the disease grade reached 9, the pathogenicity of transformant 33 and 16 was reduced to grade 3, and the pathogenicity of transformant 4 was the weakest, the disease grade was 1. There was no significant change in biological characters of partial transformants.【Conclusion】ATMT mutant library withofwas constructed, and the mutants with changed sporulation number, conidia germination rate and pathogenicity were obtained through primarily screening. It will lay a foundation for further study on the infection pathway and pathogenic molecular mechanisms ofon maize ear in the future.
maize;; ATMT; mutant library; green fluorescent protein; transformant
10.3864/j.issn.0578-1752.2019.08.008
2018-11-26;
2019-01-15
国家自然科学基金青年科学基金(31601590)
孙华,E-mail:1550416593@qq.com。 通信作者 李坡,Tel:0312-5915682;E-mail:lipo-0524@163.com。通信作者石洁,Tel:0312-5915682;E-mail:shij99@163.com
(责任编辑 岳梅)
