大鼠青光眼应激模型中视网膜神经节细胞PTEN基因表观遗传修饰及表达的影响*
2019-05-07杨静史贻玉沈沛阳陈海波朱明月李伟
杨静, 史贻玉△, 沈沛阳, 陈海波, 朱明月, 李伟
1中山大学中山眼科中心海南眼科医院(海南省眼科医院)、海南省眼科学重点实验室(一病区)(海南海口 570311) ; 2海南医学院基础医学院(海南海口 570102)
青光眼主要以视网膜神经节细胞凋亡为主,导致视神经乳头发生损伤,进行性视野缺失为主要特征的不可逆性病变,已经成为全球第一不可逆致盲性眼病[1]。而在青光眼发生中眼压升高则是主要危险因素。目前,临床上对于青光眼发病机制尚不完全知晓,主要以降低眼压、保护视神经为主[2-3]。部分患者尽管眼压已经得到有效的控制并使用视神经保护药物,但是视功能损害仍在继续。因此,加强青光眼发病机制、治疗方法研究具有重要的临床意义[4-5]。2015年6月至2017年12月本文主要选择清洁级雌性Wistar大鼠30只作为对象,探讨大鼠青光眼应激模型中视网膜神经节细胞PTEN基因表观遗传修饰及表达的影响,报告如下。
1 材料与方法
1.1 实验动物 选择清洁级雌性Wistar大鼠30只作为对象,随机数字法分为正常对照组10只、模型组10只、模型+药物干预组(甲钴胺处理)10只。30只Wistar大鼠体重86~95 g,平均(90.35±0.83)g,所选动物均由医学动物实验中心提供。Wistar大鼠常规饲养,自由摄食、饮水,光照12 h,建模前12 h禁食,实验均通过医院动物委员会批准同意。
1.2 主要仪器和试剂 通用型SP免疫组化检测试剂盒、DAB Kit酶底物显色试剂盒、白洋 G16 型台式高速离心机、中性树胶、石蜡切片机(LEICA-RM2235 型)、光学显微镜及Msho数字成像系统、生物组织摊烤片机及PCR仪等。见表1。
1.3 方法
1.3.1 动物模型建立及处理方法 (1)动物模型建立[6-7]。除正常对照组外,其余大鼠均建立大鼠青光眼应激模型,右眼为诱导高眼压眼,左眼为对照眼。大鼠腹腔内注射10%水合氯醛(0.2~0.3 mL/100 g)全身麻醉,沿角膜缘剪开上方和外侧球结膜,分离上直肌两侧或下方的2支和外直肌一侧或下方的1支巩膜上静脉,烧灼巩膜上静脉,缝合球结膜。术前、术后1周内每天,1月内隔天,1月后2次/周用Tono-penXL笔式眼压计测量眼压,每只大鼠测量5次,取平均值[8-9]。(2)处理方法。建模完成后模型组不采取任何措施处理,正常对照组不参与建模,模型组+药物干预组建模成功后采用甲钴胺进行处理,两组均干预11周[3]。
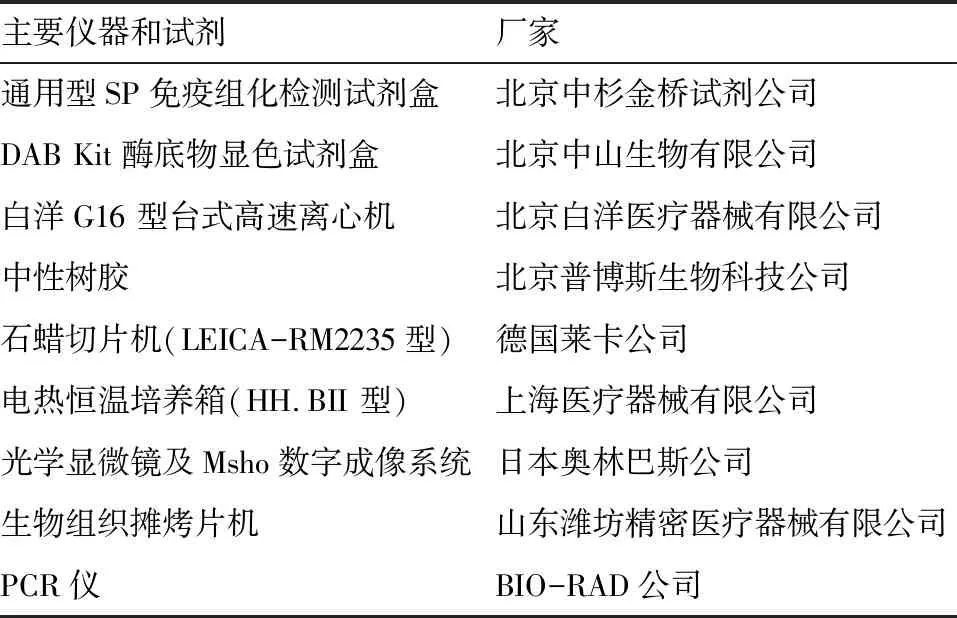
表1 主要仪器和试剂
1.3.2 凋亡小体、caspase-3、PTEN细胞定位和PTEN表达 (1)凋亡小体、caspase-3、PTEN细胞定位。处死大鼠,摘取眼球,分离视神经节细胞(RGCs)用4%多聚甲醛固定,利用DAPI和PITC染色,荧光镜观察凋亡小体、caspase-3、PTEN细胞定位[10]。(2)PTEN表达。①测定方法。采用免疫组织化学观察PTEN的表达。取大鼠眼部组织,制备细胞切片,向切片组织中放入1份30.0%H2O2及10份蒸馏水,加入内源性酶常温下灭火10 min,采用蒸馏水连续洗涤3次。将切片放置在枸橼酸盐缓冲液中,调节溶液pH值为6.0,利用电炉加热,煮沸后间隔5 min再次煮沸,反复2次,常温下冷却后加入PBS洗涤2次,常温下加入浓度5%BSA封闭液,甩去多余液体后加入一滴PTEN蛋白(稀释浓度为1∶ 100)单克隆抗体,采用PBS 洗涤3次,每次 2 min。采用DBA显色试剂盒中在1 mL底物中加入1滴PTEN蛋白二抗,混合均匀后制备DBA工作液,常温下显色,完毕后利用苏木素复染、脱水、透明后封片,倒置显微镜下观察阳性细胞数量占总细胞数量的比例,每个标本测定3次,取平均值[11]。②判定方法。以细胞膜和(或)细胞质中出现棕黄色颗粒或团状视为阳性。参考奥尔雷德评分标准从细胞阳性数(1~4分)及染色强度(0~12分)进行判断,得分越高,阳性率越高。评定时每个标本连续测定3次,在200倍光镜下取5个视野,取平均值。
1.3.3 PTEN和AKT(Ser473)表达量 采用Western blot分析RGCs的PTEN和AKT(Ser473)表达量。各组大鼠处理完毕后杀死大鼠并取球囊区血管组织完成蛋白提取;各区总蛋白20 μg进行Western blot分析,一抗比例设定为1∶ 500、二抗比例设定为1∶ 1 000,采用β-actin作为内参照,完成 PTEN和AKT(Ser473)表达量测定[12-13]。
1.3.4 大鼠青光眼模型RGCs的PTEN基因表观遗传修饰的改变 制备大鼠青光眼模型(压力和血液流动改变)→在外科手术处理造模后的1、3、5、7、9、11周的时间点处死大鼠→摘取眼球→分离RGCs→组织分为两份,其中一份检测PTEN的表达;另外一份用4%多聚甲醛固定→分离组织DNA,用特异性甲基化-PCR检测PTEN基因启动子甲基化状况→用固定的组织作ChIP检测RGCs的PTEN基因启动子组蛋白(H3K9或H4K8)的乙酰化状态→分析各组大鼠RGCs的PTEN基因表观遗传修饰的差异[14]。
1.4 统计学处理 采用SPSS 18.0软件处理,计数资料行2检验,采用n(%)表示,计量资料行t检验,采用表示,P<0.05为差异有统计学意义。
2 结果
2.1 3组处理后不同时间点双眼眼压变化及RGCs凋亡率比较 模型组及模型+药物干预组大鼠行右眼巩膜上静脉烧灼后,成功建立高眼压模型,眼压高于正常对照组及对照眼,见表1。模型+药物干预组与正常对照组处理后1、3、5、7、9、11周RGCs凋亡率比较差异无统计学意义(P>0.05);模型+药物干预组处理后1、3、5、7、9、11周RGCs凋亡率低于模型组(P<0.05)。见表2。


时间点正常对照组模型组模型+药物干预组IOP右IOP左IOP右IOP左IOP右IOP左术前11.04±1.8913.21±1.7012.44±1.5613.01±1.6710.99±2.1311.67±1.56术后1周12.45±2.0911.13±1.9829.87±1.9011.52±1.8428.23±1.7811.72±1.86术后3周10.98±1.9112.64±1.8527.67±1.8710.98±1.9127.86±1.3412.45±2.09术后5周13.56±1.7910.78±2.0625.78±1.5612.43±1.4525.67±1.3613.21±1.70术后7周11.78±2.6511.72±1.8623.85±1.9011.13±1.9824.78±1.4510.98±1.94术后9周12.43±1.4510.98±1.9423.45±1.4512.64±1.8523.48±1.3913.56±1.79术后11周11.52±1.8413.32±1.8823.32±2.1512.45±2.0923.04±1.9512.64±1.85
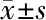
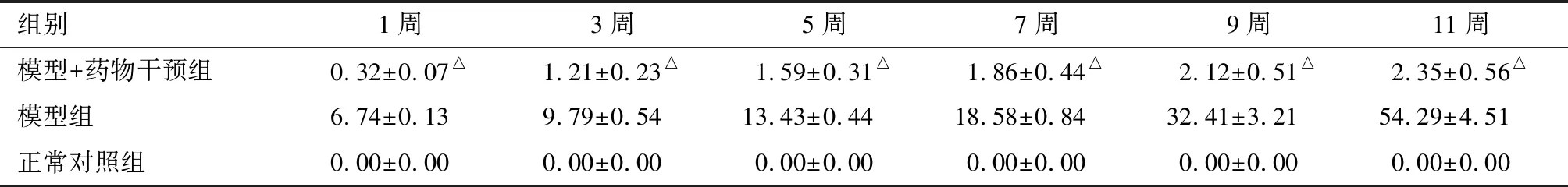
组别1周3周5周7周9周11周模型+药物干预组0.32±0.07△1.21±0.23△1.59±0.31△1.86±0.44△2.12±0.51△2.35±0.56△模型组6.74±0.139.79±0.5413.43±0.4418.58±0.8432.41±3.2154.29±4.51正常对照组0.00±0.000.00±0.000.00±0.000.00±0.000.00±0.000.00±0.00
△与模型组比较P<0.05
2.2 3组大鼠PTEN阳性率比较 模型+药物干预组与正常对照组PTEN阳性率差异无统计学意义(P>0.05),低于模型组(P<0.05)。见表3。

表3 3组大鼠PTEN阳性率比较 只(%)
*与模型+药物干预组比较P<0.05
2.3 3组PTEN和AKT(Ser473)表达量比较 Western blot结果表明:模型+药物干预组PTEN表达量低于模型组和正常对照组(P<0.05);模型+药物干预组AKT(Ser473)表达量高于正常对照组(P<0.05),低于模型组(P<0.05)。见图2。
2.4 3组大鼠PTEN基因启动子组蛋白(H3K9或H4K8)比较 模型+药物干预组PTEN基因启动子组蛋白阳性率与正常对照组比较差异无统计学意义(P>0.05),均高于模型组(P<0.05)。见表4。

A:正常对照组;B:模型组;C:模型+药物干预组
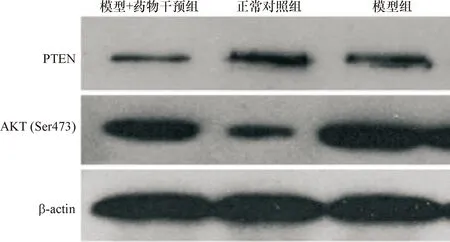
图2 3组PTEN和AKT(Ser473)表达量比较

表4 3组大鼠PTEN基因启动子组蛋白(H3K9或H4K8)比较 例(%)
△与模型组比较P<0.05
3 讨论
青光眼是以视乳头凹陷、视野缺损及视力下降为共同特征的疾病,以病理性眼压增高、视神经供血不足为发病的原发危险因素。同时,青光眼的发生、发展还与视神经对于压力损害的耐受性有关,成为人类失明的三大致盲眼病之一[15-16]。目前,临床上对于青光眼缺乏有效的治疗方法,常规方法以眼压控制、神经营养治疗为主,虽然能改善患者症状,但是失明率较高,导致患者预后较差。
目前,临床上对于青光眼致盲机制尚不完全知晓,其眼内损伤主要以视乳头生理凹陷扩大、RGCs凋亡等为主要特征,且临床上常见学说包括:传统机械学说、缺血学说及两者的混合学说等均无法完全解释青光眼的视神经损害机制。国内学者[17]研究表明:青光眼性视神经病变中RGCs的死亡主要由RGCs凋亡引起,而RGCs凋亡涉及到细胞内的调节凋亡相关的基因的表达。本研究中,模型组+药物干预组处理后1、3、5、7、9、11周RGCs凋亡率,低于模型组(P<0.05)。由此看出:大鼠青光眼应激模型建立过程中加强药物干预有助于降低RGCs细胞凋亡率。国内学者研究结果显示:建模后给予药物干预能对PTEN表观遗传、修饰产生明显的影响,能降低RGCs细胞凋亡率,从而延缓抑制RGCs细胞增殖、生长及迁移。(1)PTEN能阻断PI3K途径能降低RGCs细胞凋亡率,当PTEN水平下调时,PIP3去磷酸化为PIP2,降低RGCs细胞凋亡率[18]。(2)PTEN基因表观遗传及修饰发生变化后能影响血小板源性生长因子诱导的P70、AKt及糖原合成,从而能抑制基质与PGGF介导的RGCs细胞凋亡;(3)抑制细胞跨越G1-S限制点,抑制基质金属蛋白酶-9表达水平,降低RGCs细胞凋亡率。本研究中,模型组+药物干预组与正常对照组PTEN阳性率差异无统计学意义(P>0.05),低于模型组(P<0.05)。国内学者研究表明: PTEN能抑制化学黏度蛋白-1、肿瘤坏死因子等延缓病情发展,延缓青光眼病情发展。同时,PTEN能诱导凋亡、抑制P13K途径抑制神经营养因子对RGCs营养作用[19]。本研究中,Western blot结果表明:模型组+药物干预组PTEN表达量,低于模型组和正常对照组(P<0.05);模型组+药物干预组AKT(Ser473)表达量,高于正常对照组(P<0.05),低于模型组(P<0.05);模型组+药物干预组PTEN基因启动子组蛋白阳性率与正常对照组比较差异无统计学意义(P>0.05),均高于模型组(P<0.05)。提示:PTEN能提高AKT(Ser473)表达量抑制疾病发展。同时,PTEN能改变PTEN基因启动子组蛋白表达率。
综上所述,大鼠青光眼应激模型中视网膜神经节细胞PTEN基因表观遗传修饰及表达能产生明显的影响,通过改变AKT(Ser473)表达量抑制疾病发展。
