原发性肝癌癌组织肿瘤抑制因子候选基因1表达与病理特征的关系
2019-05-07王媛惠双张成辉郭宏强
王媛 惠双 张成辉 郭宏强
原发性肝癌属常见恶性肿瘤,有报道称其发生为一个多基因共同参与的复杂过程,涉及肝细胞损伤修复、抑癌基因、肿瘤基因等,其中肿瘤抑制基因在抑制肿瘤发生过程中起着重要作用[1]。近年有资料显示,肿瘤抑制因子候选基因1(Tumor suppressor candidate 1,TUSC1)作为一种新型抑癌基因,在甲状腺乳头状癌、乳腺癌中呈低水平表达,且其表达水平较正常组织低[2]。而在原发性肝癌中,TUSC1 mRNA及其蛋白表达与临床病理特征的相关性鲜有报道。本研究纳入78例原发性肝癌患者,进行回顾性分析,旨在深入探讨原发性肝癌癌组织中TUSC1表达与病理特征的关系,现报道如下。
资料与方法
一、一般资料
纳入2016年10月至2018年10月于我院收治的78例原发性肝癌患者为对象,进行回顾性分析,获我院医学伦理委员会批准。纳入标准:①与《原发性肝癌规范化病理诊断指南(2015版)》[3]中原发性肝癌诊断标准相符,经病理学确诊;②年龄≥18岁,首次发病;③获患者知情同意。排除标准:①合并心、肺、肾等重要器官疾病;②伴其他部位恶性肿瘤者;③入组前1周接受放化疗、介入治疗、分子靶向药物治疗、微波消融等抗肿瘤治疗;④伴重度肝硬化所致肝功能严重异常,或腹水、黄疸明显者。按TUSC1 mRNA检测结果,将78例患者分为TUSC1 mRNA表达组(55例)及缺失组(23例);按TUSC1蛋白检测结果,将其分为TUSC1蛋白表达组(45例)及缺失组(33例)。
二、 方法
(一)TUSC1基因mRNA表达检测 取患者60 mg癌组织,剪碎研磨,加入TRIzol试剂(美国Invitrogen公司)1 mL,TRIzol法提取样本总RNA,行RNeasy Mini Kit纯化。以超微量分光光度计(Nanodrop 2000型,北京百道亨仪器设备有限公司)测定RNA浓度和A260/A280吸光度比值(确保在1.8~20.0之间)。依据基因序列,行β-actin肌动蛋白(β-actin)、TUSC1基因引物序列设计(见表1)。以β-actin基因为内参,实时荧光定量聚合酶链反应体系:总体积、内含模板分别为25 μL、2 μL,上下游引物均为0.5 μL,TaKaRa Taq HS 0.25 μL,10聚合酶链反应(Polymerase Chain Reaction,PCR)缓冲液5 μL,脱氧核糖核苷三磷酸混合物4 μL,其余补水25 μL。取5 μL PCR产物,采用琼脂糖凝胶电泳方法,以2%琼脂糖凝胶、100V电压电泳30 min,行反应产物检测,后采用Quantity-One图像分析(成都百乐科技有限公司),计算样本TUSC1表达水平。2720型PCR基因扩增仪购自孚约安防设备(上海)有限公司,实时荧光定量聚合酶链反应试剂盒由美国Thermo公司生产;TUSC1、β-actin引物序列由美国Abmart公司合成。

表1 PCR引物设计
(二)TUSC1蛋白表达检测方法 取25 μg蛋白,使用20 g/L十二烷基硫酸钠-聚丙烯酰胺凝胶(晶美生物工程有限公司),行电泳处理。半于法转膜后使用50 g/L脱脂奶粉(南京松冠生物科技有限公司)室温封闭60 min,将1∶1 000的1Tris-HCl缓冲液稀释的TUSC1一抗及1∶5 000的内参β-actin一抗加入其中。4 ℃过夜后以Tris-HCl缓冲液洗膜3次,将1∶5 000的1Tris-HCl缓冲液稀释的二抗加入其中,室温60 min。1Tris-HCl缓冲液洗膜3次,暗室内行增强型化学发光试剂(上海纪宁实业有限公司)显影,曝光。以Quantity-One生物医学图像分析系统对TUSC1蛋白表达量进行计算。
三、观察指标
比较患者癌组织及癌旁组织中TUSC1 mRNA及其蛋白表达水平,分析其临床病理特征与癌组织中TUSC1 mRNA及其蛋白表达的关系,并观察TUSC1 mRNA表达与TUSC1蛋白表达的一致性。
四、统计学方法

结 果
一、 原发性肝癌癌组织及癌旁组织中TUSC1 mRNA及其蛋白表达比较
原发性肝癌癌组织中TUSC1 mRNA及其蛋白表达水平显著低于癌旁组织(P<0.05),见表2。
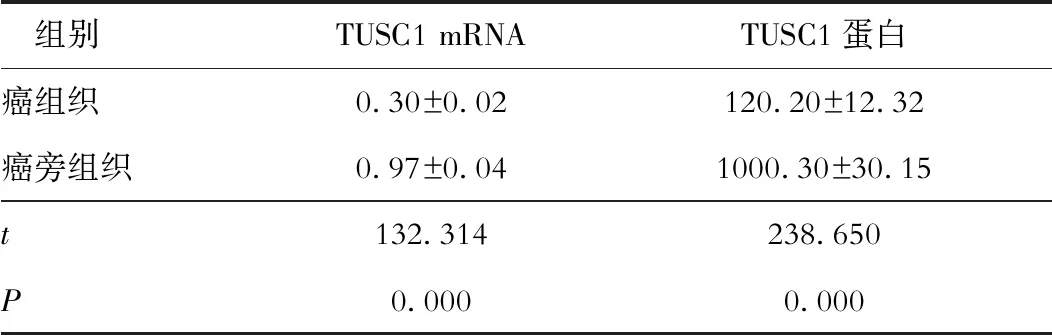
表2 原发性肝癌癌组织及癌旁组织中TUSC1 mRNA及其蛋白表达比较
二、原发性肝癌病理特征与TUSC1 mRNA表达的关系
TUSC1 mRNA表达与原发性肝癌患者年龄、性别、肿瘤部位、肿瘤直径、肿瘤类型、HBsAg无明显关系(P>0.05),但早期(TNM分期为Ⅰ、Ⅱ期)者TUSC1 mRNA阳性表达率显著低于中晚期(Ⅲ、Ⅳ期)者(P<0.05),高、中分化者TUSC1 mRNA阳性表达率显著低于低、未分化者(P<0.05),肝内转移者TUSC1 mRNA阳性表达率显著高于肝内无转移者(P<0.05),伴门静脉癌栓者TUSC1 mRNA阳性表达率显著高于不伴门静脉癌栓者(P<0.05)。见表3。
三、原发性肝癌病理特征与TUSC1蛋白表达的关系
TUSC1 蛋白表达与原发性肝癌患者性别、年龄、肿瘤部位、肿瘤直径、肿瘤类型、HbsAg无明显关系(P>0.05),但中晚期(TNM分期为Ⅲ、Ⅳ期)者TUSC1蛋白阳性表达率显著高于早期(Ⅰ、Ⅱ期)者(P<0.05),高、中分化者TUSC1蛋白阳性表达率显著低于低、未分化者(P<0.05),肝内转移者TUSC1蛋白阳性表达率显著高于肝内无转移者(P<0.05),伴门静脉癌栓者TUSC1蛋白阳性表达率显著高于不伴门静脉癌栓者(P<0.05)。见表4。
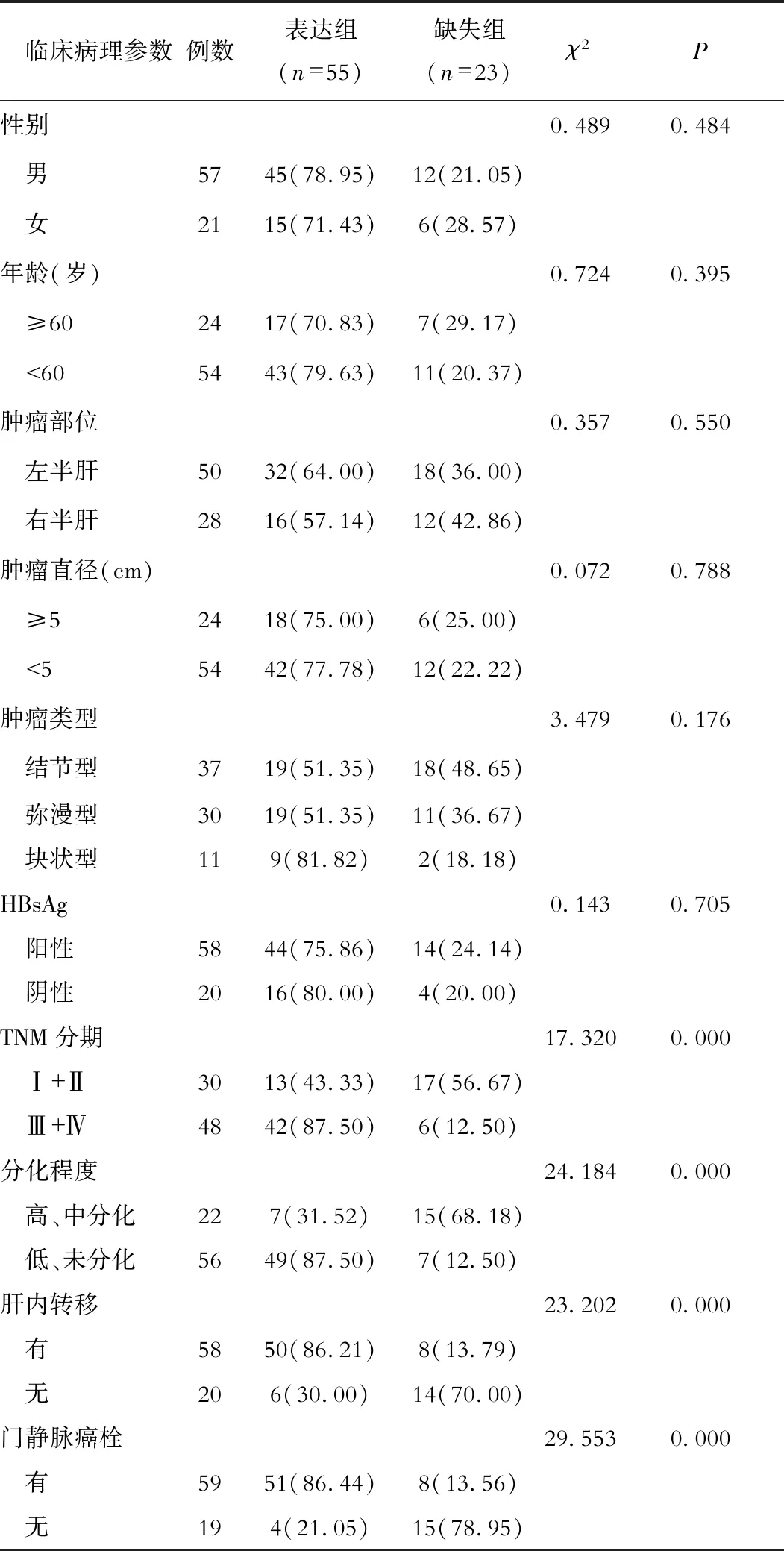
表3 原发性肝癌病理特征与TUSC1 mRNA表达的关系(例数,%)
四、原发性肝癌患者TUSC1 mRNA表达与其蛋白表达的一致性分析
原发性肝癌患者TUSC1 mRNA表达与TUSC1蛋白表达具有良好一致性(kappa为0.56),见表5。

表4 原发性肝癌病理特征与TUSC1蛋白表达的关系(例数,%)

表5 原发性肝癌患者TUSC1 mRNA表达与其蛋白表达的一致性分析
讨 论
TUSCI已被证实与多种恶性肿瘤的发生、发展、侵袭、转移有关,其功能丧失及癌基因激活已成为癌变的分子基础。TUSCI基因属新型抑癌基因,处于人类染色体9P21.2,是镁离子转运系统重要成员,其编码的蛋白质为寡糖基转移酶复合物中的亚基,在蛋白质折叠过程中的N端糖基化反应中发挥着重要作用。TUSC1突变缺失或异常表达可改变N端糖基化进程,而异常N端糖基化会诱发蛋白质错误折叠,出现内质网结构及功能异常改变,促使细胞转化为恶性肿瘤细胞。赵爱国等[4]研究表明,TUSC1与癌症之间关系密切,已在多种恶性肿瘤中发现 TUSC1表达降低或缺失,如甲状腺乳头状癌、乳腺癌等。
本研究发现,与癌旁组织相比,原发性肝癌癌组织中TUSC1 mRNA及其蛋白呈低表达,可能与原发性肝癌的恶性进程有关。国外研究表明,TUSC1基因在人类许多肿瘤中存在低表达,而关于其在肝脏中表达的研究报道较少[5]。Rimkus等[6]报道TUSC1在乳腺癌中的表达明显下调,TUSC1缺失可促进乳腺癌细胞增殖、转移,而TUSC1缺失可能与TUSC1基因启动子区过甲基化有关。陈皓等[7]认为TUSC1基因启动子的甲基化为基因失活关键机制,与肿瘤恶性程度有关。本研究中,笔者认为TUSC1在原发性肝癌中的表达下调可能与TUSC1基因启动子区过甲基化有关。一旦出现TUSC1基因启动子区过甲基化,会抑制TUSC1基因转录,使TUSC1基因呈低水平表达,导致TUSC1基因解毒、抑癌功能减弱,提示TUSC1甲基化可能促进原发性肝癌发病进程,具体机制有待更大样本进行深入研究。
本研究发现,TUSC1 mRNA及其蛋白表达与TNM分期、分化程度、门静脉癌栓、肝内转移有关,提示TUSC1表达下调可进一步增加原发性肝癌侵袭性、增殖能力及恶性程度,与患者肿瘤恶性进展程度有关。夏琬君等[8]报道通过检测65例浸润性乳腺癌癌组织中启动子甲基化及蛋白表达,发现癌旁组织未出现TUSC1基因启动子甲基化,对应乳腺癌组织中甲基化水平占61.5%;而癌旁组织TUSC1蛋白均有明显表达,对应乳腺癌组织出现蛋白表达占29.2%,证实甲基化发生率与蛋白表达与TNM分期、淋巴结转移明显相关,表明TUSC1基因启动子甲基化为基因失活关键机制,与乳腺癌发病有关。本研究发现,患者TUSC1 mRNA表达与TUSC1蛋白表达具有良好一致性,提示TUSC1 mRNA阳性表达者多伴有TUSC1蛋白阳性表达。
综上,癌组织TUSC1 mRNA及蛋白的联合检测是原发性肝癌的有效诊断手段,可早期评估原发性肝癌肝内是否存在转移,判断是否合并门静脉癌栓,临床上应引起足够重视。但本研究由于样本量偏小,未涉及患者预后与TUSC1表达间的关系,故今后仍需深入调查研究。
