人重链铁蛋白偶联HER2抗体的纯化及其在成像中的初步应用
2019-05-07殷惠陈龙张文远朱新杰许诺王婷婷盛复庚
殷惠,陈龙,张文远,朱新杰,许诺,王婷婷,盛复庚
1.安徽医科大学 解放军307临床学院,北京 100071;2.解放军总医院 第五医学中心南院区放射科,北京 100071;3.北京大学 化学与分子工程学院,北京 100871
近年来,随着生物医学技术的发展,越来越多的纳米材料用于癌症的靶向成像及治疗,但普遍存在安全性及生物相溶性差的缺点[1]。铁蛋白是人体内普遍存在的铁代谢蛋白,生理状态下形成24 聚体的笼状结构,内外径分别为8、12 nm,其内部空腔可以载药[2-4]。铁蛋白作为药物载体具有生物相容性高及易于工程改造的优点[5]。目前,很多研究以铁蛋白作为载体,包载治疗或成像药物,进行癌症的诊断或治疗[6]。其机理主要是借助重链铁蛋白(heavy chain ferritin,HFn)与人转铁蛋白受体1(transferrin receptor 1,TfR1)结合,发挥其功能[7]。但从靶向肿瘤递送角度,需要增加铁蛋白的靶向性,使其更好地定位于肿瘤细胞,因而提高其靶向性也是目前关注的热点之一。通过不同靶向配体的化学修饰,或遗传修饰的方法提高铁蛋白的靶向性,已经取得了一些成功。相关报道如在铁蛋白表面修饰RGD,通过RGD 与整合素αⅤβ3的结合,将铁蛋白靶向癌细胞;或将铁蛋白与细胞黏附分子偶联,靶向内皮,从而提高对肺血管系统的靶向等[8-9]。单克隆抗体作为特异性的靶向分子,将铁蛋白与临床常用抗体偶联,既可以提高铁蛋白的靶向性,也有利于将铁蛋白纳米材料向临床转化。
人表皮生长因子受体2(human epidermal growth factor receptor-2,HER2)是临床上许多肿瘤如乳腺癌、胃癌等的重要治疗靶点。乳腺癌是女性最常见的恶性肿瘤之一,我国的乳腺癌发病率逐年上升,并且患者中的15%~23%表现为HER2 阳性[10]。曲妥珠单抗(商品名为赫赛汀)作为一种人源化的单克隆抗体,可以特异地与表面高表达HER2的乳腺癌细胞结合,进而通过抗体依赖的细胞介导的细胞毒性作用(antibody-depen⁃dent cell-mediated cytotoxicity,ADCC)产生抗肿瘤活性,是临床治疗乳腺癌的主要方式之一[11-12]。虽然曲妥珠单抗的靶向治疗改善了HER2 阳性乳腺癌患者的预后,但仍有相当一部分患者会复发并死亡。目前,除了继续研究靶点不同的分子靶向药物,针对关键基因、信号通路等的研究也在探索中。但临床研究更倾向于将不同机制靶向药物进行联合治疗,如将靶向药物与化疗药物联合使用,或将靶向药物与内分泌联合治疗等[13]。尽管有关曲妥珠单抗治疗的临床数据丰富,但许多重要问题仍未得到解决,包括最佳治疗持续时间,以及如何最好地将曲妥珠单抗与细胞毒性试剂和其他药剂联合使用以最大限度地提高疗效,同时尽量减少毒性等。2016年有关MM-302的实验已进入临床试验阶段,主要是设计一种既有HER2 阳性细胞靶向性,又有抗肿瘤细胞毒性的靶向-化疗药物偶联物,以曲妥珠单抗为靶向分子,以期达到减毒增效的目的[14]。
在本研究中,我们采用类似于抗体偶联药物(antibody drug conjugate,ADC)的设计思路,将临床常用抗HER2 抗体(曲妥珠)与载体材料HFn 偶联成靶向复合物HFn/anti-HER2,从而增加对HER2 阳性的乳腺癌(HER2+MDA-MB-231-Luci)的肿瘤靶向。结果表明靶向复合物HFn/anti-HER2 在体内外能更好地靶向HER2 阳性细胞,验证了临床常用抗体与HFn 偶联的可能性,结合铁蛋白药物载体和抗体高靶向性的优势,可以大大提升铁蛋白在生物医药方面的应用。
1 材料与方法
1.1 材料
6~8 周龄 SPF 级 BLBC/c 雌性裸鼠(北京维通利华有限公司),实验过程中对动物的处理符合动物伦理学标准(许可证编号为LA2018033);标记萤光素酶基因的HER2 阳性及阴性的乳腺癌细胞株MDA-MB-231-Luci(本实验室保存);重链铁蛋白菌种由中国农业大学赵广华教授提供;大肠杆菌BL21 感受态(天根生化有限公司);质粒小提试剂盒、蛋白 marker、BCA 试剂盒、TEMED(Bio-Rad 公司);DMEM 培养基(上海素尔生物科技有限公司);牛血清白蛋白(上海捷倍思基因技术有限公司);青霉素-链霉素溶液(100×)(碧云天生物技术);Mal-PEG-NHS(ToYongBio 公司);曲妥珠单抗(国药准字J20110020);D-荧光素钾盐(Thermo Fisher Scientific 公司);其余所用试剂均为分析纯。
AKTA start 蛋白纯化仪、Superdex 200 凝胶过滤柱(GE Healthcare 公司);纯水仪(Milli-pore 公司);小动物活体成像仪IVIS LuminaⅢ(珀金埃尔默公司);分光光度计Nanodrop2000C(Thermo Sci⁃entific 公司);马尔文粒径分析仪(Malvern Instru⁃ment 公司);透射电子显微镜(日立公司);激光共聚焦显微镜(卡尔蔡司公司)。
1.2 重链铁蛋白诱导表达和鉴定
将 10 μL 菌液接种到 1 mL 含 100 μg/mL 氨苄青霉素的LB 培养基中,37℃、220 r/min 振摇1 h,提取质粒,测序。蛋白表达纯化过程参照Uchi⁃da 等的方法[15],但加热步骤改为在65℃而不是60℃下进行,并使用镍柱纯化。挑取转化平板上的单克隆接种于含100 μg/mL 氨苄青霉素的10 mL LB 培养液试管中,37℃、220 r/min 振摇 4~6 h;按 1∶100 接种于含 100 μg/mL 氨苄青霉素的 1 L LB 培养液中,37℃、220 r/min 振摇至菌液D600nm为 0.6~0.8(约 4~6 h);加入 IPTG 至终浓度为 1 mmol/L,37℃、220 r/min 振摇过夜,诱导蛋白表达;离心收菌,用PBS 重悬沉淀;重悬液经超声波破碎后,65℃加热15 min,离心;将上清缓慢加入硫酸铵(浓度约50%),4℃搅拌2 h,4℃冰箱过夜,12 000 r/min 离心10 min,倒掉上清,沉淀复溶;65℃水浴加热15 min,离心15 min 收集上清,过0.22 μm 滤膜后,用 30 kD 超滤管超滤 3 次,除硫酸铵,过镍柱,收集蛋白;30 kD 超滤管超滤,除咪唑并浓缩至2 mL,过Superdex 200 凝胶过滤柱进行尺寸排阻层析;取层析后蛋白进行12% SDSPAGE,考马斯亮蓝染色显带。
1.3 细胞培养
用DMEM 培养基分别培养HER2 表达阳性及阴性的乳腺癌细胞HER2+MDA-MB-231-Luci 和HER2-MDA-MB-231-Luci,培养基中加入10%的胎牛血清、100 U/mL 青霉素、0.1 mg/mL 链霉素。
1.4 靶向复合物HFn/anti-HER2的制备
异双功能交联剂马来酰亚胺-聚乙二醇-琥珀酰亚胺琥珀酸酯(Mal-PEG-NHS)用于人重链铁蛋白与抗体的结合。偶联过程如Elisabetta 所述[16]。室温下取10 mg anti-HER2 与5 mg Mal-PEG-NHS,在 2 mL PBS 溶液(pH7.5)中反应 30 min,以30 kD 超滤管超滤除去未反应的Mal-PEG-NHS;再将其与人重链铁蛋白在室温下于PBS 缓冲液(pH7.0)里偶联 1 h,30 kD 超滤管超滤 3 次,12 000 r/min 离心 10 min,过 0.22 μm 滤膜,4℃冰箱保存;用Superdex 200 凝胶色谱柱通过尺寸排阻凝胶色谱(SEC)纯化复合后的纳米载体;用 PBS 溶液(pH7.4),设置流速为 1 mL/min,纯化样品以除去游离抗体并收集分离纯化后的HFn/anti-HER2。
1.5 HFn、HFn/anti-HER2纳米材料的表征
用马尔文粒径分析仪进行HFn 及复合物HFn/anti-HER2 纳米靶向材料的尺寸和Zeta 电位分析。样品用0.22 μm 滤膜过滤,用去离子水稀释至0.5 mg/mL。粒径大小分布是通过数据分布进行统计的。
用透射电子显微镜分析HFn 及复合物HFn/anti-HER2 纳米靶向材料。用去离子水稀释至0.5 mg/mL,滴一滴在碳支持膜上,3 min 后用滤纸吸干,再用磷钨酸染色,2 min 后用滤纸吸干,并干燥,在80 kV的加速电压下观察。
1.6 HFn、HFn/anti-HER2纳米材料的荧光标记
用Cy5.5-NHS 标记目标蛋白。HFn 及复合物HFn/anti-HER2 纳米靶向材料标记相同量的荧光,蛋白与荧光以1∶2eq 比例标记,避光室温振荡反应过夜,通过G-25 Sephadex 脱盐柱去除游离荧光团。本研究用BCA 试剂盒测量蛋白浓度,分光光度计测定荧光标记后的荧光强度。
1.7 HFn、HFn/anti-HER2纳米材料的体内外靶向
将HER2 阳性及阴性的乳腺癌细胞接种在共聚焦皿中,将荧光标记的纳米材料加入相应的细胞中(Cy5.5 终浓度为200 nmol/L),在37℃培养箱中孵育20 min;用PBS 洗涤细胞3 次,加入DAPI染液(终浓度50 ng/mL)孵育15 min;再用PBS 洗涤细胞2 次,加入100 μL PBS;用激光共聚焦显微镜进行荧光显像。
根据批准的方案进行动物实验,建立HER2阳性乳腺癌荷瘤裸鼠模型,每只鼠肩背部接种5×105HER2 阳性 MDA-MB-231-Luci 细胞,1 周后进行生物发光成像。尾静脉注射荧光标记的对照组 HFn-Cy5.5、实验组 HFn/anti-HER2-Cy5.5 纳米材料(Cy5.5 浓度为40 nmol/kg,120 μL),注射后0、2、8、24、48、96、144 h 分别用小动物活体成像仪进行荧光成像,并进行荧光信号统计。
1.8 统计分析
用SPSS 16.0 软件进行统计分析。计量资料采用x±s表示,2 组间均数比较采用t检验,P<0.05认为差异有统计学意义。
2 结果
2.1 人铁蛋白重链的制备
铁蛋白在大肠杆菌中表达,经镍柱纯化后进行SDS-PAGE,可见清晰的铁蛋白亚基条带(图1),蛋白带条带单一,表明得到的HFn 纯度高。
2.2 人重链铁蛋白与抗HER2抗体的偶联
用双功能交联剂Mal-PEG-NHS 将抗体和重链铁蛋白偶联(图2),获得的复合物通过尺寸排阻凝胶色谱表征,以确定交联反应是否产生预期的可溶性大分子物质。结果见图3,HER2 抗体吸收峰位置约在65 mL 处;偶联后铁蛋白吸收峰(55 mL 处)消失,在45 mL 处出现一个新的主峰即为HFn/anti-HER2,表明铁蛋白与抗HER2 抗体偶联成功。用HPLC 进行HER2 抗体的定量分析,计算HFn 缀合物的偶联比例,HFn 与HER2 抗体起始摩尔比为1∶3.2,约59%的游离HER2 抗体在65 mL 处洗脱出来,对应于HFn,这表明每个HFn连接的HER2 抗体约为1.3 个。
2.3 靶向复合物HFn/anti-HER2的表征
通过透射电子显微镜和动态光散射表征HFn和靶向复合物HFn/anti-HER2。透射电子显微镜显示HFn(图4A)为特征性的纳米壳-核结构,复合物HFn/anti-HER2(图4B)仍表现为特征性的纳米球形结构。动态光散射频率曲线(图4C)显示复合后流体动力学直径增加,单独的HFn的平均直径为7.11±0.12 nm,而复合物HFn/anti-HER2的平均直径为16.88±0.49 nm(表1)。多分散指数(PDI)表明,和未与HER2 抗体偶联的HFn 相比,复合物HFn/anti-HER2的单分散水平相似(分别为0.18±0.01 vs.0.16±0.03),两者分散性很好,在水溶液中HFn 与靶向复合物HFn/anti-HER2的Zeta 电势分别为-9.82±1.51、-6.59±0.86 mV。
2.4 复合物HFn/anti-HER2的体内外靶向验证
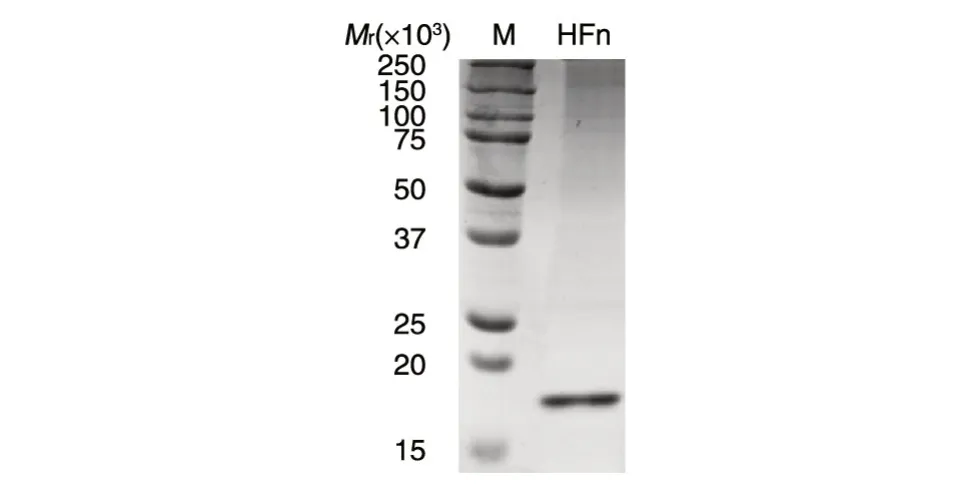
图1 重链铁蛋白亲和纯化的SDS-PAGE分析

图2 HER2抗体与HFn偶联过程模式图
为了在体外验证靶向复合物HFn/anti-HER2的靶向性,首先进行了体外表征。肿瘤细胞在Cy5.5 通道信号(红色)(波长设置为670 nm)结果显示,靶向复合物HFn/anti-HER2 相对于HFn 本身在HER2 阳性乳腺癌细胞中的荧光强度更高(图5,3~4)。同时,HER2 阳性乳腺癌细胞中较HER2 阴性细胞中荧光强度更高。表明靶向复合物 HFn/anti-HER2-Cy5.5 增加了 HFn 对 HER2 阳性乳腺癌的靶向性。
为了进一步验证靶向复合物的靶向性,HFn与靶向复合物HFn/anti-HER2 标记荧光基团Cy5.5之后分别于尾静脉注入HER2 阳性乳腺癌荷瘤鼠,体内荧光成像结果如图6所示,可以看出靶向复合物HFn/anti-HER2 在24 h 左右出现明显的肿瘤富集现象,并在48 h 左右达到峰值,之后在96 h 内都保持了良好的靶向;对照之下,HFn 在长达144 h 范围内未出现明显的肿瘤富集现象。此外,荧光强度测量分析(图7)表明HFn/anti-HER2在体内表现出更长的保留时间(24~72 h)。

图3 HFn、游离HER2抗体及靶向复合物HFn/anti-HER2的尺寸排阻凝胶色谱曲线

图4 HFn(A)和靶向复合物HFn/anti-HER2(B)的透射电子显微镜图像(比例尺:100 nm);C为通过动态光散射获得的HFn和靶向复合物HFn/anti-HER2的频率曲线

表1 HFn和靶向复合物HFn/anti-HER2的直径、多分散指数(PDI)及Zeta电势(x±s,n=3)

图5 细胞荧光实验检测HFn及靶向复合物HFn/anti-HER2对乳腺癌细胞的肿瘤靶向性
3 讨论
纳米材料靶向成像及载药是近年来的研究热点,其可通过增强渗透滞留(enhanced permea⁃bility and retention,EPR)效应及与主动靶向方式靶向肿瘤[17-18]。铁蛋白作为一种生物纳米材料具有良好的生物相容性,无免疫原性,并且其内部空腔可以作为药物载体装置,因此在肿瘤的诊断与治疗方面展现了优势[19-20]。作为备受关注的天然药物载体,如何对铁蛋白进行修饰以提高其靶向性,一直是研究的热点。目前提高其靶向性主要通过靶向修饰配体、抗体,但未将其与临床常用靶向治疗分子连用。目前单克隆抗体的靶向性和特异性受到研究者青睐[21],因此,利用抗体结合提升铁蛋白的靶向性是适当可行的思路。HER2 是HER2 阳性乳腺癌靶向治疗的关键靶点,作为模型抗体具有很高的研究和临床价值。
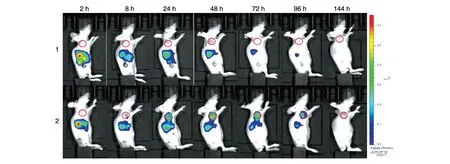
图6 HER2阳性乳腺癌荷瘤鼠的肿瘤靶向性成像
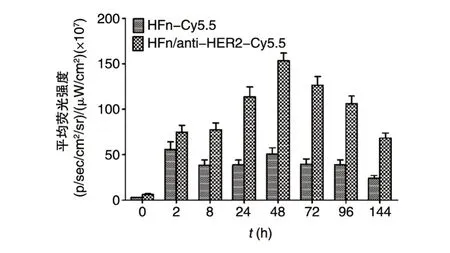
图7 HFn和靶向复合物HFn/anti-HER2在HER2阳性乳腺癌荷瘤鼠模型中的荧光强度分析
我们利用HER2 抗体对肿瘤的高靶向特性,将人重链铁蛋白作为药物或试剂载体与之相连,发挥HER2 抗体的良好肿瘤靶向性及铁蛋白的载体特性,构建一个靶向复合物纳米载体平台。本研究探讨了人重链铁蛋白与临床常用HER2 抗体连用的可能性,人重链铁蛋白可以与HER2 抗体以1∶1.3的比例连接,在体内靶向肿瘤成像时,成像平均荧光强度在48 h 达到最强,靶向性是重链铁蛋白本身的3 倍,说明铁蛋白的靶向性增加,有利于将其进行临床转化,具有研究价值和开发潜能。有文献报道,修饰后的铁蛋白可以装载更多的化疗药物或成像分子,且拥有较长的循环半衰期,故能更好地用于肿瘤的治疗[8]。本研究运用荧光标记检测,在体内外观察到良好的靶向性,关于载药后成像及治疗还在进一步研究中。
综上,我们构建了人重链铁蛋白-抗体偶联物,人重链铁蛋白作为药物载体,临床常用抗体作为靶向分子,极大地提升了铁蛋白的肿瘤靶向性,增强了铁蛋白在肿瘤诊断和治疗方面的潜力,为后续铁蛋白的临床转化提供了可行思路。
