核桃粕多肽酸乳饮料稳定剂配方优化及性能表征
2019-05-07杨媛媛潘建龙宴正明张润光张有林
杨媛媛,潘建龙,宴正明,张润光,张有林*
1(陕西师范大学 食品工程与营养科学学院,陕西 西安,710000)2(安康市瀛天生态农林开发有限公司,陕西 安康,725000) 3(陕西省林业科学研究院,陕西 西安,710000)
核桃(JuglansregiaL.)是胡桃科核桃属植物,为世界四大干果之一。核桃仁中蛋白质含量高达15%~25%,具有健胃、补血、润肺、养神等功效,被称为是天然营养补品[1-2]。核桃仁冷榨取油后的副产物核桃粕中蛋白质含量高达54%[3],但目前未得到充分利用,造成资源浪费。乳酸菌发酵食品具有降低血糖,调节肠胃,增强免疫等功能[4]。利用乳酸菌发酵植物蛋白开发集蛋白质营养价值与乳酸菌保健功能于一体的新型发酵饮料,可成为开发利用核桃的一种新途径。
关于酸性植物蛋白饮料的研究有诸多报道,王才华等[5]对大豆蛋白乳酸菌饮料的制备工艺进行了研究;李博等[6]选育出一株蛋白酶活性高,发酵活力好的乳杆菌株用于制备花生酸乳。酸性蛋白饮料中蛋白质易沉淀,目前主要通过添加稳定剂解决这一问题。不同稳定剂对酸乳体系的性质、产品的口感影响很大,实际生产中添加单一稳定剂效果很不理想,往往需要复配使用[7]。NTAZINDA等[8]研究,将羧甲基纤维素钠和可溶性大豆多糖复配,有效降低了沉淀率和平均粒径,改善了产品的口感。KIANI等[9]将结冷胶与果胶复配,极大延长了酸性乳饮料的货架期。LIU等[10]将可溶性大豆多糖和果胶复配,结果表明果胶的加入限制了可溶性大豆多糖吸附到酪蛋白上,不利于酸乳的稳定。因此复配稳定剂效果不一,需进一步验证。本试验在前人研究的基础上筛选出生产核桃粕多肽酸乳饮料理想的单一稳定剂羧甲基纤维素钠(sodium carboxymethyl cellulose,CMC-Na)、高酯果胶(high methoxyl pectin,HMP)和阿拉伯胶(gum arabic,GA),进行单因素和正交试验,并通过测定产品流变学特性、观察微观结构变化和感官鉴评,确定最佳复配方案,旨在为复合稳定剂的研究提供理论基础,为核桃粕多肽酸乳饮料的开发提供技术参考。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
核桃为香菱品种由西安市核桃良种繁育基地提供;风味蛋白酶为北京索莱宝科技有限公司产品;乳酸菌发酵剂为昆山佰生优生物科技有限公司产品;CMC-Na为国药集团化学试剂有限公司产品;HMP为丹尼斯克(上海)公司产品;GA为郑州裕和食品添加剂有限公司产品;白砂糖、牛奶为市售。以上材料均为食品级。
1.1.2 仪器与设备
JM-50型胶体磨,西安永兴食品药化机械公司;LRH-250生化培养箱由上海一恒科技有限公司;MK3型全波长酶标仪,美国热电公司;AR-G2型流变仪,美国TA公司;黏度计,美国Brookfield有限公司;FV1200激光共聚焦显微镜,日本奥林巴斯有限公司;BI-90Plus激光粒度仪,美国布鲁克海文仪器公司。
1.2 试验方法
1.2.1 核桃粕多肽酸乳饮料制备工艺

1.2.2 操作要点
(1)乳酸菌的活化及驯化
参考杨胜敖等[11]的方法。菌种活化:取脱脂乳5 mL,装于试管,塞口,121 ℃杀菌20 min。冷却后,加入1 g/L的发酵剂菌粉,置于37 ℃的恒温条件下培养12 h。菌种的驯化:采用梯度浓度驯化法,将活化的乳酸菌菌种(接种量为4%)依次接入含核桃酶解液与脱脂乳质量比为5∶5、 6∶4、7∶3、8∶2、 9∶1、10∶0 的混合物中,37 ℃培养至凝乳。经多次驯化,直至混合菌种生长良好,凝乳快,才可作为生产发酵剂。-18 ℃冻藏备用。
(2)核桃粕酶解液的制备
酶解:称取定量核桃粕与沸水按比例1∶12(g∶mL)混合,充分搅拌,待冷却后加入柠檬酸调节pH至6.0,加入风味蛋白酶,在50 ℃下保温水解。
灭酶:酶解液沸水浴20 min。
(3)核桃酶解液的发酵
在上述制备好的酶解液中加入牛奶、白砂糖、稳定剂等,均质, 70 ℃杀菌30 min,冷却后接种一定量的乳酸菌发酵。在4 ℃下冷藏后熟,取样分析。
1.2.3 核桃粕多肽酸乳饮料稳定性研究
单因素试验:对前期筛选出的CMC-Na、HMP和GA三种稳定剂,考察添加量对样品稳定性、感官评分、黏度和粒径的影响,综合评价各稳定剂的效果。
正交试验:在单因素试验的基础上,通过正交试验对3种稳定剂进行复配,确定出最佳配方。
1.2.4 稳定系数的测定
参考周文化等[12]的方法:离心机将样品在3 000 r/min离心10 min,分别取离心后的上清液和核桃粕多肽酸乳饮料,稀释100倍,在501 nm波长下测定吸光值,稳定系数按公式(1)计算。

(1)
1.2.5 综合评分方法
参考马永轩等[13]的方法,对核桃粕多肽酸乳饮料样品随机编号,并分装到专用品评杯中,食品专业的品评员10名,对样品按表1进行感官评分,按公式(2)计算每个样品的综合评分值。
综合评分=稳定系数×30%+感官评分×70%
(2)

表1 感官评分表Table 1 Sensory score sheet
1.2.6 黏度测定
将添加了不同浓度稳定剂的核桃粕多肽酸乳饮料样品搅拌均匀,用黏度计测定,设置转速200 r/min,测定温度15 ℃,每个样品3次重复。
1.2.7 粒径测定
添加不同浓度稳定剂的样品冷藏1d后,利用Brookhaven BI-90 Plus激光粒度分析仪测定其粒径分布情况。
1.2.8 流变学研究
参考张雅媛等[14]和CUI等[15]的方法作以下改动:采用稳态模式,剪切速率0.1~100 s-1,温度25 ℃,每10 倍频率取10 个数据点,测定黏度及剪切力随剪切速率的变化。对添加复配稳定剂的核桃粕多肽酸乳饮料样品及未添加稳定剂的样品每次取样1.5 mL,进行流变学特性研究。
1.2.9 微观结构测定
参考侯俊杰[16]的方法,将新制备的样品和储存7 d的样品,每毫升加入40 μL尼罗蓝染液对蛋白质染色30 min,在激发波长633 nm条件下放大40倍,用激光共聚焦显微镜观察添加复配稳定剂的样品及未添加稳定剂的样品中蛋白质分布及微观结构。
1.3 数据处理
采用Excel和Origin 8.5软件分析和绘图,并采用Duncan’s进行多重比较,试验设置3次重复,差异显著水平取0.05。
2 结果与分析
2.1 CMC-Na、HMP和GA对核桃粕多肽酸乳饮料品质的影响
不同稳定剂添加量对核桃粕多肽酸乳饮料综合评分的影响见图1。由图1看出,添加单一稳定剂与不添加稳定剂相比,综合评分均显著增加(P<0.05)。由图1-A看出样品的综合评分随着CMC-Na添加量的增加呈先上升后下降的趋势,添加量为1.2 g/L时,样品综合评分为78.01。其原因是CMC-Na属阴离子多糖,在酸性条件下吸附于蛋白质表面,该吸附层提供的空间位阻效应维持了体系稳定,随着CMC-Na添加量的增加,稳定体系被破坏,口感变差[17]。
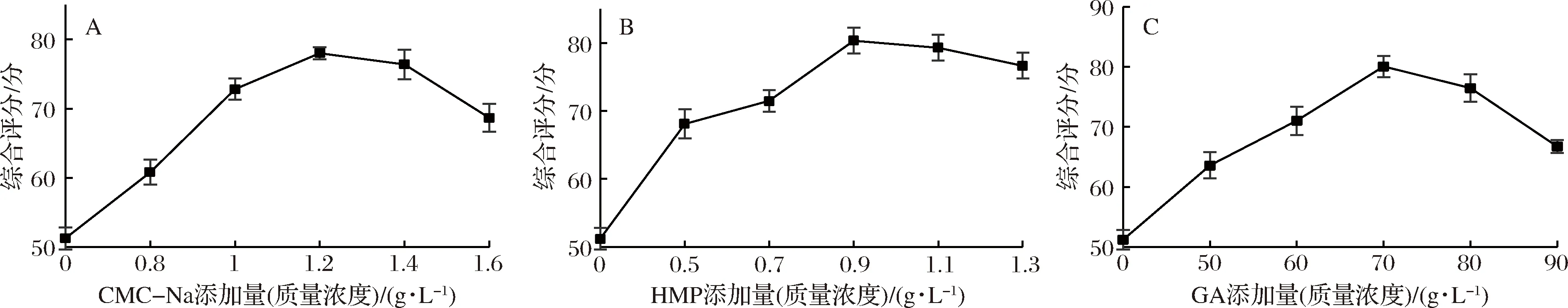
图1 三种稳定剂不同添加量对核桃粕多肽酸乳饮料品质的影响Fig.1 Effect of different addition amount of three stabilizers on quality of walnut polypeptide yogurt drink
由图1-B看出,样品的综合评分随着HMP添加量的增加先上升后逐渐趋于平缓,添加量为0.9 g/L时,综合评分为80.35,这与NAKAMURA等[18]研究结果一致,其原因是HMP与蛋白质复合胶粒间的静电排斥作用维持着酸乳体系稳定,添加量太高,会增加酸乳的黏稠感。由图1-C可以看出,随着GA添加量的增加样品综合评分呈先上升后下降,添加量为70 g/L 时,样品的综合评分为80.03,因为是在酸性环境中GA能够通过静电作用与部分蛋白质结合,随着GA添加量的增加,样品中会出现絮凝现象,体系失稳。
2.2 CMC-Na、HMP和GA对核桃粕多肽酸乳饮料黏度的影响
3种稳定剂的添加量对核桃粕多肽酸乳饮料黏度的影响见图2。
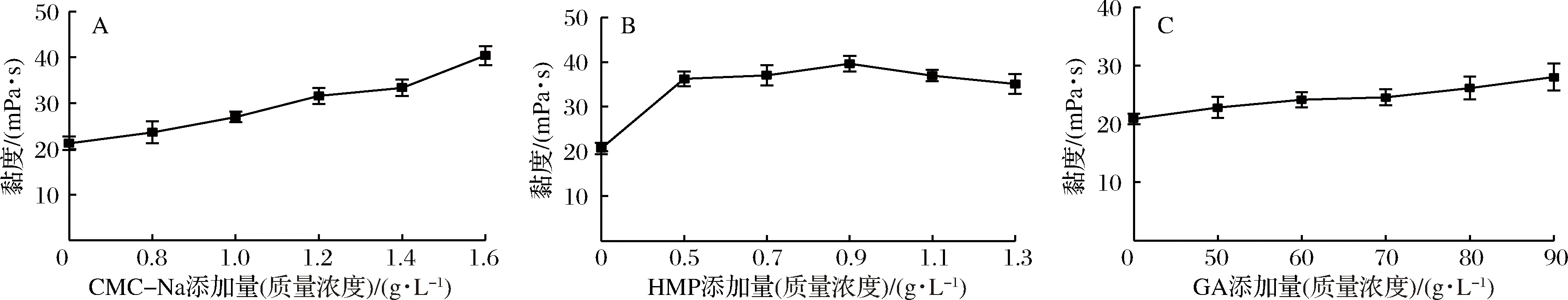
图2 三种稳定剂不同添加量对核桃粕多肽酸乳饮料黏度的影响Fig.2 Effect of different adding quantity of stabilizers on the viscosity of walnut polypeptide yogurt drink
由图2看出,样品的黏度随着CMC-Na、HMP、GA添加量的增加而增加。据TROMP等和KASTNER等[19-20]报道,其原因是在酸性环境中,CMC-Na、HMP和GA均可与酸乳中的部分蛋白质形成静电复合物,由静电作用以及分子间的摩擦力增大,导致样品黏度增加。
2.3 CMC-Na、HMP和GA对核桃粕多肽酸乳饮料粒径的影响
根据斯托克斯定律,颗粒的直径越小,沉降速度越慢,体系越稳定[21]。3种稳定剂的添加量对核桃粕多肽酸乳饮料平均粒径的影响见图3。由图3-A可以看出,随着CMC-Na添加量的增加,样品的平均粒径呈先增大再减小最后增大的趋势,添加量为1.2 g/L时,粒径值最小为(1.26±0.01) μm,这是因为低添加量时,CMC-Na不能充分吸附于蛋白质上,造成蛋白质分子聚集,粒径增大;当其添加量为1.2 g/L时,足以覆盖于蛋白质表面,此时蛋白质稳定不聚集;当添加量高于0.12%时,CMC-Na在蛋白质上发生多层吸附,粒径增大。由图3-B可以看出,随着HMP添加量的增加,样品的平均粒径显著减小(P<0.05),添加量为0.5 g/L时粒径最小为(0.94±0.02) μm。这说明在一定的添加量范围内,HMP和蛋白质能够通过静电作用形成复合物,阻止蛋白质分子聚集,减小粒径,该结论与李向东等[22]关于HMP对含乳饮料粒径的影响研究结果相一致。由图3-C可以看出,随着GA添加量的增加,样品的平均粒径呈先下降后上升再微下降的趋势,添加量为50 g/L时,粒径最小为(1.07±0.05) μm,这可能是GA分子为球形构象,蛋白质更易与其侧链的羧酸基团相互作用从而降低GA分子内部的静电斥力,使其收缩,但添加量继续增加,复合物粒径会增大。
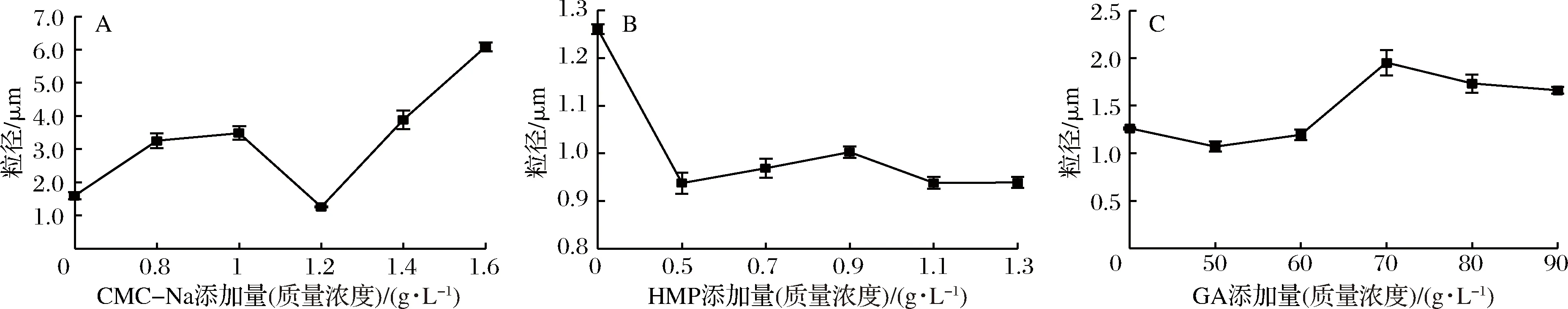
图3 三种稳定剂不同添加量对核桃粕多肽酸乳饮料粒径的影响Fig.3 Effects of different addition amount of threa stabilizers on particle size of walnut polypeptide yogurt drink
2.4 稳定剂复配正交试验
在上述单因素试验的基础上对CMC-Na、HMP、GA复配及添加量试验,采用L9(34)正交表,进行正交试验,以综合评分为指标评价稳定剂复配效果,选出最优组合及用量,正交试验结果见表3。
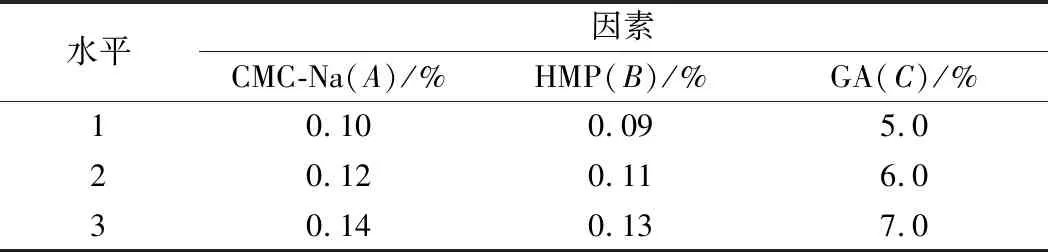
表2 稳定剂配方优化试验因素水平表Table 2 Stabilizer formula optimization test factor level table
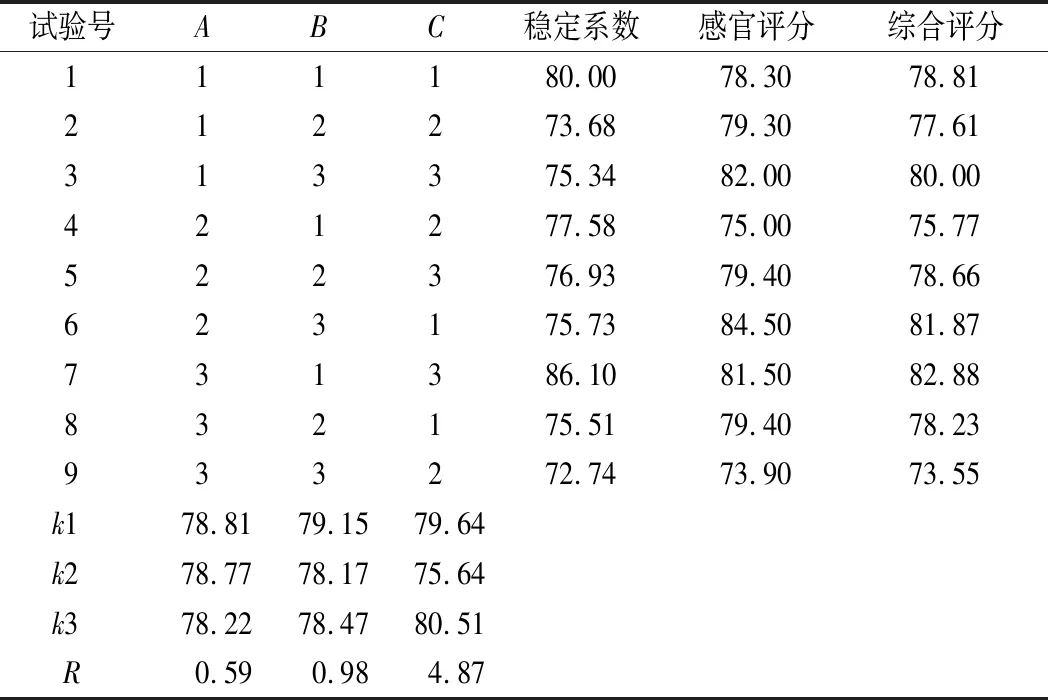
表3 稳定剂复配正交试验结果及分析Table 3 Stabilizer compounding orthogonal test results and analysis
由表3极差分析可知,稳定剂对产品综合评分影响的主次顺序为:GA>HMP>CMC-Na,最佳组合为A1B1C3, 即CMC-Na添加量1 g/L、HMP添加量0.9 g/L、GA添加量70 g/L。在此条件下又进行验证试验,测得核桃粕多肽酸乳饮料的稳定系数为80.21,感官得分为82.20,综合评分为81.60,与表3中最高综合评分差异不显著(P<0.05),综合考虑,最终复配选用A1B1C3。
2.5 核桃粕多肽酸乳饮料流变学特性
采用AR-G2型流变仪测定添加最佳复配稳定剂前后的核桃粕多肽酸乳饮料样品的流变学特性,作出黏度-剪切速率,剪切应力-剪切速率的关系图,见图4。

A-黏度—剪切速率;B-剪切应力—剪切速率图4 核桃粕多肽酸乳饮料的黏度—剪切速率和剪切应力—剪切速率曲线图Fig.4 Viscosity-shear rate and shear stress-shear rate profile of walnut polypeptide yogurt drink
由图4-A看出,添加复配稳定剂后,核桃粕多肽酸乳饮料黏度随着剪切速率的升高而降低,最后趋于平缓,而复配前的样品黏度随着剪切速率的增加先减小后基本保持不变,直至和水的黏度相等。由图4-B看出,复配后的核桃粕多肽酸乳饮料剪切应力随着剪切速率的增大而增大,而未复配样品剪切应力变化趋势和水接近。根据牛顿剪切应力公式可以判断,添加复配稳定剂后,核桃粕多肽酸乳饮料出现剪切稀化现象,反映出非牛顿流体特性,属假塑性流体。未添加复配稳定剂的样品,在高剪切速率下,呈现出牛顿流体的特性[23-24]。综合图4-A、图4-B看出,加入稳定剂后核桃粕多肽酸乳饮料黏度显著增加(P<0.05)。
2.6 核桃粕多肽酸乳饮料微观结构
本试验对添加复配稳定剂前后的核桃粕多肽酸乳饮料通过激光共聚焦显微镜观察微观结构,结果如图5所示。
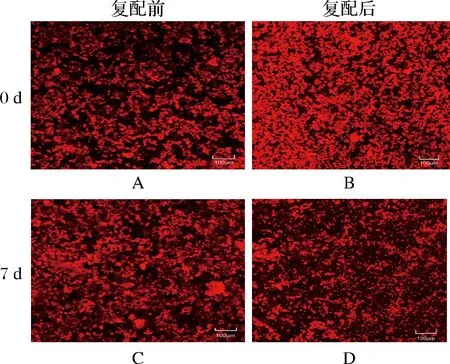
图5 核桃粕多肽酸乳饮料激光共聚焦显微镜图Fig.5 Laser confocal microscopy of walnut peptide polypeptide milk drink注:比例尺子-100 μ m。
图5-A、图5-B分别为储藏0 d添加复配稳定剂前后的样品图像。由图5可知,未添加稳定剂的样品,蛋白凝聚,分布松散不均一,添加复配稳定剂的样品蛋白质粒径明显减小,且分布更为密集。该结果与盛林霞[25]对酸性乳饮料中稳定剂复配机理的研究结论一致,其原因是复配稳定剂间产生协同作用,使体系具有更好的均一稳定性。
图5-C为贮藏7 d时未复配样品的图像,与图5-A相比蛋白絮凝现象更为明显;图5-D中蛋白质粒径无明显增加,聚集现象得到改善,但均一性比图5-B差,出现上述现象的原因可能是乳酸菌造成酸乳体系后酸化,部分蛋白质结构“塌陷”,空间位阻效应减弱,空间排斥力逐渐小于范德华吸引力,出现聚集,体系失稳沉淀。
3 结论
CMC-Na、HMP和GA三种稳定剂及其添加量对核桃粕多肽酸乳饮料感官、稳定性、黏度和粒径的影响各不相同,总体表现为添加了稳定剂综合评分、黏度均显著上升,体系呈最稳状态时样品的平均粒径较未添加稳定剂时显著减小。
复配稳定剂的稳定效果优于单一稳定剂,CMC-Na、HMP和GA三种稳定剂复配提高了核桃粕多肽酸乳饮料的稳定性,改善了口感,以添加1.2 g/L CMC-Na、0.9 g/L HMP、70 g/L GA时效果最佳。
经对添加复配稳定剂前后的核桃粕多肽酸乳饮料样品的流变学特性研究,样品添加复配稳定剂后由牛顿流体转变为非牛顿流体,黏度增加蛋白质絮凝减少,产品稳定性提高。
