卤料提取物对氧化诱导鸭肉肌原纤维蛋白功能特性和结构的影响
2019-05-07梅甜恬唐洁夏杨毅唐棋张建华张国星
梅甜恬,唐洁,夏杨毅,2*,唐棋,张建华,张国星
1(西南大学 食品科学学院,重庆,400715) 2(重庆市特色食品工程技术研究中心,重庆,400715)
蛋白氧化包括直接被活性物质诱导和间接与氧化应激副产物反应引起共价修饰[1],是一个自由基链式反应过程,主要由羟自由基(·OH)、肌红蛋白自由基和脂类次级氧化产物诱导引发,其中·OH被认为是活性氧自由基中氧化能力最强的自由基[2]。在肉制品加工贮藏过程中,肌原纤维蛋白(myofibrillar protein, MP)容易受到自由基攻击发生氧化,致使结构和功能特性发生变化,从而降低肉类品质和营养价值,如嫩度和持水性下降[3],影响蛋白质消化吸收[4]等。
二丁基羟基甲苯(butylated hydroxytoluene,BHT)、丁基羟基茴香醚(butyl hydroxyanisole,BHA)等[5]是常用的合成抗氧化剂,具有较好的抗氧化效果,但对人体有潜在危害,如诱发畸形和癌症[6-7]。香辛料是一类具有芳香和辛香等风味的天然植物,主要用于改善食品风味,包括增加香气、着色及消除异味等。同时,还具有抗氧化[8]的生理功能,可以作为天然抗氧化剂,如桂皮[9]、八角[10]、迷迭香[11]、丁香[12]等。复配香辛料在食品加工、餐饮等行业应用众多,其中复合香辛料卤制是酱卤肉制品重要的加工环节之一,赋予了卤肉制品独特的风味,但对卤料的抗氧化特性研究较少。实验以酱卤肉制品卤料配方为参照,分析卤料对肌原纤维蛋白结构和功能特性的影响,探讨卤制过程中卤料抗氧化作用,也为卤料作为抗氧化剂应用于酱卤肉制品保藏提供理论参考。
1 材料与方法
1.1 材料与试剂
鸭腿肉,重庆北碚永辉超市,放入-18 ℃低温冰箱冻藏;肉桂、良姜、八角等香辛料,重庆市天生农贸市场。
K2HPO4、叠氮钠、二硝基苯肼、三氯乙酸:分析纯,成都市科隆化工试剂厂;乙二醇双(2-氨基乙基醚)四乙酸(EGTA)、盐酸胍、乙二胺四乙酸(EDTA)、十二烷基磺酸钠(SDS):分析纯,Biosharp公司;牛血清蛋白:分析纯,上海伯奥生物科技有限公司; SDS-PAGE凝胶制备试剂盒,北京索来宝科技有限公司。
1.2 仪器设备
水浴恒温振荡器(SHZ-B),上海龙跃仪器设备有限公司;超低温冰箱(DW-25W518),青岛海尔电器有限公司;可见分光光度计(722-P),上海现科仪器有限公司;冷冻离心机(Avanti J-30I),美国贝克曼库尔特公司;内切式匀浆机(XHF-D),宁波新芝生物科技有限公司;漩涡混匀器(XW-80A),上海青浦沪西仪器厂;拉曼光谱仪(DXR2),美国Thermo Fisher Scientific公司;医用冷冻离心机(TGL-16),四川蜀科仪器有限公司;小型垂直电泳槽(Power Pac Basic),美国Bio-Rad公司;凝胶成像系统(G:BOX),美国基因公司。
1.3 方法
1.3.1 样品制备
1.3.1.1 卤料提取物制备
卤料配方F参考武苏苏等[13]方法略作修改。肉桂、良姜12%;八角、香叶、山奈、白芷、小茴香、甘草、陈皮、草果8%;砂仁、豆蔻4%;辣椒3%;丁香1%。
提取方法参考贾娜等[14]方法略作修改。卤料洗净后烘干,捣碎,过60目筛,分别取50 g到三角瓶中,按料液比1∶8添加蒸馏水/体积分数为95%的乙醇,在55 ℃水浴摇床中摇匀12 h,用0.45 μm滤膜真空抽滤,按料液比1∶7向残渣中加入蒸馏水/体积分数为95%的乙醇,重提12 h后过滤。合并滤液并在旋转蒸发仪中浓缩,最后分别用蒸馏水/体积分数为95%的乙醇定容至100 mL,得到卤料提取物(质量浓度相当于500 g/L),将醇提物和水提物分别标记为FC、FS,保存于4 ℃冰箱中待用。
1.3.1.2 肌原纤维蛋白提取
参考CAO等[15]的方法略有修改。称取 10 g鸭肉绞碎,加入4倍体积冰浴缓冲液 A(20 mmol/L磷酸盐缓冲液,100 mmol/L NaCl,2 mmol/L EGTA,10 mmol/L K2HPO4,pH 6.25)混合均匀。纱布过滤除去筋腱结缔组织,10 000 r/min匀浆 60 s,5 500 r/min,4 ℃,离心10 min取沉淀,重复以上操作2次。离心后向沉淀中加入 4倍体积冰浴缓冲液 B(100 mmol/L NaCl,1 mmol/L NaN3,pH 6.25),2 000 r/min匀浆 60 s。5 500 r/min,4 ℃,离心10 min,弃上清液取沉淀,重复上述操作,最后所得沉淀即为MP膏体。
1.3.1.3 肌原纤维蛋白氧化诱导
用pH值6.25的磷酸盐缓冲溶液稀释MP膏体,双缩脲法测定蛋白质质量浓度并调节至40 mg/mL。将其分为5组,第1组不添加抗氧化剂也不进行氧化处理(记为NonOx组),其余4组进行氧化处理,其中第2组不添加抗氧化剂(记为Ox组),第3~5组分别添加体积分数0.05%(以蛋白终浓度计)的FC、FS和0.01%BHT(分别记为Ox+FC组、Ox+FS组和Ox+0.01%BHT组),搅拌均匀后加入Feton氧化体系(10 μmol/L FeCl3,100 μmol/L抗坏血酸,1 mmol/L H2O2)于4 ℃氧化12 h,用冷冻离心机8 000 r/min离心10 min,取沉淀。
1.3.2 指标测定
1.3.2.1 多酚含量测定
采用Folin-酚法[16]测定多酚含量。以没食子酸为标准品,将其配制质量浓度为100 μg/mL没食子酸标准储备液。分别吸取0.3、0.4、0.5、0.6、0.7 mL标准储备液于10 mL比色管中,加入0.2 mL Folin-酚试剂,混匀,再加入0.5 mL饱和Na2CO3溶液,用蒸馏水稀释至10 mL,27 ℃水浴1 h后,在波长765 nm处测量吸光度值,绘制标准曲线,得到回归方程Y=0.009 7x+0.062 5,R2=0.998 3。
准确吸取0.5 mL卤料提取物于10 mL比色管中,根据上述方法测定吸光度值。通过回归方程计算多酚含量,以每克复合香辛料计,单位为mg/g。
1.3.2.2 还原力测定
参考袁娅等[17]的测定方法略有改动。分别吸取0.4 mL 5 mg/mL的FC、FS和BHT溶液(由体积分数为95%乙醇配制,且体积分数为0.01%、0.02%)于试管中。依次加入1.8 mL 0.2 mol/L的磷酸盐缓冲溶液(pH 6.6)和1 mL 10%铁氰化钾溶液。混合均匀后于50 ℃水浴30 min,急速冷却。加入1 mL 10%三氯乙酸溶液,4 000 r/min离心15 min。取1 mL上清液,依次加入2 mL蒸馏水和0.2 mL质量浓度为1 mg/mL的三氯化铁溶液,混合均匀。放置10 min后,在波长700 nm处测吸光度,以吸光度值(A700nm)表示还原能力大小。
1.3.2.3 羰基含量测定
参考OLIVE[18]等的方法略作改动。用双缩脲法测定蛋白质量浓度并调节至5.0 mg/mL。取2 mL样品溶液于离心管中,加入2 mL 10 mmol/L的2,4-二硝基苯肼(对照组加入 2 mol/L HCl,其余操作相同),室温暗处静置1 h(每隔10 min漩涡1次)。随后加入2 mL 20%三氯乙酸,10 000 r/min离心15 min,取沉淀。用2 mLV(乙醇乙酯)∶V(乙醇)=1∶1混合液洗涤沉淀3次,加入5 mL pH 6.5盐酸胍溶液,37℃下溶解沉淀20 min,于10 000 r/min离心5 min,去除不溶性部分。样品在370 nm处测定吸光值,羰基浓度用摩尔消光系数22.0 mo1/(L·cm)来计算,羰基含量表示为nmol/mg。
1.3.2.4 总巯基含量测定
参考SIMPLICIO[19]等的方法。取1 mL质量浓度4 mg/mL的样品溶液,加入8 mL Tris-甘氨酸溶液,然后经均质和10 000 r/min离心15 min,除去不溶性蛋白。取4.5 mL上清液加入0.5 mL 10 mmol/L Ellman试剂,30 min后在412 nm处测定吸光值。空白不加蛋白溶液,其他方法相同。巯基浓度计算使用摩尔消光系数13 600 M-1·cm-1,计算如公式(1)所示:
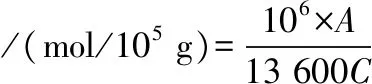
(1)
其中A,样品在412 nm处的吸光度;C,样品的蛋白的浓度,mg/mL。
1.3.2.5 浊度测定
参考韩敏义等[20]的方法测定,用冰浴磷酸盐缓冲溶液(0.6 mol/L NaCl,50 mmol/L Na2HPO4,pH 6.25)溶解肌原纤维蛋白,2 800 r/min混合匀浆36 s,最终稀释为质量浓度2.5 g/L的溶液。在室温下放置20 min后,以磷酸盐缓冲液为空白,在波长340 nm处测定吸光值,以该吸光值为肌原纤维蛋白的浊度。
1.3.2.6 溶解度测定
参考AGYARE等[21]的方法测定,将1.3.2.5中得到的2.5 mg/mL的蛋白质溶液在4 ℃下静置1 h,5 500 r/min 4 ℃离心15 min,取上清液,用双缩脲法测定肌原纤维蛋白溶液的浓度,空白用未添加肌原纤维蛋白的磷酸盐缓冲液替代。肌原纤维蛋白溶解度的计算公式为:

(2)
1.3.2.7 疏水性测定
参考CHIN等[22]的方法测定,用冰浴20 mmol/L磷酸盐缓冲溶液(pH 6.25)溶解肌原纤维蛋白,2 800 r/min混合匀浆36 s,最终稀释为质量浓度5 g/L的蛋白溶液。取1 mL样液于离心管中并加入200 μL 1mg/mL溴酚蓝,室温漩涡10 min,8 000 r/min离心10 min,取上清液,稀释10倍后在波长595 nm处测定吸光值,空白用未添加肌原纤维蛋白的磷酸盐缓冲液替代。肌原纤维蛋白表面疏水性的计算如公式(3)所示:
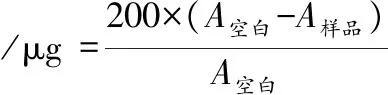
(3)
1.3.2.8 SDS-PAGE电泳分析
采用SDS-PAGE凝胶制备试剂盒制备凝胶,电泳样品用样品溶解液(内含4% SDS,10% β-巯基乙醇,20%甘油,0.02%溴酚蓝,0.125 mol/L Tris-HCl缓冲液,pH 6.8)配制成最终质量浓度为5 mg/mL的溶液,漩涡混合1 min,100℃煮沸3 min,于10 000 r/min离心10 min备用。分离胶为12%,浓缩胶为5%,将制好的胶板取下,安装至电泳槽,上样量15 μL,MAKER上样5 μL。开始电流为15 mA,待样品进入分离胶后改为恒流25 mA,当指示剂迁移至距离胶下端1 cm处关闭电源。染色1 h后脱色12 h,用凝胶系统成像。
1.3.2.9 拉曼光谱分析
取氧化诱导后的肌原纤维蛋白膏,用于拉曼光谱分析。激光波长785 nm,功率120 mW,曝光时间60 s,扫描3次,测试范围400~3 050 cm-1,测试完成后以苯丙氨酸(1 004 cm-1)为标准进行归一化,Peakfit拟合分峰;用OMNIC对拉曼光谱数据进行平滑、基线校正。
1.4 数据统计与分析
采用Microsoft Excel 2010进行数据处理;采用SPSS 19.0统计分析软件进行方差分析和显著性检验;采用Origin Pro 9.0作图。所有试验均做3次重复测定,试验数据采用平均值±标准差形式。
2 结果与分析
2.1 卤料提取物的多酚含量
香辛料的抗氧化活性与其多酚含量密切相关,且多酚与蛋白质相互作用会对蛋白质结构和功能特性产生影响[23]。由图1可知,FC和FS多酚含量分别为35.64、29.09 mg/g,FC多酚含量显著高于FS(P<0.05)。有研究发现,单一香辛料的丁香醇提物多酚含量低于水提物、桂皮醇提物多酚含量高于水提物[24-25],表明香辛料提取物的多酚含量随提取方式的不同而有所差异。香辛料中含有多酚、鞣酸等多酚类物质,可通过清除自由基、螯合金属离子及还原能力达到抗氧化效果[24]。来源不同的香辛料所含抗氧化物质不同,如丁香中的丁香子酚、姜中的姜黄素、桂皮中的桂皮酚等[8],其抗氧化效果也有所差异,研究发现,香辛料提取物的抗氧化效果随着浓度的升高而增加[24]。因此,卤料提取物的多酚含量受复配比例及提取条件影响,提取工艺仍有待进一步优化。

图1 不同卤料提取物的多酚含量
Fig.1 Polyphenol content of different halogen extracts注:不同小写字母表示不同组间差异显著(P<0.05),下同。
2.2 卤料提取物的还原力
在铁氰化钾体系吸光度值越高代表着试验物质的还原能力越强。由图2可知,FC、FS与0.01% BHT、0.02% BHT的还原力大小顺序为0.02% BHT>FC>0.01% BHT>FS,其中0.02% BHT的还原力显著高于FC、FS和0.01% BHT(P<0.05),0.01% BHT的还原力显著高于FS(P<0.05),但与FC差异不显著(P>0.05),表明5 mg/mL的FC和FS的还原力与0.01% BHT相似,因此选择0.01% BHT为对照进行试验。
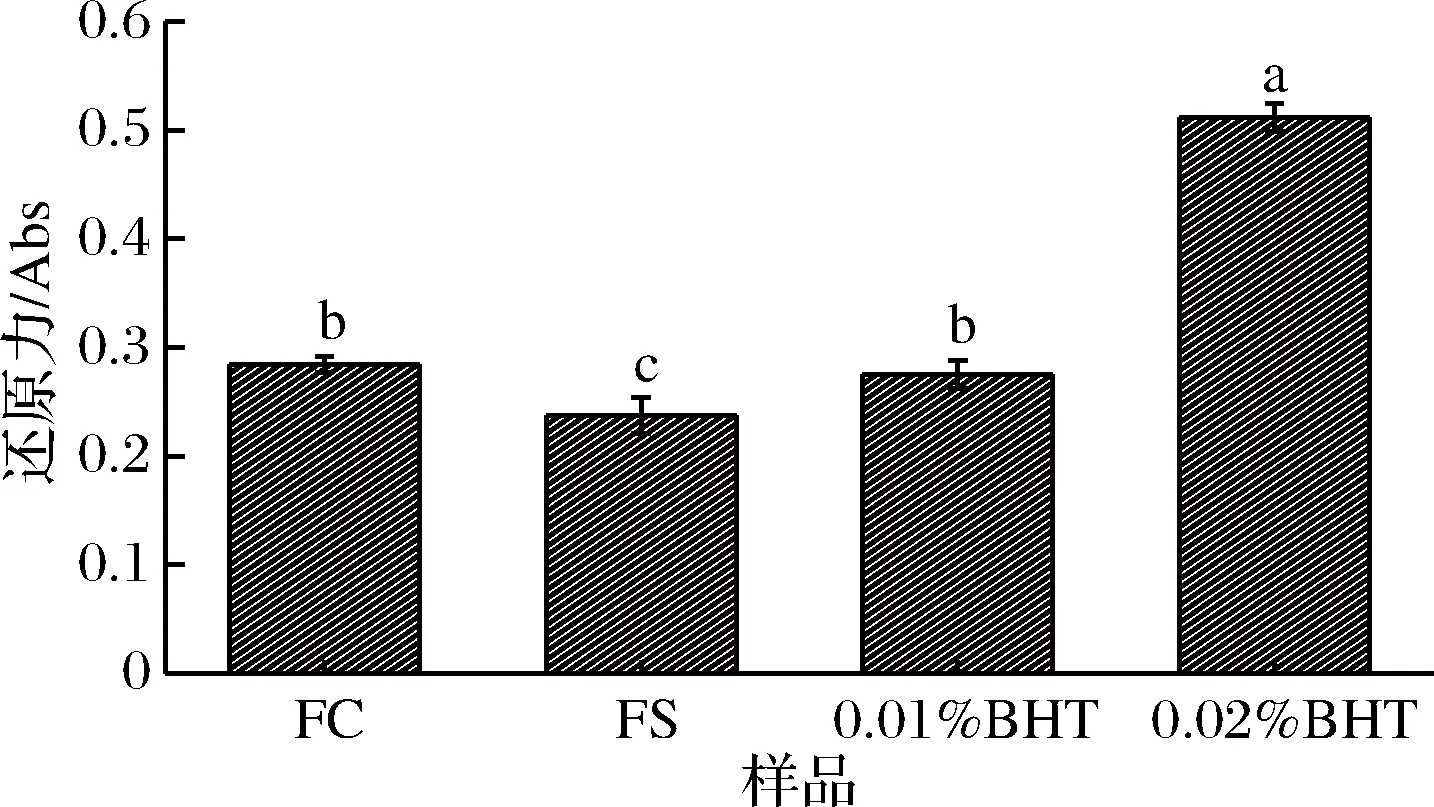
图2 卤料提取物与BHT的还原力比较
Fig.2 Comparison of reducing force of brine extracts andBHT
2.3 卤料提取物对氧化诱导肌原纤维蛋白羰基含量的影响
羰基含量被普遍认为是判断蛋白氧化程度的指标之一,且蛋白质的氧化程度随着羰基含量增加而升高[26]。由图3可知,Ox组羰基含量显著高于NonOx组(P<0.05),·OH可与蛋白质直接作用,诱导蛋白质肽链断裂及侧链基团氧化形成羰基化合物[27],导致氧化后蛋白质羰基含量升高。Ox+FC、Ox+FS和Ox+0.01%BHT组羰基含量与Ox组相比显著降低了5.80%、6.16%、4.35%(P<0.05),显著高于NonOx组(P<0.05),但3者之间差异不显著(P>0.05)。有研究发现[28],丁香提取物可抑制·OH氧化诱导的猪肉肌原纤维蛋白羰基含量的上升,这与本研究结果相似。香辛料中的多酚含有羟基氢,可与·OH反应,降低蛋白质的氧化程度,从而抑制羰基的生成。因此,卤料的抗氧化效果与0.01%BHT类似,均可抑制羰基生成。
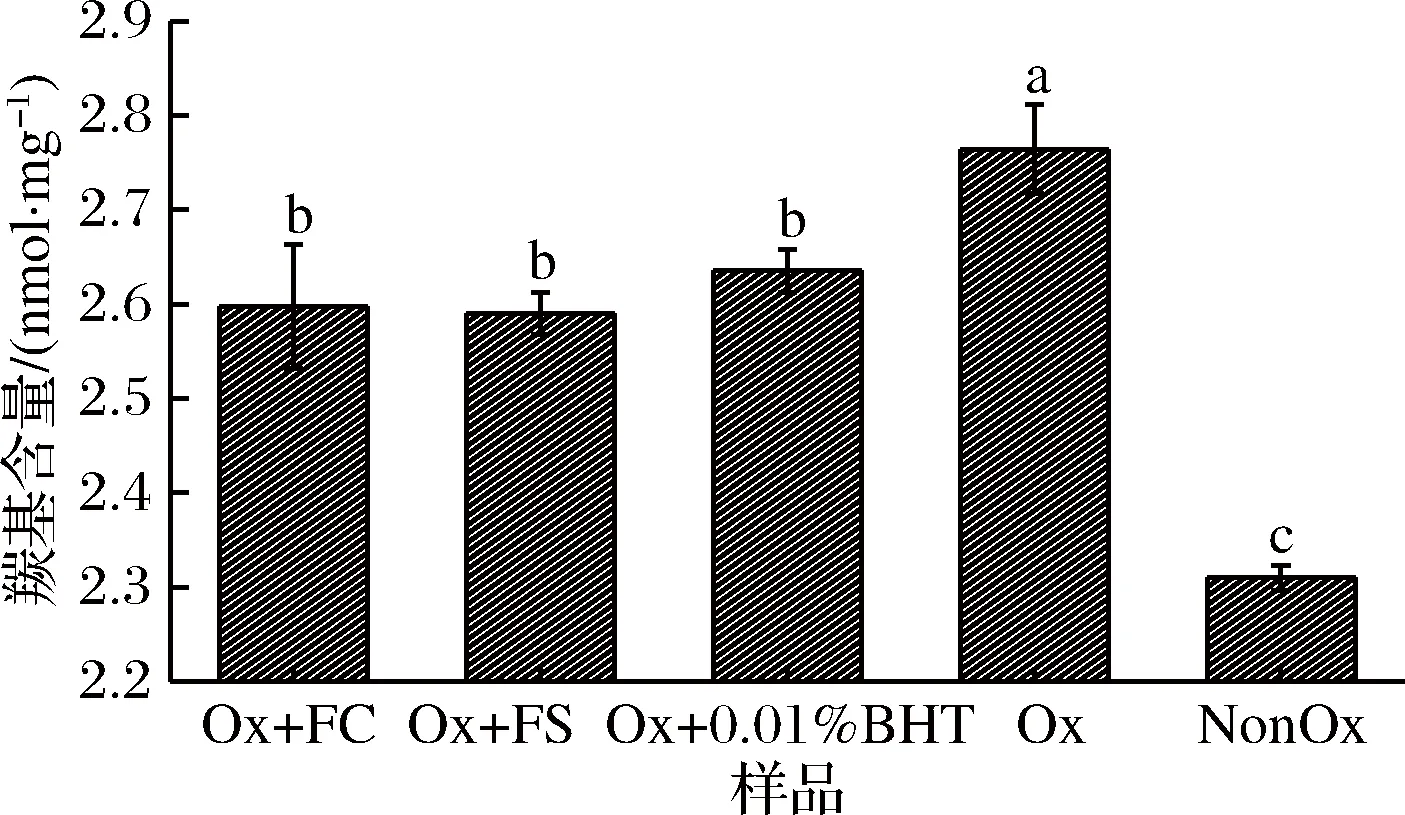
图3 卤料提取物对氧化诱导MP羰基含量的影响
Fig.3 Effect of halogen extracts on the carbonyl content of oxidized myofibrillar protein
2.4 卤料提取物对氧化诱导肌原纤维蛋白总巯基含量的影响
由图4可知,Ox组总巯基含量显著低于NonOx组(P<0.05),可能原因是氧化导致埋藏在蛋白质内部的巯基暴露出来,转化为二硫键[29],或巯基进一步转化为次磺酸或其他氧化产物[2]。Ox+FC、Ox+FS和Ox+0.01%BHT组总巯基含量均显著低于NonOx组(P<0.05),Ox+FC组总巯基含量显著高于Ox组(P<0.05),Ox+FS、Ox+0.01%BHT组的总巯基含量高于Ox组,但差异不显著(P>0.05),Ox+FC组总巯基含量显著高于Ox+0.01%BHT组(P<0.05),但与Ox+FS组差异不显著(P>0.05)。复合香辛料中的多酚可与MP中的巯基相互作用,形成复合物,从而抑制了巯基的转化[30],因此添加复合香辛料组的巯基含量高于Ox组,在本研究中添加FC可减少蛋白质的巯基的转化,且其效果优于0.01%BHT。
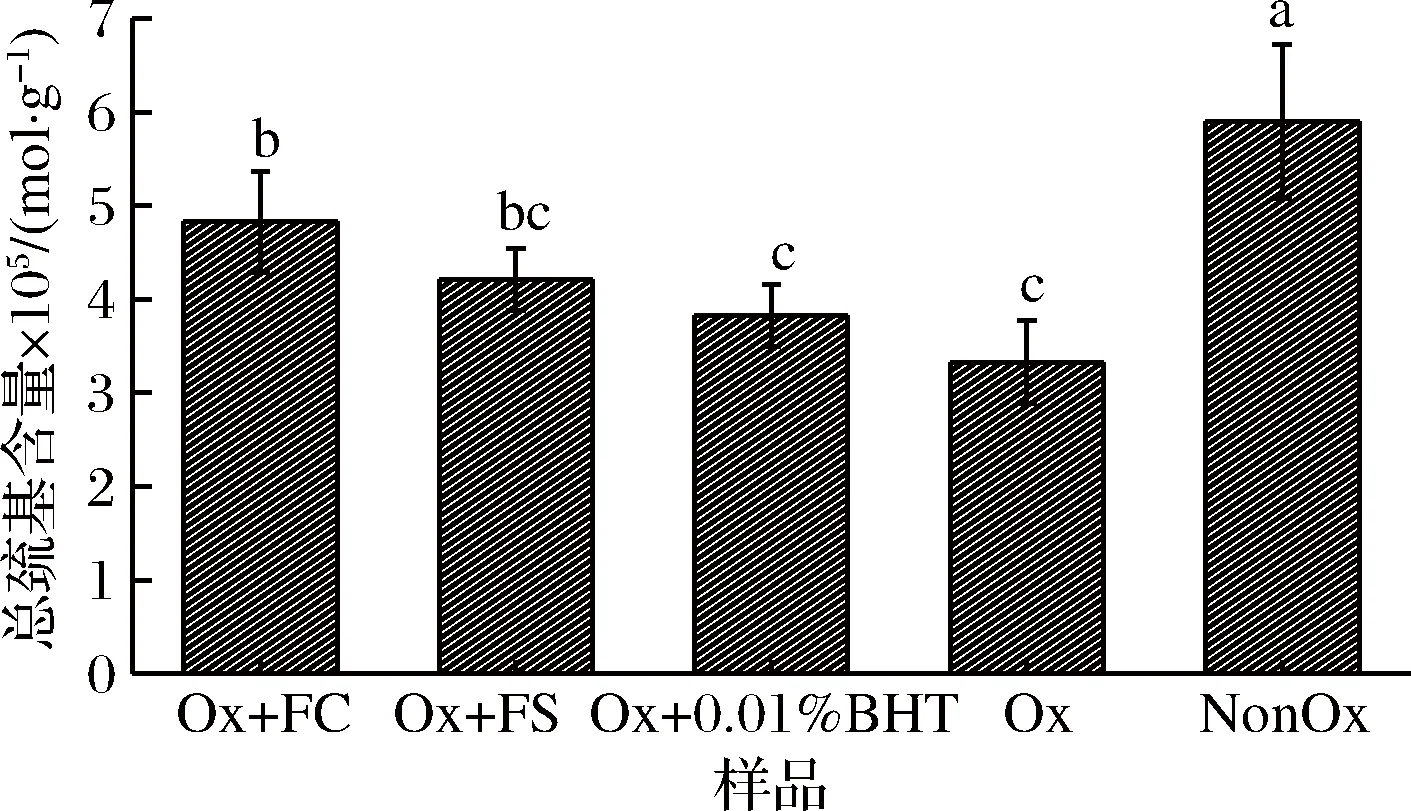
图4 卤料提取物对氧化诱导肌原纤维蛋白总巯基含量的影响
Fig.4 Effects of halogen extracts on total thiols content of oxidized myofibrillar proteins
2.5 卤料提取物对氧化诱导肌原纤维蛋白表面疏水性、浊度和溶解度的影响
由表1可知,Ox组的表面疏水性和浊度显著高于NonOx组(P<0.05),而溶解度显著低于NonOx组(P<0.05),出现这种现象的原因可能是氧化使蛋白质分子的表面疏水基团暴露出来,MP的疏水性增加[31];浊度可以反映蛋白质的聚集程度,蛋白质疏水性增加、二硫键形成均会导致蛋白质之间发生交联聚集[32],使得浊度增加,而蛋白质表面疏水性和浊度的提高会导致其溶解性下降。
氧化诱导后,Ox+FC和Ox+0.01%BHT组的表面疏水性和浊度显著低于Ox组(P<0.05),与NonOx组差异不显著(P>0.05),且Ox+FC和Ox+0.01%BHT组差异不显著(P>0.05)。而Ox+FS组的疏水性显著高于NonOx组(P<0.05),低于Ox组,但差异不显著(P>0.05),浊度高于NonOx组,但显著低于Ox组(P<0.05)。Ox+FC、Ox+FS和Ox+0.01%BHT组的溶解度均显著低于NonOx组(P<0.05),显著高于Ox组(P<0.05),且Ox+FC组的溶解度显著高于Ox+FS和Ox+0.01%BHT组(P<0.05)。贾娜等[33]研究发现0.1%肉桂、丁香提取物可降低蛋白质表面疏水性,改善猪肉糜冷藏过程中蛋白质溶解度的下降,这与本研究的结果相似。与Ox组相比,添加卤料提取物后,蛋白质的表面疏水性和浊度下降,溶解性提高的原因可能是,卤料所含多酚的芳香环可以通过疏水作用与蛋白质上的氨基酸疏水性侧链形成复合物,阻止了疏水性基团的暴露[34],从而导致可与MP结合的溴酚蓝含量减少,降低了MP的疏水性,其聚集程度随之下降,浊度降低,溶解度提高。综上所述,添加FC可以明显降低蛋白质的表面疏水性和浊度,改善蛋白质的溶解度,其抗氧化效果与添加0.01%BHT类似,均优于添加FS。

表1 卤料提取物对氧化诱导肌原纤维蛋白表面疏水性、浊度和溶解度的影响
2.6 SDS-PAGE电泳分析
肌原纤维蛋白的分子量较为广泛,肌原纤维蛋白中肌球蛋白重链(myosin heavy chain, MHC)、肌动蛋白(actin)、原肌球蛋白(tropomyosin)和肌原蛋白(troponin)含量较多,副肌球蛋白(paramyosin)和肌球蛋白轻链(myosin light chain, MLC)含量较少。由图5可知,与NonOx组相比,其余4个组MHC条带密度明显减弱,表明氧化后,肌原纤维蛋白的MHC和MLC发生了聚合或降解。
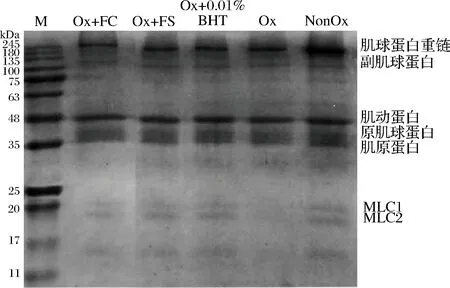
图5 不同组氧化诱导MP的SDS-PAGE电泳分析
Fig.5 SDS-PAGE electrophoresis analysis of myofibrillar proteins from different treatment groups
氧化后Ox组明显没有MLC条带,但Ox+FC、Ox+FS和Ox+0.01%BHT组的MLC条带仍然存在,只是较NonOx组浅,表明卤料抗氧化效果与0.01%BHT类似,可保护蛋白质,减缓蛋白质的氧化降解。
2.7 卤料提取物对氧化诱导肌原纤维蛋白拉曼光谱的影响
拉曼光谱的酰胺I带(1 655±5 cm-1)可以有效反映肌原纤维蛋白的二级结构[35]。由图6可知,氧化前后,拉曼光谱的酰胺I带吸收峰强度减弱,且Ox组的酰胺I带吸收峰较其他组低,说明·OH诱导的氧化可以导致蛋白质二级结构发生变化。从表2可以看出,与NonOx组相比,Ox组的α-螺旋(1 645~1 657 cm-1)含量显著降低(P<0.05),β-折叠(1 665~1 680 cm-1)含量显著增加(P<0.05)。当蛋白发生氧化后,蛋白质的酰胺I带向长波长移动,α-螺旋解旋而部分转化成β-折叠,肽链重排,蛋白的结构发生变化[36]。由于蛋白的结构紧密程度和构象稳定性大大降低,包埋于分子内部的疏水性残基暴露出来,增强了肌球蛋白分子间的疏水相互作用,引起蛋白质的聚合[37],因此氧化后,蛋白质表面疏水性和浊度升高。
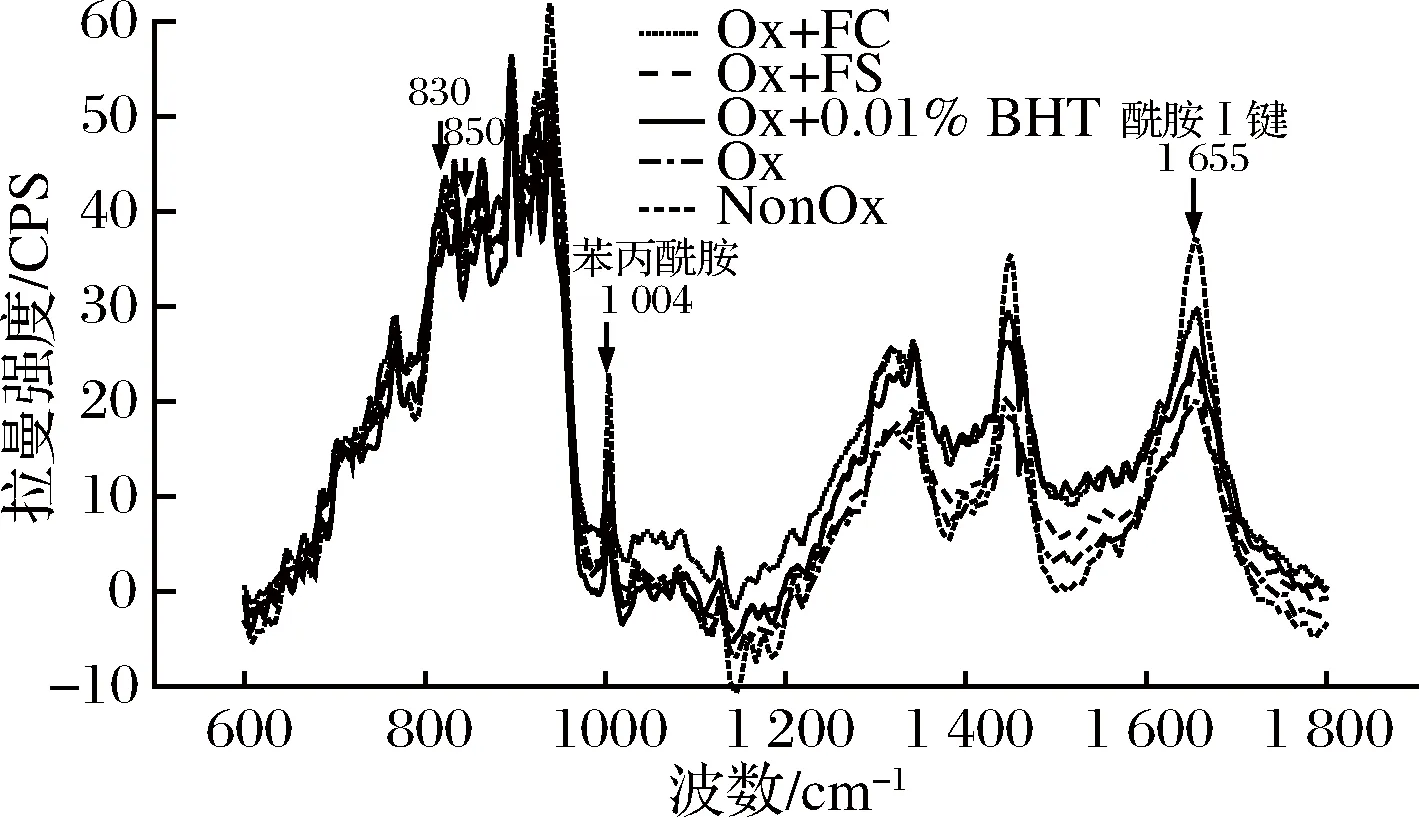
图6 卤料提取物对氧化诱导MP拉曼光谱的影响
Fig.6 Raman spectroscopic analysis of oxidation inducedmyofibrillar treated by halogen extracts
Ox+FC和Ox+0.01%BHT组的α-螺旋含量均显著高于Ox组(P<0.05),低于NonOx组,但差异不显著(P>0.05),β-折叠含量均显著低于Ox组(P<0.05),高于NonOx组,但差异不显著(P>0.05)。Ox+FS组的α-螺旋含量显著低于Ox+FC组(P<0.05),β-折叠含量则显著高于Ox+FC组(P<0.05)。多酚在一定程度上可以延缓酰胺I带的位移,抑制蛋白质结构变化,降低蛋白氧化聚合程度,从表2可知,添加FC与0.01%BHT的效果类似,可以较好的保护α-螺旋结构,减少β-折叠结构的产生,从而降低蛋白质的表面疏水性和浊度,这与上述疏水性和浊度结果一致。

表2 卤料对氧化诱导MP二级结构含量的影响
3 结论
FC的多酚含量显著高于FS(P<0.05)。FC和FS均可抑制羰基生成,保护巯基,降低蛋白质的表面疏水性和浊度,提高其溶解度,但FC的抗氧化效果更好。综合SDS-PAGE电泳及拉曼光谱分析,添加FC比FS更能有效延缓蛋白的酰胺I带向长波长移动,保护蛋白质的二级结构,能有效抑制蛋白质氧化降解、变性聚集。总的来说,FC的蛋白质抗氧化效果与0.01%BHT类似,优于FS的蛋白抗氧化效果。今后,卤料的提取工艺有待进一步优化,卤料提取物的质量浓度对蛋白质的抗氧化效果的影响仍需继续研究,相应的抗氧化性能及其机理仍需详细探讨,并可以研究对酱卤肉制品贮藏品质的影响。
