随机诱变和基因组重排选育阿维拉霉素高产菌
2019-05-07胡向东冯云会叶茂梁新乐
胡向东,冯云会, 叶茂,梁新乐
1(杭州皇冠农业生物工程技术研究中心有限公司,浙江 杭州,310012) 2(浙江工商大学 食品与生物工程学院,浙江 杭州,310018)
阿维拉霉素(avilamycin)是绿色产色链霉菌的次级代谢产物,能够有效抑制多种革兰氏阳性菌的生长,广泛应用于动物饲料添加剂[1]。研究表明,阿维拉霉素能够与核糖体A部位相互作用,干扰起始因子IF2、tRNA结合,影响多肽链的合成,从而发挥抑菌效果[2-3]。其抑菌效果与已知所有抗生素不存在交叉抑制作用,包括氯霉素、四环素、红霉素等以核糖体为靶标的抗生素[4]。阿维拉霉素现已在欧美、日本、南美、东亚等地区销售使用,我国农业部于2005年批准进口使用,批文到期后,农业部又在2015年作为动物用药物饲料添加剂批准进口,市场前景广泛。目前阿维拉霉素的产品销售及生产技术均被美国礼来公司所控制[5],国内在高产阿维拉霉素菌种选育及发酵工艺优化上仍处于开发研究阶段,还未见大规模生产的报道[6]。
阿维拉霉素为低聚糖类抗生素,由十多种不同的组分组成[7]。以阿维拉霉素A活性最高,分子式为C61H88Cl2O32,分子量1 404.24;其次是阿维拉霉素B,其分子式为C59H84Cl2O32,分子量1 375。市售[8](进口)阿维拉霉素商品多为阿维拉霉素A和阿维拉霉素B的混合物。阿维拉霉素是胞内抗生素,是一种与细胞生长相联的次级代谢产物[9],水溶性差,易分解,且其产生菌株生长周期长,对环境要求高,造成其产量较低。
目前主要通过多重诱变等方法获得阿维拉霉素高产菌株[10],但传统诱变正突变率较低,且多次反复诱变会产生抗药性,难以大幅度提高产量。基因组重排基于DNA Shuffling原理[11],结合传统诱变和原生质体融合技术,将优良性状聚集在融合菌株中,以达到育种目的。当前DNA Shuffling主要应用于改良工业微生物菌种,增强微生物对生长环境的耐受性,提高产物产率等方面。DAHIKAR等[12]采用紫外线与亚硝基胍(NTG)对分离得到的5株鼠李糖乳杆菌进行诱变,以获得的突变株作为亲本进行了2轮原生质体融合,得到的融合子在pH值4.0时L-乳酸产量为11.2 g/L,是野生菌株的1.84倍。ZHAO等[13]对1株产纤维素酶的灰绿曲霉A.glaucusHGZ-2用UV进行诱变与递归融合,经过2轮重排,得到1株突变体,其滤纸酶(filter paper enzyme, FPase)和羧甲基纤维素酶(carboxymethyl cellulose enzyme, CMCase)活性分别达到71和70 U/mL,比亲本菌株提高了1.95倍和1.72倍。此外,基因组重排技术还能增强酿酒酵母(Saccharomycescerevisiae)的乙醇耐受性并提高其酒精产量[14]。由此可见,基因组重排技术在高产菌株筛选方面具有明显优势,有望成为解决阿维拉霉素生产技术瓶颈的新突破口。
本研究以绿色产色链霉菌(S.viridoehrongenes)2-21为原始菌株,采用基因组重排技术,结合ARTP和137Csγ诱变,筛选得到高产的正突变株,再进行原生质体递归融合,最终得到1株遗传稳定的高产阿维拉霉素重组菌株H4-15。中试发酵结果表明,阿维拉霉素产量达到(2 356.44±6.34)mg/L,是原始菌株的3.47倍。为随机诱变和基因组重排技术来提高阿维拉霉素工业化产量提供了科学依据。
1 材料与方法
1.1 主要材料
1.1.1 菌株
原始菌株绿色产色链霉菌(S.viridoehrongenes)2-21,由浙江工商大学食品与生物工程学院保藏,敏感菌株藤黄微球菌(Microccusluteus)10209,购自中国工业微生物菌种保藏中心。
1.1.2 培养基配制
活化培养基(g/L):KNO31.0,可溶性淀粉20.0,K2HPO40.5,MgSO4·7H2O 0.5,FeSO40.01,NaCl 0.5,pH 7.2~7.4。
种子培养基(g/L):4.0酵母浸膏,4.0葡萄糖,10.0麦芽浸膏,0.11 CaCl2,pH 7.2~7.4。
发酵培养基(g/L):20.0可溶性淀粉,20.0豆粕粉,5.0大豆蛋白胨,7.812D-木糖,2.34L-缬氨酸,0.5 CaCO3,pH 7.2~7.4。
再生培养基:蔗糖103.0 g/L,葡萄糖10.0 g/L,蛋白胨0.1 g/L,酵母浸膏5.0 g/L,KH2PO40.25 g/L,MgCl2·6H2O 11.2 g/L,琼脂20.0 g/L。微量元素溶液2.0 mL/L,TES 10.0 mL/L。
敏感培养基(g/L):3.0 牛肉膏,10.0 蛋白胨,5.0 NaCl,15.0~20.0 琼脂,pH 7.0~7.2
1.1.3 溶液配制
高渗溶液(PB液)、微量元素、TES缓冲液等参照文献[15]。
1.2 实验方法
1.2.1 菌种活化及培养
取菌种干粉溶于适量ddH2O中,并接种活化培养基,28 ℃培养5~7 d。活化菌种接至种子培养基,28 ℃、220 r/min培养36~48 h,获得种子培养液。
1.2.2 单孢子菌悬液的制备
取对数期的菌株S.viridoehrongenes2-21孢子斜面,无菌生理盐水洗涤斜面,转入无菌离心管中,经脱脂棉过滤得单孢子悬液并计数到107个/mL。
1.2.3 摇瓶发酵培养
将种子培养液接入液体发酵培养基,接种量5%,28 ℃、220 r/min培养8~10 d。
1.2.4 等离子诱变(ARTP)育种
菌悬液均匀地涂布于小铁片并晾干,ARTP分别照射30、60、120、180、240 s。将铁片用无菌生理盐水洗脱并稀释,涂布活化培养基,28 ℃培养5~7 d。计算致死率。选择菌落较大、菌丝较密的菌株进行初筛和复筛,测定各菌株生物量和阿维拉霉素含量。
1.2.5137Csγ诱变育种
单孢子菌悬液计数到107个/mL,137Csγ射线分别照射200、300、350、500、700 Gy。涂布活化培养基,28 ℃培养5~7 d。观察菌落生长状态,以未经诱变处理的菌悬液为对照,计算致死率。选择菌落较大、菌丝较密的菌株进行初筛和复筛,测定各菌株生物量和阿维拉霉素含量。
1.2.6 抗性突变株的筛选
配制一定浓度的利福平溶液添加到活化培养基中,将诱变后的单孢子菌悬液涂布活化培养基,28 ℃培养3~5 d,挑取单菌落,进行突变株的筛选。初筛采用琼脂块法[16];复筛采用管碟法[17]。
1.2.7 原生质体融合
取5 mL菌液8 000 r/min离心10 min,弃上清液。加入5 mL体积分数为0.2%的溶菌酶重悬,35 ℃水浴2 h。用带有脱脂棉的一次性针筒过滤酶解液并收集滤液,4 ℃、2 000 r/min离心15 min,弃上清液。PB溶液重悬沉淀,并制备浓度为107个/mL的原生质体悬液。每个样品各取1 mL原生质体悬液混匀,4 ℃、2 000 r/min离心15 min,弃上清液。缓慢加入1 mL体积分数为40%的PEG6000,轻微振动,25 ℃静置20 min。4 ℃、2 000 r/min离心15 min,弃上清。PB液洗涤1次,4 ℃、2 000 r/min离心15 min,弃上清。加入5 mL PB液重悬,取0.1 mL涂布于再生平板上,28 ℃培养5~7 d。筛选出高产突变体进行循环原生质体融合。
1.2.8 菌株稳定性验证
经ARTP和137Csγ射线混合诱变后的高产阿维拉霉素菌株,连续传代培养5次,分别测定其生物量和阿维拉霉素产量,评估其遗传稳定性。
1.2.9 菌株扩大化培养
将遗传稳定菌株进行10 L发酵罐扩大培养。装液量60%,通气量1.2 vvm,转速300 r/min,pH值7.4,溶氧体积分数不低于30%。发酵过程中,测定pH值、菌体干重、阿维拉霉素产量、还原糖等指标。
1.3 分析方法
1.3.1 阿维拉霉素含量的测定
采用HPLC法。取30 mL发酵液,4 ℃、8 000 r/min离心10 min,弃上清液。加入3倍体积甲醇,37 ℃浸泡沉淀16~24 h,离心取上清液。0.22 μm有机膜过滤后备测。液相测定条件:色谱柱Eclipse plus C18(150 mm×4.6 mm,5 μm),柱温:30 ℃,检测波长295 nm,流速1.0 mL/min,流动相V(乙腈)∶V(0.1 mol/L乙酸铵)=49∶51。
1.3.2 其他指标及测定方法
菌丝干重测定参照文献[10];还原糖的测定采用DNS法[18]。
1.3.3 数据处理与统计分析
各指标测定结果以X±S(平均数±标准误)表示,应用SPSS 22.0进行数据分析,P<0.05为显著性差异,P<0.01为极显著性差异。采集数据应用Origin 9.0进行分析作图。
2 结果与分析
2.1 随机诱变育种结果
2.1.1 ARTP最佳照射剂量的确定
ARTP剂量用照射时间来表示,对原始菌株S.viridoehrongenes2-21进行ARTP照射处理,计算致死率。由图1可知,当照射时间为240 s时,其致死率高达92%左右。等离子诱变的照射时间不易过长,因此本实验选取200 s作为ARTP最佳照射时间。
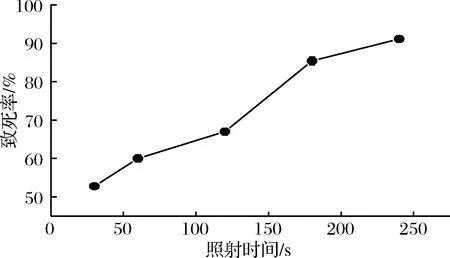
图1 ARTP对S.viridoehrongenes 2-21的致死率
Fig.1 The lethality rate of ARTP irradiation onS.viridoehrongenes 2-21
2.1.2137Csγ射线照射剂量的确定
取ARTP照射后的优势菌株,进行137Csγ射线辐照,计算致死率。由图2可知,随着照射剂量的增加,菌株的致死率提高;当照射剂量为550 Gy时,致死率接近100%,因此选择500 Gy为最适照射剂量。

图2 137Csγ对S.viridoehrongenes 2-21的致死率
Fig.2 The lethality rate of 137Csγ irradiation onS.viridoehrongenes 2-21
2.1.3 ARTP诱变及第1轮137Csγ诱变育种结果
对原始菌株2-21进行ARTP及137Csγ诱变,初筛得到164个单菌落,从中挑选出26个菌落较大、颗粒较饱满的相对优势菌株进行摇瓶发酵复筛,测定生物量和阿维拉霉素产量。

表1 ARTP诱变及第1轮137Csγ诱变育种结果
注:诱变菌株与原始菌株S.Viridoehrongenes2-21比较,*差异显著,P<0.05,**差异极显著,P<0.01;n=3。表2同。
由表1可知,菌株C1-10和C1-22的阿维拉霉素产量较高,分别为(932.65±4.98)和(943.68±2.56)mg/L,是原始菌株的1.37和1.39倍。
2.1.4 第2次137Csγ诱变育种结果
对第1轮诱变后的菌株C1-10和C1-22进行2次诱变,利用琼脂块法对诱变菌株进行初筛,从98株菌株中挑选出18株相对高产菌株进行摇瓶发酵复筛,测定生物量和阿维拉霉素产量。由表2可知,菌株C2-3、C2-8和C2-14的阿维拉霉素产量有所提高,其中菌株C2-8的产量达到了(1 278.43±3.23)mg/L是原始菌株的1.88倍。

表2 第2轮137Csγ诱变育种结果
2.2 基因组重排育种结果
2.2.1 利福平最小抑菌浓度确定
以原始菌株2-21及2轮随机诱变后的突变株C1-10、C1-22、C2-3、C2-8和C2-14作为亲本进行原生质体融合,并做利福平最小抑菌浓度实验。配制质量浓度为40、80、160、240和320 mg/L利福平抗性培养基,28 ℃培养7 d,观察菌落生长情况。

表3 亲本菌株在利福平不同质量浓度抗性下的生长情况
注:“+++”表示菌落生长旺盛;“++”表示菌落生长均匀;“+”表示菌落较少;“—”表示几乎无菌落。
由表3可知,菌株C1-10及C2-14的最小抑制质量浓度为160 mg/L;而其他菌株能在240 mg/L抗性平板上生长,但是在320 mg/L几乎无生长,因此可采用320 mg/L作为最小抑制浓度。
2.2.2 第1轮原生质体融合结果
抗性培养基中利福平质量浓度为350 mg/L。挑出性状优良的38株菌进行摇瓶复筛,测定阿维拉霉素含量,如图3所示。5株融合子(H1-10、H1-14、H1-20、H1-29、H1-37)的阿维拉霉素产量有所提高,其中H1-20的阿维拉霉素产量为(1 471.36±11.06) mg/L,是原始菌株的2.17倍。

图3 第1轮融合子摇瓶发酵复筛
Fig.3 The screening of the first round generation fusants of shake-flask fermentation
2.2.3 第2轮原生质体融合结果
抗性培养基中利福平质量浓度为400 mg/L。第1轮融合子H1-10、H1-14、H1-20、H1-29、H1-37作为亲本菌株,筛选出性状优良的30株菌进行摇瓶复筛,如图4所示。5株融合子(H2-6、H2-11、H2-25、H2-26、H2-29)的阿维拉霉素产量均较高,其中H2-29的阿维拉霉素产量为(1 673.26±12.62) mg/L,是原始菌株的2.47倍。
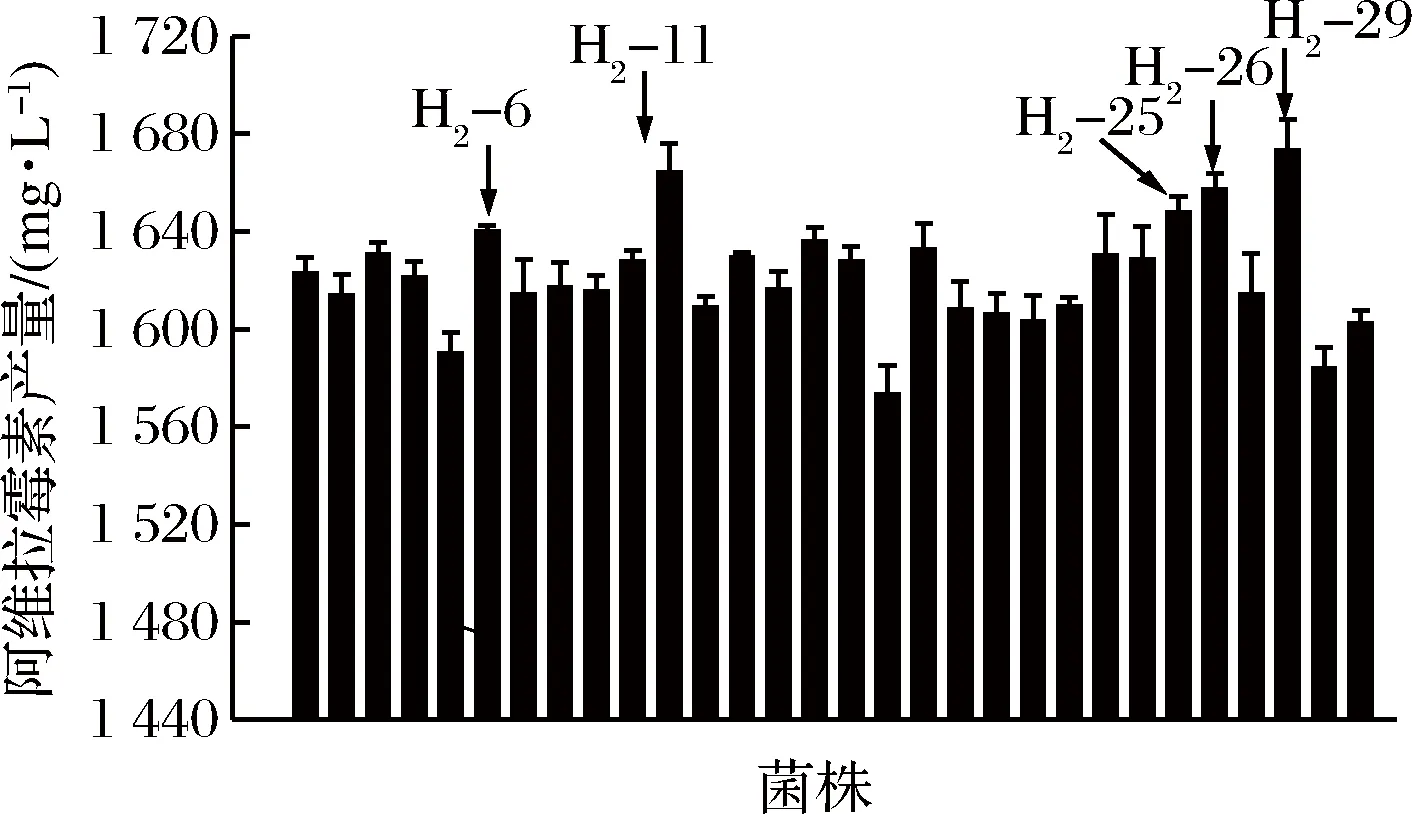
图4 第2轮融合子摇瓶发酵复筛
Fig.4 The screening of the second round generation fusants of shake-flask fermentation
2.2.4 第3轮原生质体融合结果
抗性培养基中利福平质量浓度为500 mg/L。第2轮融合子H2-6、H2-11、H2-25、H2-26、H2-28作为亲本菌株,筛选出性状优良的25株菌进行摇瓶复筛,如图5所示。5株融合子(H3-1、H3-5、H3-9、H3-16、H3-21)的阿维拉霉素产量较高,其中H3-16的阿维拉霉素产量为(1 944.40±6.01) mg/L,是原始菌株的2.87倍。
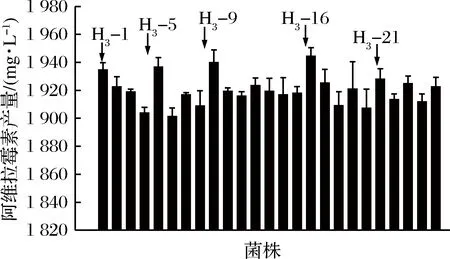
图5 第3轮融合子摇瓶发酵复筛
Fig.5 The screening of the third generation fusants of shake-flask fermentation
2.2.5 第4轮原生质体融合结果
抗性培养基中利福平质量浓度为600 mg/L。第3轮融合子H3-1、H3-5、H3-9、H3-16、H3-21作为亲本菌株,筛选出性状优良的20株菌进行摇瓶复筛,如图6所示。3株融合子(H4-5、H4-11、H4-15)的阿维拉霉素产量较高,其阿维拉霉素产量分别为(2 146.64±16.53)、(2 119.48±1.10)、 (2 155.48±7.81) mg/L,分别是原始菌株的3.16、3.12、3.18倍。

图6 第4轮融合子摇瓶发酵复筛
Fig.6 The screening of the fourth generation fusants of shake-flask fermentation
2.3 稳定性遗传试验
经过2轮随机诱变4轮原生质体融合后得到3株产量较高的优势菌株,进行稳定性遗传试验,如表4所示。传代培养5次后,菌株H4-15具有良好的稳定性,阿维拉霉素产量达到(2 155.48±7.81) mg/L,而H4-5、H4-11遗传稳定性较差,所以最终得到1株稳产、高产的阿维拉霉素产生菌H4-15。
2.4 高产突变菌株H4-15的扩大化培养
将菌株H4-15进行中试扩大化培养,如图7所示。菌株pH值呈现先下降后上升的趋势;菌株对糖的消耗在1~2 d时有所停顿,之后迅速下降。1~2 d是菌株的前期准备阶段,此时菌体生长旺盛,菌体快速积累,培养基中菌丝体干重迅速增加,但随着发酵的进行,培养基中的氮源及碳源逐渐馈乏,有害产物积累,致使菌株干重逐渐下降。4 d开始进入阿维拉霉素合成期,此时阿维拉霉素合成速度较快,第6天时含量达到最高。之后菌体发生自溶,含量有所下降。第8天时阿维拉霉素含量又有所回升,说明绿色产色链霉菌的代谢过程中存在2次生长情况。发酵过程中阿维拉霉素产量最大达到(2 356.44±6.34) mg/L,比摇瓶发酵提高了9.68%,是原始菌株的3.47倍。
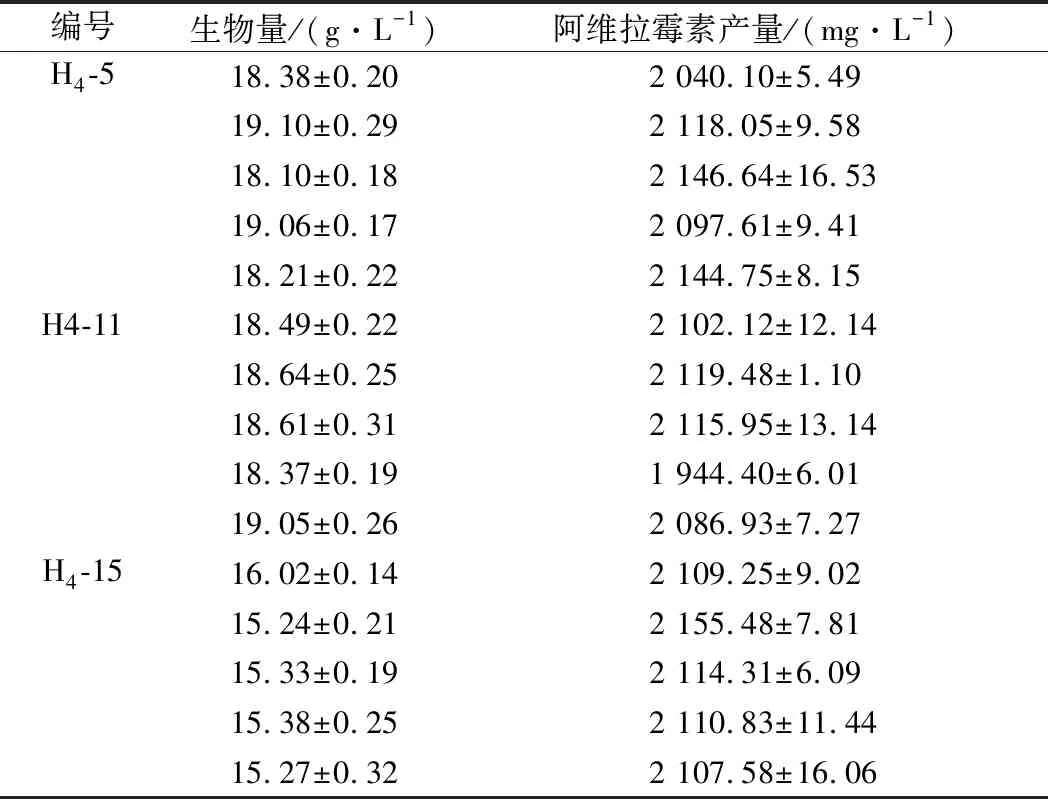
表4 融合高产菌株稳定性实验结果

图7 高产菌株H4-15扩大化培养结果
Fig.7 Fermentation process of S.viridochromogenesH4-15 in a 10 L Fermenter
2.5 菌株H4-15发酵产物阿维拉霉素组分验证
据报道阿维拉霉素具有多种结构类似物,以A组分的活性最高,B组分次之。对菌株H4-15发酵产物进行LC-MS测定,如图8所示。发酵液中主要成分是Ⅰ和Ⅱ,结合图9可知,组分Ⅰ分子量(M-H-)1 403.45,结合相关文献[19-20],组分Ⅰ为阿维拉霉素A;结合图10可知,组分Ⅱ分子量(M-H-)1 373.41,结合相关文献[19-20],组分Ⅱ为阿维拉霉素B。

图8 高产菌株H4-15发酵液浸提物色谱图
Fig.8 Diagram of the fermentation product of H4-15

图9 阿维拉霉素组分A的质谱图
Fig.9 Diagram of avilamycin A
图10 阿维拉霉素组分B的质谱图
Fig.10 Diagram of avilamycin B
3 结论与讨论
建立高效筛选方法是抗生素菌种选育的关键,本文采用等离子(ARTP)诱变和137Csγ诱变,并结合基因组重排技术,对绿色产色链霉菌高产菌进行筛选。ARTP诱变技术已成功应用于高效产氢菌Enterobacteraerogenes的选育中,最终致使其通过NADH途径,产氢能力显著提高,是原始菌株的14倍[21]。基因组重排育种技术作为一种新型、有效的技术,与经典的诱变育种协同使用,能够更好地筛选出高产突变菌株,且不易产生回复突变。文献[22]中依次经过UV-LiCl、60Co-γ诱变及5轮原生质体融合,得到1株产量为(68.10±0.56)mg/L的高产菌。刘芳等[23]采用紫外-氯化锂、微波-吖啶橙复合诱变,结合氯化钙、阿维拉霉素、链霉素多重抗性筛选,获得1株遗传稳定的MY-20菌株,168 h后阿维拉霉素A和B组分产量达到了0.95和4.62 g/L,分别比出发菌株提高了428%和237%。毛灵琪等[24]以不同的诱变方法及几十轮基因组重排,筛选到了1株高产菌株R708,其产量比出发菌株提高了20倍,摇瓶发酵产量达到了0.208 g/L。
本文经随机诱变和基因组重排最终选育出1株阿维拉霉素高产重组菌株H4-15,遗传性能稳定,其摇瓶产量为(2 155.48±7.81) mg/L,是原始菌株S.viridoehrongenes2-21的3.18倍。经中试扩大化培养,其产量可达到(2356.44±6.34)mg/L,是原始菌株的3.47倍,其主要成分为阿维拉霉素A和阿维拉霉素B,具有工业化生产的潜在价值。
绿色产色链霉菌S.viridoehrongenes2-21是阿维拉霉素生产的优良潜力菌株,以利福平作为抗性筛选剂,通过随机诱变和基因组重排技术的结合能大幅提升其产素能力,有望成为解决阿维拉霉素生产技术瓶颈的研究热点。
