川陈皮素对非酒精性脂肪性肝病大鼠肝细胞凋亡的影响*
2019-05-06石安华范英昌武俊紫何朋伦周青丽陈文慧
石安华,范英昌,姚 政,武俊紫,何朋伦,王 维,周青丽,陈文慧△
(1.天津中医药大学,天津 300193;2.云南中医药大学,云南 昆明 650500)
当前随着我国社会经济的发展和人们运动量的相对减少,非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD)的发生率逐年升高[1]。有研究显示,在我国NAFLD已经成为仅次于病毒性肝炎的第2大疾病[2]。NAFLD临床中主要表现为肝脏脂肪颗粒的过量聚集,此时需积极控制,如若控制不佳,可造成肝纤维化、肝硬化甚至肝癌的发生,而在上述的发生和进展过程中,肝细胞凋亡伴随其中[3]。目前西医治疗本病并没有特效药,近年来国内外学者采用传统中医药治疗NAFLD发现独特的优势[4],但是中医药汤剂在治疗本病时存在有效药理成分不明确的问题,因此采用中药单体治疗NAFLD是当前研究的热点。目前的研究显示,多种中医药单体在调节NAFLD血脂、改善肝功能方面具有独特的优势,特别是黄酮类化合物[5-6]。川陈皮素(nobiletin)是从中药陈皮中提取的一类多甲氧基黄酮类化合物,其在抗氧化、改善记忆、抗癌等多种慢性疾病治疗方面已有众多的研究报道[7-8]。但其对 NAFLD的治疗作用还缺少相关研究证实,本实验通过复制NAFLD大鼠模型,探讨川陈皮素治疗后大鼠肝细胞调亡相关基因表达特点,以进一步明确川陈皮素治疗NAFLD的作用机制。
1 材料和方法
1.1 实验动物、饲料和垫料 健康清洁级SD大鼠72只,6周龄,体质量160~180 g,由昆明医科大学动物实验中心提供(动物合格证号为:SYXK(滇)2011-004)。购买后饲养于云南中医药大学动物实验部,日常由其自由饮食,室温为20~24℃,光照/黑暗=12 h/12 h,普通饲料、饲养用垫料均由昆明医科大学提供;高脂饲料由本课题组提供配方(普通饲料加10%猪油,2%胆固醇),交由昆明医科大学动物实验中心配置。
1.2 实验材料和仪器 川陈皮素购于酷尔化学科技(北京)有限公司;水飞蓟素胶囊购于天津天士力圣特制药有限公司;谷丙转氨酶(Alanine transaminase,ALT)、谷草转氨酶(Aspartate transaminase,AST)、总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、低密度脂蛋白胆固醇(Low density lipoprotein cholesterol,LDL-C)和高密度脂蛋白胆固醇(High density lipoprotein cholesterol,HDL-C)试剂盒购于武汉默沙克生物科技有限公司、白介素-1a(Interleukin-1a,IL-1a)、 白 介 素 -1b(Interleukin-1b,IL-1b)和白介素 -6(Interleukin-6,IL-6)试剂盒购于武汉博士德生物有限公司;肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、肿瘤坏死因子受体 1(Tu mor necrosis factor receptor 1,TNFR-1)、跨膜糖蛋白(Fas)、跨膜糖蛋白配体(FasL)、半胱氨酸天冬氨酸蛋白酶8(Caspase-8)、半胱氨酸天冬氨酸蛋白酶3(Caspase-3)、B-细胞淋巴瘤/白血病-2原癌基因(Bcl-2)、Bcl-2相关基因(Bax)蛋白以及 β-actin抗体购于美国Santa公司;
酶标仪(HBS-1096A型,南京德铁实验设备有限公司);全自动生化分析仪(CHEMIX-180型,日本SYSMEX公司);精密电子天平(AB135-S型,上海精密仪器仪表有限公司);蛋白电泳仪(Mini Gel型,赛默飞世尔中国有限公司);PCR仪(ProFlex型,赛默飞世尔中国有限公司)。
1.3 动物分组、造模和给药剂量 所有大鼠在购买后均给予适应性喂养2周,2周后采用随机数字法将大鼠分为6组,分别为正常组、模型组、阳性药物水飞蓟素治疗组、川陈皮素低、中、高剂量组,每组12只。除正常组外,其余5组给予高脂饮食8周,构建NAFLD模型(模型构建成功的标准为每组各处死2只大鼠,血清肝功能指标检测和肝脏切片病理学观察,有明显脂肪肝表征时证明造模成功)。
造模成功后,给予相应治疗,其中正常组和模型组给予每日10 mL/kg生理盐水灌胃,水飞蓟素组以水飞蓟素14 mg/kg灌胃治疗,川陈皮素低、中、高剂量组给予川陈皮素100、200、400 mg/kg灌胃治疗,水飞蓟素给药剂量根据大鼠和人体换算公式计算得到,川陈皮素给药剂量根据文献报道[9]确定,每天给药1次,连续给药6周。
1.4 肝脏和血液收集 于前夜禁食不禁水12 h后,次日称重后处死大鼠,处死时采用3 mL的1%水合氯醛腹腔注射麻醉,麻醉后固定于解剖板,心脏取血法收集大鼠血液,血液收集后分装于1.5 mL的离心管中,离心后提取上清液,-20℃冰箱保存备用。之后剖开腹腔,取出肝脏,采血后即刻脱颈处死大鼠,作腹部正中切口打开腹腔,取出完整肝脏,称重后,切取肝左叶置于4%的中性福尔马林溶液中保存备用于HE染色,其它组织切成4小块分装于冻存管中置于超低温冰箱中备用于蛋白和mRNA的检测。
1.5 一般情况、肝指数及相关生化指标检测 大鼠一般情况要求每天记录,主要观察大鼠毛色、体重生长情况、饮食、大小便以及死亡情况。大鼠肝指数为肝脏重量 /大鼠体重×100%。ALT、AST、HDL-C、LDL-C、TC和TG根据试剂盒说明书采用全自动生化仪检测。IL-1a、IL-1b和IL-6严格按照试剂盒说明书操作,采用酶标仪检测。
1.6 组织病理学检测 从中性福尔马林溶液中取出肝组织,进行常规石蜡包埋和切片,切片后,采用二甲苯脱蜡、梯度酒精清洗、超纯水清洗、苏木紫染色、清洗后伊红染色、二甲苯透明封片。制片成功后光镜下观察收集图像。
1.7 凋亡相关蛋白检测 称取1g肝脏组织,用组织蛋白裂解液裂解后提取上清,BCA法定量后调平,每组各取50 μg行SDS-PAGE电泳,电泳完成后将目的条带转移至PVDF膜,之后依次按照5%脱脂奶粉封闭2 h后PBST洗涤3次、加入一抗过夜后洗涤3 次[TNF-α(1 ∶5 000)、TNFR-1(1 ∶5 000)、Fas(1 ∶3 000)、FasL(1 ∶1 000)、Caspase-8(1 ∶2 000)、Caspase-3(1 ∶2 000)、Bcl-2(1 ∶5 000)和 Bax(1 ∶5 000)]、加入二抗(1∶5 000)2 h 后洗涤 3 次,暗室曝光、显影定影后扫描仪收集图片,Image J计算每个条带的灰度值,每组实验重复3次。
1.8 凋亡相关蛋白mRNA检测 称取100 mg肝脏组织,采用总RNA试剂盒提取总RNA,琼脂糖凝胶电泳确认成功提取后,定量并调平,每组各取2 μg将其逆转录合成cDNA,之后即进行qRT-PCR电泳,电泳条件为扩增95℃预变性2 min;95℃变性10 s,退火60℃、30 s,72℃延伸35 s,循环次数35次。采用2-ΔΔCt法计算目的基因相对表达量。引物序列设计为表1所示。

表1 引物序列设计表
2 结果
2.1 大鼠一般情况 正常组大鼠精神活跃,毛色发亮,饮食和生长均正常;相较于正常组,模型组在造模成功后体重明显增加,小便量增加,大便油腻发臭,毛色发黄,饮食量相较于正常组有一定的降低,药物治疗后,模型组体重增加幅度降低;水飞蓟素片治疗组以及川陈皮素低、中、高剂量组相较于模型组上述表现改善,特别是活动量有明显增加。
2.2 大鼠肝脏病理学 光镜下,正常组大鼠肝细胞大小均一,肝小叶结构正常,看不到任何脂肪变性以及炎细胞浸润,模型组则出现明显的肝细胞损伤,主要表现为肝细胞可见大量脂肪空泡,严重者空泡融合,将胞核挤向一侧,同时也可见肝细胞胞浆疏松化、气球样变,炎细胞浸润。相较于模型组,水飞蓟素片以及川陈皮素低、中、高剂量组肝脏上述病变明显减轻。
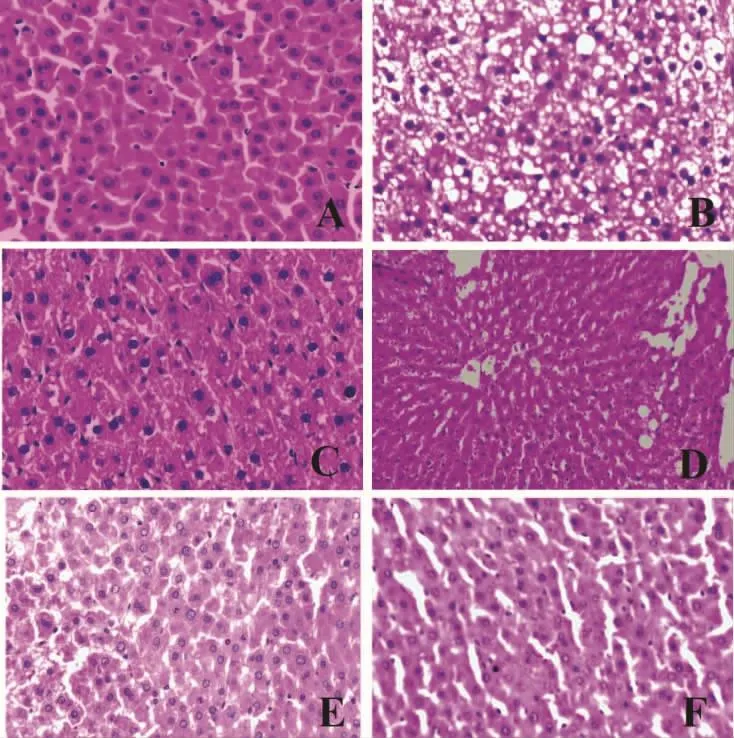
图1 大鼠肝脏HE染色镜下观(20×20)
2.3 大鼠肝指数 与正常组相比,模型组大鼠肝湿重和肝指数明显升高(P<0.05);相较于模型组,水飞蓟素片治疗组以及川陈皮素低、中、高剂量组肝湿重和肝指数明显降低(P<0.05);此外川陈皮素高剂量组肝指数明显低于水飞蓟素片治疗组(P<0.05);而体重各组间则没有明显差异,详见表2。
表2 治疗前后各组大鼠肝重、体重和肝指数的变化(±s,n=12)
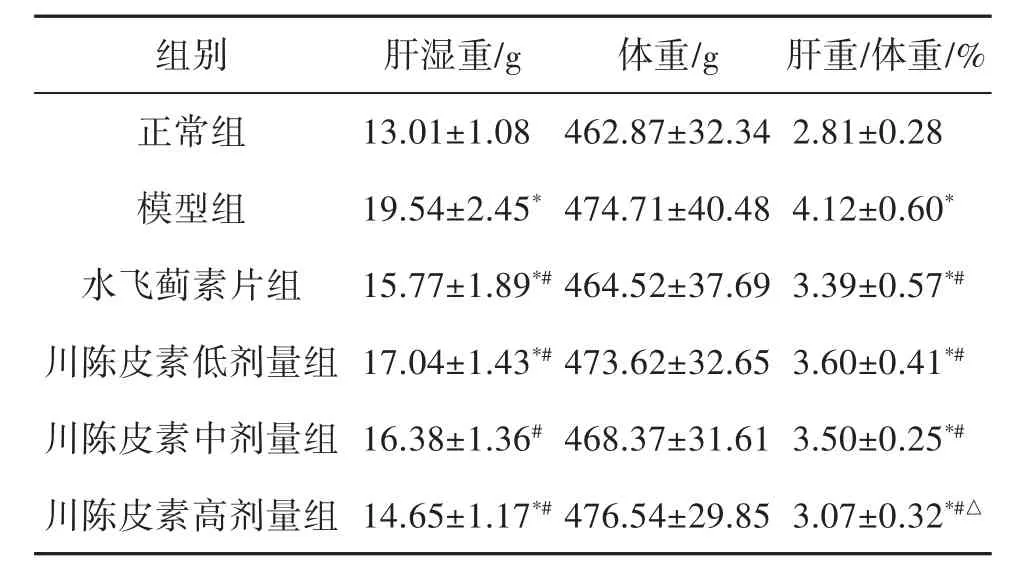
表2 治疗前后各组大鼠肝重、体重和肝指数的变化(±s,n=12)
注:与正常组相比,*P<0.05;与模型组相比,#P<0.05;与水飞蓟素片组相比,△P<0.05
组别 肝湿重/g 体重/g 肝重/体重/%正常组 13.01±1.08 462.87±32.34 2.81±0.28模型组 19.54±2.45*474.71±40.48 4.12±0.60*水飞蓟素片组 15.77±1.89*#464.52±37.69 3.39±0.57*#川陈皮素低剂量组 17.04±1.43*#473.62±32.65 3.60±0.41*#川陈皮素中剂量组 16.38±1.36#468.37±31.61 3.50±0.25*#川陈皮素高剂量组 14.65±1.17*#476.54±29.85 3.07±0.32*#△
2.4 大鼠肝功能 与正常组相比,模型组大鼠血清肝功能指标ALT和AST明显增高(P<0.05);与模型组相比,水飞蓟素片治疗组以及川陈皮素低、中、高剂量组则明显降低(P<0.05),此外,川陈皮素高剂量组ALT和AST均低于水飞蓟素片治疗组(P<0.05),详见表3。
表3 治疗前后大鼠血清肝功能指标ALT和 AST 的变化(±s,n=12,U/L)
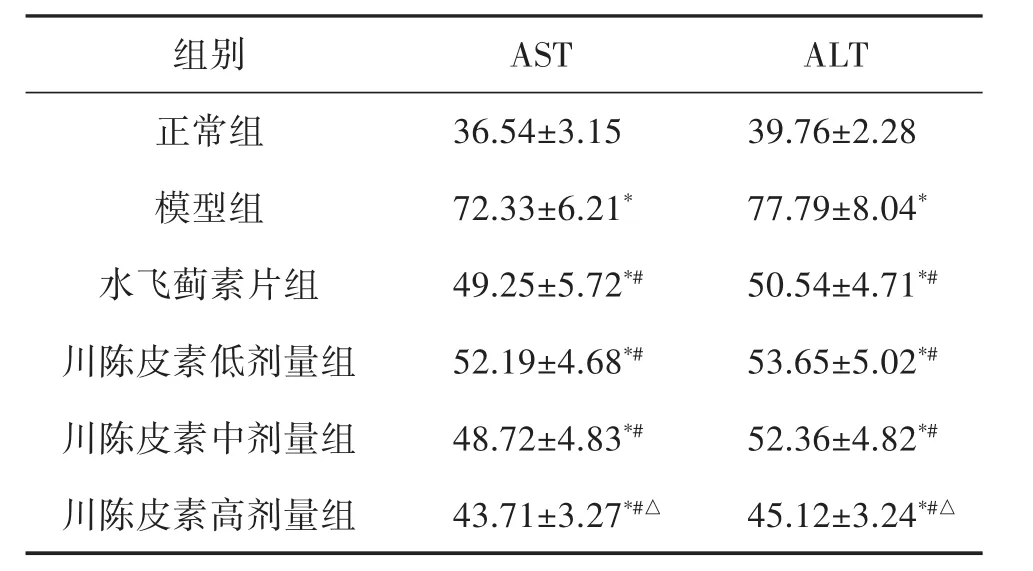
表3 治疗前后大鼠血清肝功能指标ALT和 AST 的变化(±s,n=12,U/L)
注:与正常组相比,*P<0.05;与模型组相比,#P<0.05;与水飞蓟素片组相比,△P<0.05
组别 AST ALT正常组 36.54±3.15 39.76±2.28模型组 72.33±6.21* 77.79±8.04*水飞蓟素片组 49.25±5.72*# 50.54±4.71*#川陈皮素低剂量组 52.19±4.68*# 53.65±5.02*#川陈皮素中剂量组 48.72±4.83*# 52.36±4.82*#川陈皮素高剂量组 43.71±3.27*#△ 45.12±3.24*#△
2.5 大鼠血脂 与正常组相比,模型组大鼠血清血脂指标TG、TC和LDL-C含量明显升高(P<0.05),HDL-C明显降低(P<0.05);与模型组相比,水飞蓟素片治疗组以及川陈皮素低、中、高剂量组TG、TC和LDL-C含量均明显降低(P<0.05),HDL-C明显升高(P<0.05);此外,川陈皮素中剂量和高剂量组TG、TC和LDL-C明显低于水飞蓟素片治疗组(P<0.05),HDL-C明显高于水飞蓟素片治疗组(P<0.05),详见表4。
表4 治疗前后各组大鼠血脂指标的变化(±s,n=12,mmol/L)
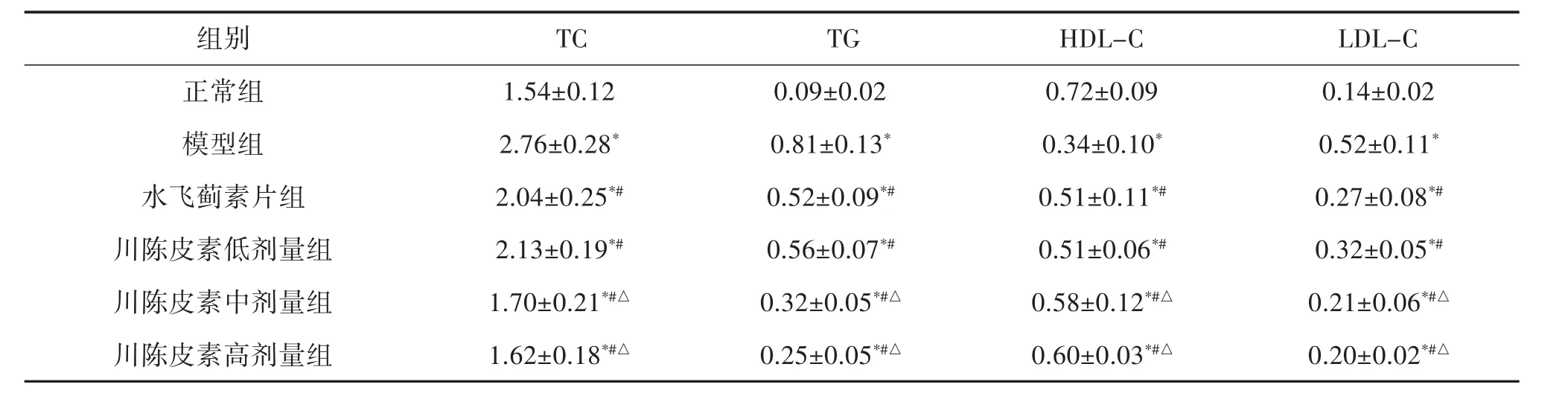
表4 治疗前后各组大鼠血脂指标的变化(±s,n=12,mmol/L)
注:与正常组相比,*P<0.05;与模型组相比,#P<0.05;与水飞蓟素片组相比,△P<0.05
LDL-C.14±0.02 52±0.11*27±0.08*#32±0.05*#1±0.06*#△0±0.02*#△
2.6 大鼠炎性因子 与正常组相比,模型组大鼠血清炎性因子指标IL-1a、IL-1b和IL-6明显增高(P<0.05);与模型组相比,水飞蓟素片治疗组以及川陈皮素低、中、高剂量组IL-1a、IL-1b和IL-6均明显降低(P<0.05)。此外,川陈皮素高剂量组上述3个指标均明显低于水飞蓟素片治疗组(P<0.05),详见表5。
表5 治疗前后大鼠炎性因子IL-1和Il-6的变化(±s,n=12)
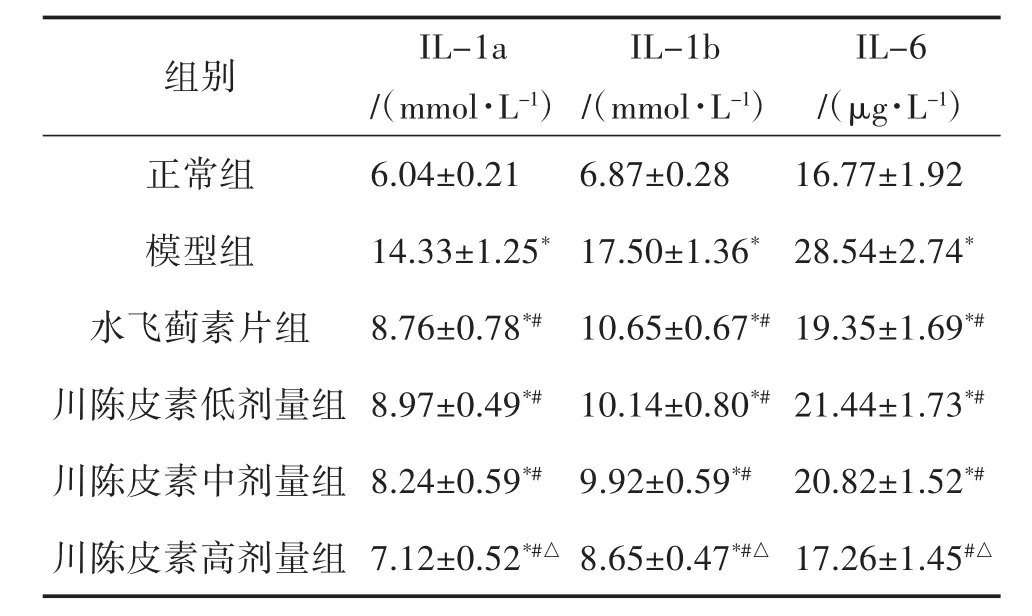
表5 治疗前后大鼠炎性因子IL-1和Il-6的变化(±s,n=12)
注;与正常组相比,*P<0.05;与模型组相比,#P<0.05;与水飞蓟素片组相比,△P<0.05
IL-6/(μg·L-1)正常组 6.04±0.21 6.87±0.28 16.77±1.92组别 IL-1a/(mmol·L-1)IL-1b/(mmol·L-1)模型组 14.33±1.25*17.50±1.36* 28.54±2.74*水飞蓟素片组 8.76±0.78*# 10.65±0.67*#19.35±1.69*#川陈皮素低剂量组 8.97±0.49*# 10.14±0.80*#21.44±1.73*#川陈皮素中剂量组 8.24±0.59*# 9.92±0.59*# 20.82±1.52*#川陈皮素高剂量组 7.12±0.52*#△ 8.65±0.47*#△ 17.26±1.45#△
2.7 大鼠凋亡相关蛋白的表达特点 大鼠凋亡相关蛋 白 TNF-α、TNFR-1、FasL、Fas、Caspase-8、Caspase-3、Bax和Bcl-2表达特点如图2和图3所示。从图中可以明显看出,与正常组相比,模型组TNF-α、TNFR-1、FasL、Fas、Caspase-8 和 Caspase-3 明显升高(P<0.05),Bcl-2表达明显降低(P<0.05);与模型组相比,水飞蓟素片治疗组、川陈皮素低、中、高剂量组TNF-α、TNFR-1、FasL、Fas、Caspase-8 和 Caspase-3明显降低(P<0.05),Bcl-2表达明显升高(P<0.05);与正常组相比,模型组Bax表达明显升高(P<0.05),与模型组相比,水飞蓟素片治疗组没有变化,但川陈皮素三个治疗组降低(P<0.05);此外,川陈皮素低、中、高剂量组 TNF-α、TNFR-1、FasL 和 Caspase-8 明显低于水飞蓟素片治疗组(P<0.05),川陈皮素中、高剂量组Fas和Bax明显低于水飞蓟素片治疗组(P<0.05),川陈皮素高剂量组Caspase-3明显低于水飞蓟素片治疗组(P<0.05)、Bcl-2明显高于水飞蓟素片治疗组。
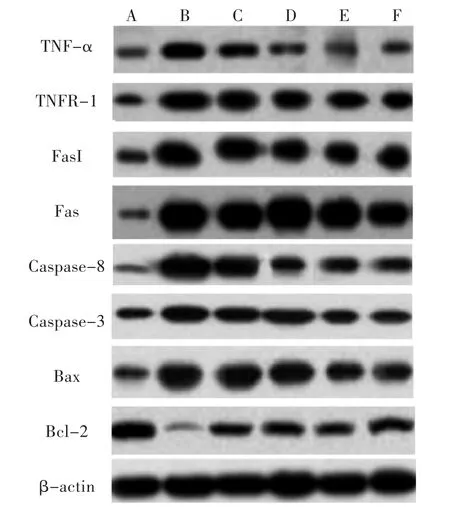
图2 大鼠凋亡相关蛋白的表达图
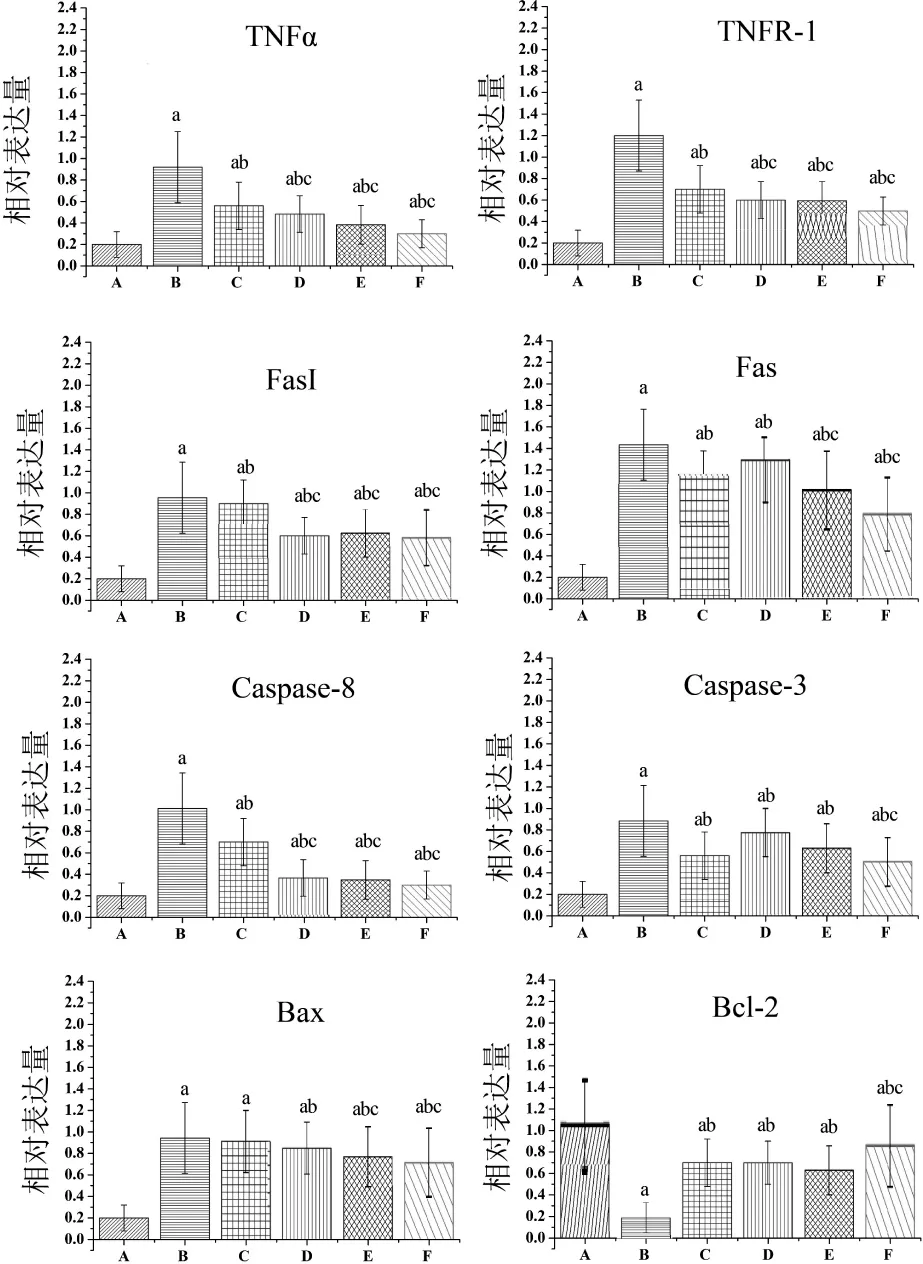
图3 大鼠凋亡相关蛋白相对表达量
2.8 大鼠凋亡相关蛋白mRNA的表达特点 大鼠凋 亡 相 关 蛋 白 TNF-α、TNFR-1、FasL、Fas、Caspase-8、Caspase-3、Bax、Bcl-2 mRNA 表达特点如图4所示。从图中可以明显看出,与正常组相比,模型组TNF-α、TNFR-1、FasL、Fas、Caspase-8、Caspase-3 和Bax明显升高(P<0.05),Bcl-2表达明显降低(P<0.05);与模型组相比,水飞蓟素片治疗组、川陈皮素低、中、高剂量组 TNF-α、TNFR-1、FasL、Fas、Caspase-8、Caspase-3和 Bax明显降低(P<0.05),Bcl-2表达明显升高(P<0.05)。此外,川陈皮素低、中、高剂量组TNF-α、Caspase-8和Bax明显低于水飞蓟素片治疗组(P<0.05),川陈皮素中和高剂量组TNFR-1、FasL、Fas明显低于水飞蓟素片治疗组(P<0.05),川陈皮素低、中、高剂量组Bcl-2明显高于水飞蓟素片治疗组(P<0.05)。
3 讨论
NAFLD发病机制较为复杂,其涉及到脂代谢、二次打击、氧化损伤等多种复杂的代谢过程[10],因此构建一个好的NAFLD动物模型,使其更贴切于人类NAFLD发病机制是实验成功的保障。目前医学界用来构建NAFLD的动物模型主要有2种方式,第1种为基因改良模型[11-12],此模型目前应用较多的为CD36基因敲除模型和乙酰辅酶A氧化酶基因缺乏模型,二者根据药物的作用机理不同,而各有侧重。CD36基因敲除鼠模型可以表现有明显的脂肪肝特征,也会造成总胆固醇的升高和胰岛素抵抗的发生,但其侧重点为氧化应激和肝细胞凋亡方面。乙酰辅酶A氧化酶基因缺乏小鼠则主要表现为脂代谢异常引发的NAFLD,其适用于肝脏降脂药物的基础实验研究。但不管是CD36基因敲除模型还是乙酰辅酶A氧化酶基因缺乏模型,二者造价均较为昂贵,因此不被广泛推广。第2种模型即为高脂高糖诱导模型[13],本类方法简单易行,同时造价相对低廉,构建的模型较为稳定,因此推广性较高。本次研究即采用高脂诱导脂肪肝模型,从HE染色可以明显看出,模型组大鼠镜下可见肝细胞脂肪变性、胞浆疏松化、气球样变、炎细胞浸润等NAFLD的病理特征,这证明所构建的模型是成功的,可以用于后续的研究开展。
NAFLD发生后,大鼠最典型的特点为肝脏病理学的损伤,同时出现明显的肝功能和血脂异常[14]。陈皮素被发现有多种生物活性,其在抗癌、消炎、抗氧化以及调节血管平滑肌等多个方面均表现有较好的药理活性。目前也有研究采用川陈皮素治疗NAFLD,但是上述的研究仅限于细胞学的研究,动物学的研究还缺少文献证实,相关的作用机理也没有明确[15-16]。本次研究采用川陈皮素治疗NAFLD大鼠,研究结果发现,与模型组相比,川陈皮素低、中、高剂量组均可以明显的降低NAFLD大鼠肝功能指标AST和ALT,同时也可以明显的调节血脂,降低肝脏指数。肝脏病理学结果也显示,在治疗后,川陈皮素3个剂量组脂肪空泡数量均明显降低,炎细胞浸润有明显改善,这种治疗效果与临床中常用的保肝护肝药物水飞蓟素片相一致,这提示川陈皮素可治疗NAFLD,那么其作用机理是什么?
细胞凋亡是机体维持自身稳定的一种基本的生理活动现象,但是细胞凋亡过低和过高均可以导致疾病的发生[17]。目前关于细胞凋亡在非酒精性脂肪性肝病中的作用和发生机制以及相关的药物治疗已有大量的文献报道。而鉴于川陈皮素在抗凋亡和抗炎方面的作用,因此推测川陈皮素实现保肝护肝作用可能是通过调节细胞凋亡实现的。目前介导NAFLD肝细胞凋亡常见的信号通路主要3条[18-21],分别为死亡受体通路、线粒体通路和内质网通路。死亡受体通路包括TNF家族的Fasl/Fas和TNF-α/TNFR-1等介导的调亡信号通路,本类通路可以直接调控炎症的发生。线粒体通路主要是指Bcl-2蛋白家族相关的基因,其中典型的蛋白为Bax和Bcl-2,二者可形成同源二聚体,以起到对细胞凋亡的抑制或促进作用。第3条通路为内质网通路,内质网通路与凋亡相关的代表性蛋白主要为Caspase家族蛋白,其可以参与胆固醇的合成和脂质的代谢。本次研究观察川陈皮素治疗前后肝脏组织中上述3条通路的代表性蛋白TNF-α、TNFR-1、FasL、Fas、Caspase-8、Caspase-3、Bax、Bcl-2 的表达特点,研究结果发现,与模型组相比,川陈皮素低、中、高剂量组 TNF-α、TNFR-1、FasL、Fas 、Caspase-8、Caspase-3和Bax明显降低,而Bcl-2表达明显升高。这提示,川陈皮素具有明显的调节NAFLD大鼠凋亡发生的作用。
综上所述,本次研究证实川陈皮素对高脂饮食诱导的NAFLD大鼠肝功能、血脂以及肝脏病理学有着明显的改善作用,其治疗NAFLD的作用可能是通过抑制细胞凋亡,降低炎症反应实现的。
