去氢骆驼蓬碱通过PTEN/Akt/MDM2信号通路抑制胃癌细胞COX-2表达
2019-05-05陶婷婷蒋世烨孙梦雪张文灵刘高双李晓林孙为豪
陶婷婷,蒋世烨,孙梦雪,张文灵,余 纳,刘高双,李晓林,邵 耘,孙为豪
(南京医科大学第一附属医院老年消化科,江苏 南京 210029)
在全球癌症死亡率中胃癌排名第2,且绝大多数病例被确诊时已为晚期阶段,低于20%的患者经过各种综合治疗后可生存5年以上。目前,治疗恶性肿瘤的主要手段是根治性手术及术后辅助化疗。然而,在应用传统化疗药物抑制或杀伤肿瘤细胞期间,大部分患者会出现严重的毒副反应,如感染、纳差、器官毒性作用等。因此,寻找疗效强且毒副反应轻的新型化疗药对肿瘤治疗意义重大。去氢骆驼蓬碱(harmine,HM)来源于蒺藜科植物骆驼蓬的种子,是其主要活性成分,具有杀菌抗炎、抑制肿瘤细胞生长增殖、抗白血病等药理作用[1]。已有学者研究发现,HM抑制胃癌细胞增殖、迁移及侵袭的作用机制主要与下调环氧合酶2(cyclooxygenase 2, COX-2)的蛋白表达水平相关[2],然而,HM抑制COX-2表达的信号转导通路目前尚不明确。
PTEN是一种抑癌基因,可通过下调磷脂酰肌醇3-激酶(phosphoinositide-3 kinase,PI3K)/Akt信号通路,来抑制肿瘤细胞的生长,并使细胞周期停滞[3-4]。Akt可通过其活化形式磷酸化Akt(p-Akt)激活通路下游的信号分子,是细胞信号转导系统及细胞周期调控系统的一种重要激酶。小鼠双微体基因2(murine double minute 2,MDM2)是高度扩增的细胞癌基因,p53基因是肿瘤抑制基因,两者构成的体系与细胞恶性转化而发生癌变密切相关,尤其是消化系统肿瘤[5-7]。本研究以COX-2呈现高表达的SGC-7901和MKN-45胃癌细胞株为实验对象,通过转染siRNA分别敲减PTEN、Akt、MDM2基因后,观察HM对胃癌细胞COX-2表达的影响,进一步明确PTEN/Akt/MDM2通路在HM抑制胃癌细胞COX-2表达中的作用。
1 材料与方法
1.1 细胞株人胃腺癌细胞株SGC-7901(中分化),购自中国科学院上海生科院细胞资源中心;人胃腺癌细胞株MKN-45(低分化),购自南京凯基生物公司。
1.2 试剂HM(Sigma公司);抗Akt、p-Akt、MDM2、p-MDM2、COX-2、PTEN抗体(Abcam公司);PTEN-siRNA、Akt-siRNA、MDM2-siRNA以及阴性对照NC-siRNA(上海吉玛公司);LipofectamineTM2000转染试剂(Invitrogen公司);ECL发光试剂盒、BCA试剂盒(Pierce公司)。
1.3 仪器细胞培养箱 (Thermo公司);蛋白免疫印迹系统(Bio-Rad公司);荧光/化学发光成像系统(Tanon公司)。
1.4 细胞培养用RPMI 1640培养基(含10%胎牛血清、100 kU·L-1青霉素和100 mg·L-1链霉素)培养细胞,置于培养箱中(37 ℃、5% CO2),2 d换液1次,3 d传代1次。
1.5 细胞转染将细胞分为空白对照组(无转染)、阴性对照组(转染NC-siRNA)、转染组(转染PTEN-siRNA或Akt-siRNA或MDM2-siRNA)。将生长状态活跃的细胞接种于6孔板,并用培养基(不含双抗)培养至细胞密度达30%~50%后,进行瞬时转染。先混匀RPMI 1640(250 μL)和siRNA(100 nmol·L-1),再取LipofectamineTM2000(5 μL)加入RPMI 1640(250 μL)中,放置5 min,将两者混匀静置20 min后,加入6孔板,每孔加入培养基(无双抗)1.5 mL,转染后6 h换液,继续培养24 h后,用于进一步实验。
1.6 蛋白提取和蛋白质印迹在转染24 h后的6孔板中加入或不加20 μmol·L-1HM处理,24 h后收集各组细胞,PBS洗涤3次后,加入细胞裂解液提取总蛋白,并测定蛋白含量。上样、电泳、转膜后,4 ℃封闭2 h,经过3次洗膜后,加入一抗4 ℃孵育过夜,洗膜3次后,二抗4 ℃孵育2 h,洗膜3次后,加入发光液,对目的蛋白进行半定量分析。

2 结果
2.1 敲减PTEN基因对胃癌细胞PTEN、p-Akt、p-MDM2及COX-2表达的影响Fig 1的Western blot结果显示,在PTEN-siRNA转染组中PTEN蛋白表达量与空白对照组及阴性对照组相比明显降低,而p-Akt、p-MDM2和COX-2蛋白表达量则明显增加。
2.2 敲减Akt基因对胃癌细胞p-Akt、p-MDM2及COX-2表达的影响Fig 2的Western blot结果显示,在Akt-siRNA转染组中,p-Akt、p-MDM2和COX-2蛋白表达量均明显低于空白对照组及阴性对照组。
2.3 敲减MDM2基因对胃癌细胞p-MDM2和COX-2表达的影响Fig 3的Western blot结果显示,在MDM2-siRNA转染组中,p-MDM2和COX-2蛋白的表达量均明显低于空白对照组及阴性对照组。
2.4 PTEN在HM抑制胃癌细胞p-Akt、p-MDM2和COX-2表达中的作用Fig 4的Western blot结果显示,在HM组中PTEN蛋白表达量明显高于阴性对照组,p-Akt、p-MDM2、COX-2蛋白表达量则明显降低。加入HM并敲减PTEN基因组p-Akt、p-MDM2、COX-2蛋白的表达量明显高于单纯加入HM组;敲减PTEN基因可逆转HM抑制胃癌细胞Akt和MDM2磷酸化及COX-2蛋白表达的作用。
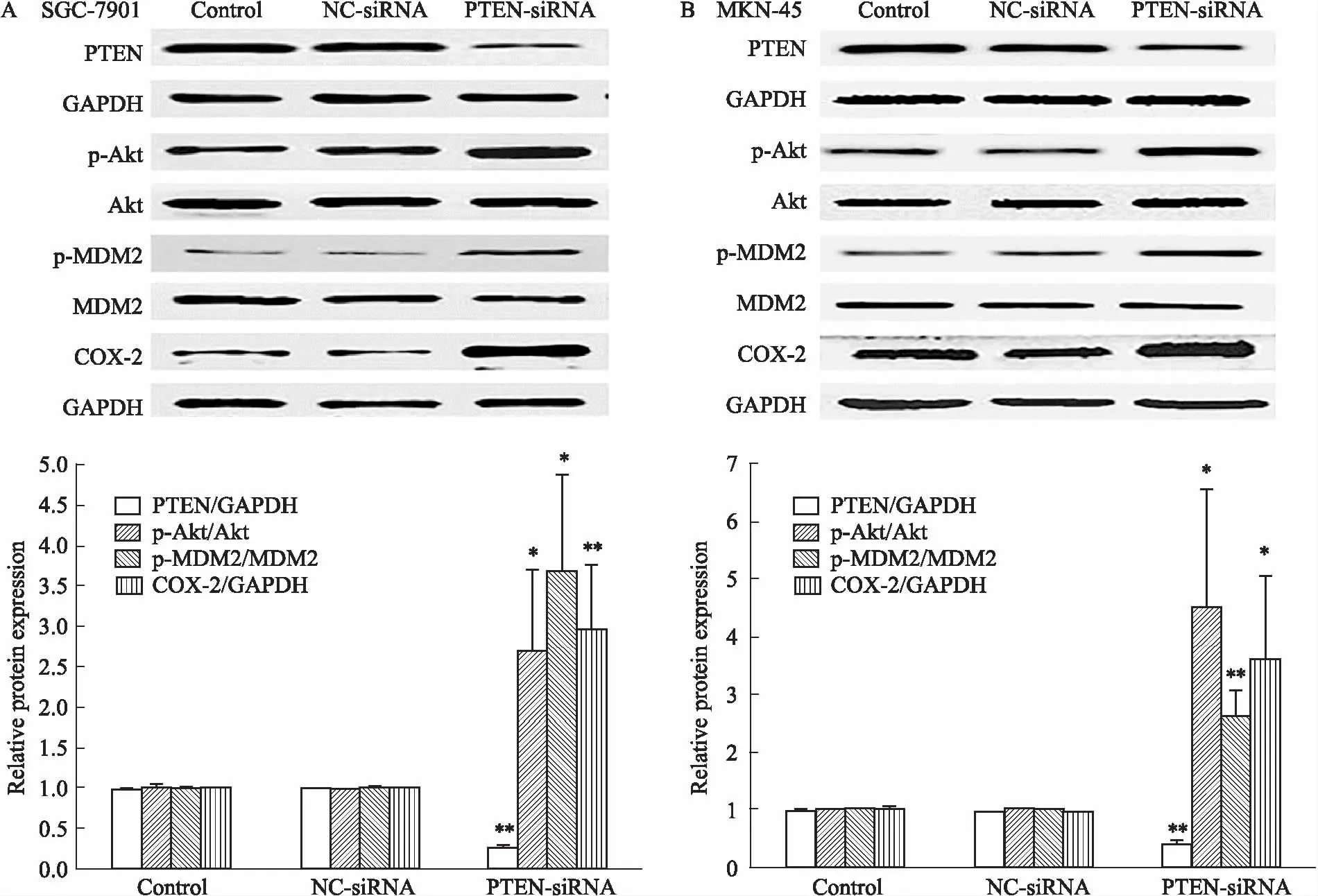
Fig 1 Effects of PTEN-siRNA on PTEN,Akt and MDM2 phosphorylation,and COX-2 expression in SGC-7901(A) and MKN-45(B) *P<0.05,**P<0.01 vs control
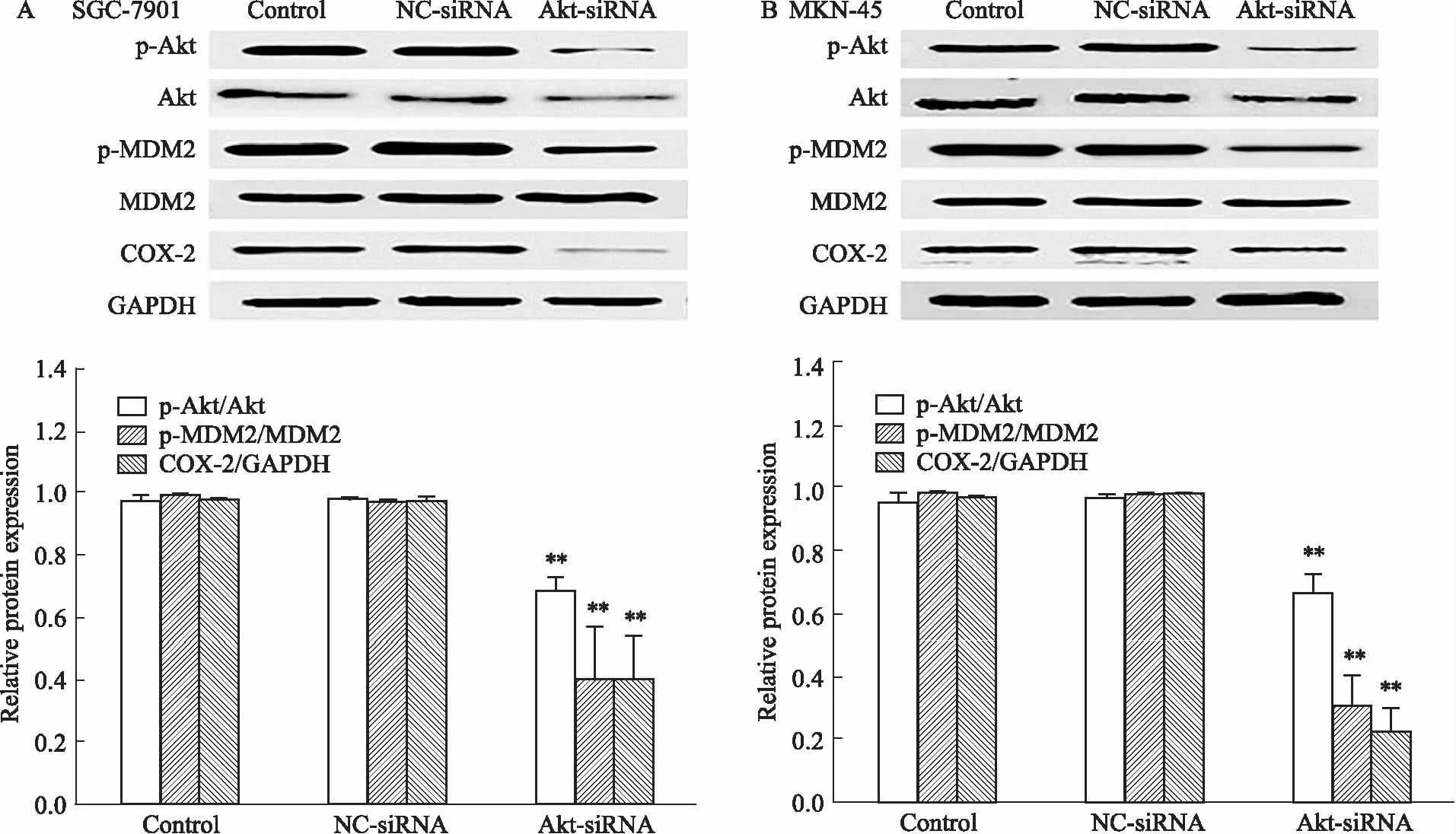
Fig 2 Effects of Akt-siRNA on Akt and MDM2 phosphorylation and COX-2 expression in SGC-7901(A) and MKN-45(B) **P<0.01 vs control

Fig 3 Effects of MDM2-siRNA on p-MDM2 and COX-2 expression in SGC-7901(A) and MKN-45(B)
*P<0.05,**P<0.01vscontrol
2.5 Akt在HM抑制胃癌细胞p-MDM2和COX-2表达中的作用Fig 5的Western blot结果显示,在HM组中p-Akt、p-MDM2、COX-2蛋白表达量均明显低于阴性对照组;加入HM并敲减Akt基因组p-Akt、p-MDM2、COX-2蛋白表达明显低于单纯加入HM组;敲减Akt基因可协同HM抑制MDM2磷酸化和COX-2蛋白表达。
2.6 MDM2在HM抑制胃癌细胞COX-2表达中的作用Fig 6的Western blot结果显示,HM组p-MDM2、COX-2蛋白表达量明显低于阴性对照组;加入HM并敲减MDM2组p-MDM2、COX-2蛋白表达量明显低于单纯加入HM组;敲减MDM2基因可协同HM抑制COX-2蛋白表达。
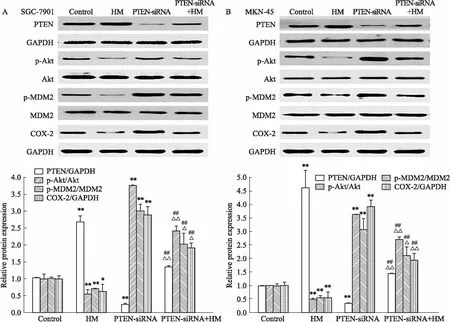
Fig 4 Effects of PTEN-siRNA on HM-mediated PTEN,Akt and MDM2 phosphorylation,
*P<0.05,**P<0.01vscontrol;##P<0.01vsHM treatment group;△P<0.05,△△P<0.01vsPTEN-siRNA without HM treatment group
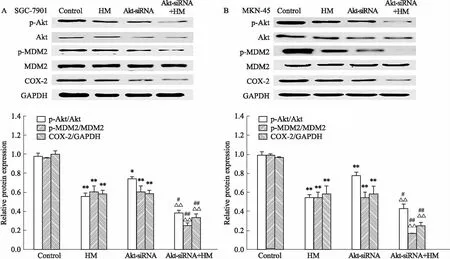
Fig 5 Effects of Akt-siRNA on HM-inhibited Akt and MDM2 phosphorylation,and COX-2 expression
*P<0.05,**P<0.01vscontrol;#P<0.05,##P<0.01vsHM treatment group;△△P<0.01vsAkt-siRNA without HM treatment group

Fig 6 Effects of MDM2-siRNA on HM-induced p-MDM2 and COX-2 expression in SGC-7901(A) and MKN-45(B) )
**P<0.01vscontrol;#P<0.05,##P<0.01vsHM treatment group;△△P<0.01vsMDM2-siRNA without HM treatment group
3 讨论
COX-2是机体受到外伤或感染等刺激后,由免疫细胞迅速产生的诱导酶,可促进花生四烯酸转变为重要的生物激素——前列腺素,从而促进炎性反应,使组织受损。前期研究表明,COX-2的异常表达将导致胃癌的发生发展[8-9],特异性COX-2抑制剂可有效抑制胃癌细胞增殖迁移,抑制肿瘤形成[10]。HM在体外可通过下调胃癌细胞COX-2蛋白水平,来降低细胞侵袭力,阻碍肿瘤形成[2]。然而,进一步明确HM抑制COX-2表达的作用机制,是目前亟待解决的问题。
PTEN作为一种具有双重活性的抑癌基因,对细胞生长周期的调控具有关键性作用,并可通过阻断持续活化的PI3K/Akt通路来促进肿瘤细胞凋亡[3-4]。本研究结果显示,HM可促进SGC-7901及MKN-45胃癌细胞株PTEN表达增加,下调p-Akt、p-MDM2和COX-2的表达。MDM2是一种在一系列人类癌症中过表达的肿瘤蛋白,既往研究结果表明[11],p-Akt可激活MDM2,使其进入细胞核并泛素化p53,p53的失活使得受损DNA的异常细胞继续分裂复制,最终导致组织恶变。PTEN则可下调Akt依赖的MDM2磷酸化,促进p53表达,MDM2与p53构成降解-反式激活循环通路,以维持正常细胞功能,消除突变细胞[12]。若MDM2或p53有任何一方基因突变、异常表达等,都可能导致该调节机制的平衡稳定状态被破坏,最终将可能直接导致细胞恶变,肿瘤形成[13]。因此,MDM2是促进恶性肿瘤形成的一个重要因素。本研究结果显示,PTEN基因敲减可逆转HM抑制p-Akt、p-MDM2和COX-2蛋白表达的作用,提示HM可能通过上调PTEN表达来抑制p-Akt、p-MDM2和COX-2过表达诱导的胃癌细胞增殖。Akt基因敲减具有协同HM下调p-MDM2和COX-2蛋白表达的作用,提示HM可能通过下调p-Akt表达,来抑制p-MDM2和COX-2过表达诱导的胃癌细胞增殖。MDM2基因敲减可协同HM下调COX-2蛋白表达水平,提示HM可能通过下调p-MDM2表达,来抑制COX-2过表达诱导的胃癌细胞增殖。Kuo等[14]提出,小檗碱可调控PI3K/Akt通路来抑制癌细胞生长代谢,促其凋亡。Dung等[15]研究发现,地奥司明通过p53活化和PI3K-Akt-MDM2信号转导途径及诱导G2/M期细胞周期停滞,来降低HA22T肝癌细胞活力、抑制细胞增殖。由此可推测得出,PTEN/Akt/MDM2可能是HM诱导COX-2表达下调的信号通路,并由此阻碍胃癌细胞增殖。但HM也可能通过其他通路,甚至其他层面来抑制胃癌细胞生长增殖,且目前仅进行了细胞层面的体外实验研究,要系统全面地了解其确切机制仍需进一步研究。
(致谢:本实验在南京医科大学第一附属医院老年医学实验室完成,在此对以上实验室和实验过程中给予指导和帮助的老师表示感谢!)
