裂果薯总皂苷抗大鼠肝纤维化作用及其机制
2019-05-05廖智红陈燕燕黄修影甘日植罗舜仁吕美娴刘布鸣
廖智红,陈燕燕,黄修影,甘日植,罗舜仁,吕美娴,刘布鸣,梁 钢
(1. 广西医科大学药学院,广西 南宁 530021;2. 钦州市第二人民医院药剂科,广西 钦州 535000;3. 广西中医药大学附属瑞康医院药剂科,广西 南宁 530011;4. 广西中药质量标准研究重点实验室,广西 南宁 530022)
肝纤维化是慢性肝病在修复过程导致的病理状态,若未得到合理的治疗,其终末阶段将发展为肝硬化、肝癌直至死亡。肝纤维化病理过程的主要特点之一是细胞外基质(extracellular matrix,ECM)蛋白过量产生。抑制TGF-β途径可以减少ECM沉积,改善肝纤维化[1],有研究报道,TGF-β通过自分泌和旁分泌机制,促进肝纤维化的发展[2]。TGF-β1/Smad信号通路与肝纤维化关系密切,抑制TGF-β1/Smad信号通路能明显改善肝纤维化程度[3]。目前,对肝纤维化的潜在机制研究较为广泛,但是临床仍缺乏能够有效防治肝纤维化的化学药物,除肝脏移植以外的治疗措施,均远未达到理想的治疗效果。
近年来,中药在抗肝纤维化方面的研究成为医学界关注的焦点之一,国际上多项中医药及中药复方或中草药提取物研究显示,中医药在抗纤维化的治疗中起重要作用[4-5]。因此,寻找开发低毒、高效的抗肝纤维化药物成为广大科研人员的重要任务。裂果薯(SchizocapsaplantagineaHance)为蒟蒻薯科植物,作为一种广西特色中草药,也属壮、瑶药,在广西产量丰富,已有一定种植规模,具有清热解毒、消肿止痛、收敛止血等功效。至今,对裂果薯公开报道的研究集中在其化学成分的分离、鉴定方面,其药效学研究很少。本课题组从裂果薯分离得到的皂苷类化合物大都是结构比较新颖的甾体皂苷,我们的前期研究表明,其皂苷成分对人肝癌细胞和鼻咽癌细胞增殖具有明显的抑制作用[6-7];体内实验研究表明,其对人肝癌裸鼠移植瘤也有抑制作用[8]。目前还未见其抗肝纤维化作用的报道,故本研究通过应用裂果薯总皂苷(total saponins ofSchizocapsaplantagineaHance,SFSP)对四氯化碳(CCl4)诱导的大鼠肝纤维化进行干预和治疗,探讨SFSP抗肝纤维化作用,并试图阐明其潜在机制。
1 材料
1.1 药物与试剂裂果薯块茎,购自广西壮族自治区资源县瓜里乡,由广西壮族自治区中医药研究院黄云峰教授鉴定为SchizocapsaplantagineaHance;SFSP由本实验室自行提取与鉴定;秋水仙碱,购自昆明制药有限公司,实验时用蒸馏水配制成混悬液。羟脯氨酸(hydroxyproline,Hyp)试剂盒,购自南京建成生物工程研究所;Ⅳ型胶原(collagen Ⅳ,CⅣ)、Ⅲ型前胶原(procollagenⅢ,PCⅢ)、透明质酸(hyaluronic acid,HA)、层黏蛋白(laminin,LN)ELISA试剂盒,均购自上海源叶生物科技有限公司;总RNA提取试剂盒、逆转录试剂盒、SYBR Premix Ex TaqTMⅡ,购自TaKaRa公司;TGF-β1、Smad4、Samd7、α-平滑肌肌动蛋白(alpha-smooth muscle actin, α-SMA)、GAPDH引物,由英潍捷基(上海)贸易有限公司合成。
1.2 实验动物♂SD大鼠 53只,体质量(180±10)g,购自广西医科大学实验动物中心,动物生产许可证号:SCXK(桂)2014-0002。
1.3 仪器StepOnePlus实时荧光定量PCR仪(美国Thermo Fisher Scientific公司);全自动生化分析仪、H-7650透射式电子显微镜(日本日立公司); SpectraMaxPlus384连续广谱扫描式酶标仪(香港分子仪器公司);BX53正置荧光显微镜(日本Olympus公司);RM2235组织切片机(德国LEICA公司);PTPS-2011彩色病理图文分析系统(重庆天海医疗设备有限公司)。
2 方法
2.1 肝纤维化动物模型的制备与干预将53只♂SD大鼠随机分为正常对照组(11只)、造模组(42只)。适应性喂养1周后,正常对照组灌胃同体积的生理盐水,造模组灌胃50% CCl4橄榄油溶液2 mL·kg-1,每周2次(先后间隔2~3 d),连续10周。于造模后第6周,随机抽取2只肝纤维化大鼠及1只正常对照组大鼠,进行病理学检查,监测肝纤维化形成情况。病理结果证实造模成功后,将其余肝纤维化大鼠随机分为模型组、秋水仙碱组(Col)、SFSP低剂量组(SFSP-L)、SFSP高剂量组(SFSP-H),每组10只。自造模6周后, SFSP干预组和Col组每日灌胃给药, Col组大鼠灌胃秋水仙碱混悬液0.4 mg·kg-1;SFSP-H组大鼠灌胃SFSP 25 mg·kg-1(用0.5%的羧甲基纤维素钠配制成混悬液,现配现用);SFSP-L组灌胃SFSP 12.5 mg·kg-1;正常对照组和模型组则灌胃等容积溶媒,给药体积为10 mL·kg-1,每日1次,连续4周。末次给药后禁食 8 h,处死大鼠,腹主动脉取血,大鼠血液静置2 h后,3 000 r·min-1离心15 min,取上清,-80 ℃冻存,备用。剥离肝脏称重,计算肝脏重量与体质量之比,得到肝脏指数。
2.2 肝组织病理学检查迅速分离肝脏组织,取肝脏相同位置,用4%多聚甲醛充分固定24 h后,以乙醇呈浓度梯度常规脱水,石蜡包埋、切片,病理切片厚度4 μm, HE、 Masson染色后,光学显微镜下观察肝组织病理形态变化,并拍照。
2.3 电镜观察肝细胞超微结构取大小为1 mm3肝组织标本,用3%戊二醛固定,1%锇酸后固定,丙酮梯度脱水,渗透处理后环氧树脂包埋,再经聚合、修块后,制成超薄切片,染色,透射电镜观察,加速电压为80 kV。
2.4 血清及肝组织生化指标检测采用全自动生化分析仪,检测大鼠血清谷草转氨酶(aspartate aminotransferase,AST)、谷丙转氨酶(alanine aminotransferase,ALT)。ELISA法检测大鼠血清HA、LN及ECM成分CⅣ、PCⅢ水平,按照ELISA试剂盒说明书操作,酶标仪上450 nm、630 nm处测定OD值,根据制备的标准曲线,采用双波长比色法,计算各组大鼠血清中各指标含量。从-80 ℃冰箱中称取50 mg肝组织,Hyp含量测定采用样本碱水解法,严格按照试剂盒说明书检测。
2.5 qPCR法检测肝组织中α-SMA、TGF-β1、Smad4、Samd7 mRNA表达从-80 ℃冰箱中取大鼠肝组织约40 mg,置预冷的研钵中研磨成肝粉,加入裂解液充分研磨,用柱式法提取总RNA。测定RNA浓度后,采用10 μL逆转录反应体系加入各组分,在PCR仪中进行逆转录反应,条件为:37 ℃反转录反应15 min,85 ℃酶失活反应5 s,cDNA置于-80 ℃冰箱保存。按照SYBR Green法配制反应体系,按20 μL体系将各反应物按反应需要配制总管,混匀,确保所有反应体系的组成一致,再取18.00 μL加至各个PCR反应管中,每管加入cDNA 2.0 μL,组成每管共20 μL体系。每组至少3个复孔,冰上操作,引物序列见Tab 1。反应条件按两步法PCR扩增程序:95 ℃预变性,30 s;95 ℃变性5 s;65 ℃ 退火,30 s。共40个循环。反应结束后,通过StepOne Software V2.2软件读取Ct值,以GAPDH为内参,采用2-△△Ct法计算目的基因mRNA相对表达量。

Tab 1 Primer sequences

3 结果
3.1 各组大鼠的一般情况正常对照组大鼠精神状态良好、自主摄食、活动灵敏、皮毛发亮;肝纤维化模型组大鼠精神状态一般,喜蜷卧,毛发光泽度降低,动作迟缓,活动度低。SFSP-L组、SFSP-H组和Col组大鼠一般情况较模型组明显改善。与正常组相比,模型组大鼠的肝脏指数明显升高;与模型组比较,SFSP组大鼠肝脏指数明显降低(P<0.01),Col组大鼠的肝指数也有降低的趋势(Tab 2)。

Tab 2 Effect of SFSP on liver index in rats with
##P<0.01vscontrol group;**P<0.01vsmodel group
3.2 SFSP对肝纤维化大鼠肝组织病理形态学的影响HE染色和Masson染色结果如Fig 1所示,正常对照组大鼠肝脏表现出正常的肝小叶结构,肝细胞索以中央静脉为中心向四周呈放射状整齐排列,肝细胞未见变性或坏死。模型组肝索排列紊乱,在中央静脉至汇管区出现大量胶原纤维沉积,形成纤维桥连接,把肝小叶分割成大小不等的圆形或椭圆的假小叶,周围纤维组织增生,小叶间纤维间隔也明显增宽。SFSP各组大鼠可见炎细胞浸润程度明显减轻,亦可见蓝色胶原纤维出现在汇管区,但是其纤维细且薄,肝小叶结构虽有破坏,但肝小叶间纤维间隔形成减少、变细,纤维结缔组织增生分布较模型组少,偶见汇管区形成纤维桥连接分割肝小叶,可观察到肝组织病理损伤比模型组明显减轻。其中,SFSP高剂量组的肝组织病变减轻,大部分肝小叶结构清晰,肝小叶间纤维间隔形成较少,胶原纤维增生比模型组有明显好转。阳性对照组与模型组比较,胶原纤维间隔变窄,着色比模型组浅,仍可见少量假小叶结构。
3.3 SFSP对肝纤维化大鼠肝细胞超微结构的影响透射电镜结果显示(Fig 2),正常对照组大鼠肝细胞核圆或椭圆,核膜清晰,内质网分布规律,线粒体呈圆形,未见明显脂滴存在;模型对照组细胞核固缩,内质网扩张,无规律分布,线粒体肿胀,糖原减少,胶原纤维束明显增生;SFSP作用后,肝细胞器病变改善,形态良好,纤维束细小,可见少量肝星状细胞凋亡小体,其中SFSP-H组改善程度较SFSP-L组明显;阳性对照组可见肝细胞形态等均较模型组有改善,但是与SFSP-H组相比,阳性组线粒体形态与内质网排列等均有所不及。
3.4 SFSP对肝纤维化大鼠肝功能及肝组织Hyp含量的影响如Tab 3所示,与对照组相比,CCl4诱导的肝纤维化大鼠血清AST和ALT活性明显增加(P<0.01);与模型组比较,Col明显降低血清AST和ALT活性(P<0.05),SFSP-H组能明显降低ALT水平(P<0.01)。与对照组比较,模型组肝组织Hyp水平明显上升(P<0.01);与模型组比较,SFSP-L组、SFSP-H组及Col组明显降低Hyp水平(P<0.01)。
3.5 SFSP对肝纤维化大鼠血清HA、LN、CⅣ、PCⅢ含量的影响血清中HA、LN、CⅣ、PCⅢ含量是衡量肝纤维化发生的重要指标。Tab 4结果显示,与对照组比较,模型组血清中HA、LN、CⅣ、PCⅢ含量均明显升高(P<0.05,P<0.01);与模型组比较,SFSP-L组与SFSP-H组均不同程度降低血清中HA、LN、CⅣ、PCⅢ含量(P<0.05,P<0.01),但是SFSP-H组纤维化改善程度较SFSP-L组明显,Col组明显降低肝纤维化大鼠血清中HA、LN、CⅣ、PCⅢ含量(P<0.05)。
3.6 SFSP对肝纤维化大鼠肝组织TGF-β1、Smad4、Smad7、α-SMA mRNA表达的影响如Tab 5所示,与正常对照组相比,模型组α-SMA、Smad4、TGF-β1 mRNA的表达明显升高,Smad7 mRNA表达明显降低;与模型组相比,给予SFSP后,肝纤维化大鼠肝组织中α-SMA、TGF-β1、Smad4 mRNA表达明显降低(P<0.01),Smad7 mRNA表达量明显增高(P<0.05)。

Tab 3 Effects of SFSP on AST, ALT in serum and Hyp in rat liver , n=10)
##P<0.01vscontrol group;*P<0.05,**P<0.01vsmodel group

Fig 1 Comparison of HE, Masson staining in each group
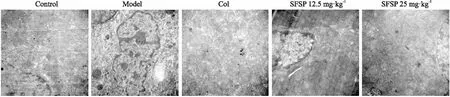
Fig 2 The protective effects of SFSP against CCl4-induced liver fibrosis in rats through TEM assay

Tab 4 Effects of SFSP on HA, LN, CⅣ, PCⅢ in serum of rats with hepatic fibrosis , n=10)
#P<0.05,##P<0.01vscontrol group;*P<0.05,**P<0.01vsmodel group
Tab 5 Effects of SFSP on expressions of TGF-β1, Smad4, Smad7, α-SMA mRNA in rats n=3)
#P<0.05,##P<0.01vscontrol group;*P<0.05,**P<0.01vsmodel group
4 讨论
肝纤维化是一种在世界范围内具有高发病率与高死亡率的疾病,如果肝纤维化得不到控制,则可进一步发展为死亡率极高的不可逆的终末期肝硬化、肝癌。SFSP是一种来源于广西壮瑶药裂果薯的天然活性成分,在本研究中,SFSP对CCl4诱导的肝纤维化表现出良好的抗肝纤维化作用。血清肝纤维化指标HA、CⅣ、LN、PCⅢ升高,根据肝纤维化诊断标准以及肝组织病理学检查结果,判定该造模方法成功复制了大鼠肝纤维化模型。结果显示,SFSP组肝组织病理形态学及纤维化较模型组明显改善。ECM积聚是肝纤维化中的常见现象,而Hyp是胶原蛋白的主要成分,也是ECM累积的典型标志物[9]。实验结果显示,SFSP低、高剂量均明显降低肝组织Hyp含量,血清学肝纤维化直接标志物HA、CⅣ、LN、PCⅢ 水平在SFSP干预后明显低于模型组,表明SFSP抑制ECM积聚,明显降低肝纤维化指标,改善模型大鼠纤维化程度,并进一步抑制肝纤维化进程。
ALT和AST是反映肝细胞损伤的常用指标。ALT主要分布于胞质中,AST主要分布于线粒体和胞质中。本研究结果显示,与对照组比较,模型组二者均明显升高,SFSP干预后的大鼠AST水平比肝纤维化模型组略有下降,没有明显干扰CCl4诱导的肝纤维化大鼠血清中的AST水平。但是高剂量组与模型组相比,ALT明显降低,且AST/ALT比值明显升高。上述结果一方面提示,SFSP抗肝纤维化作用不是通过对肝细胞的保护实现的,另一方面说明ALT降低的比例明显高于AST的比例,但是高剂量比低剂量SFSP组AST/ALT比值升高得更明显,证实SFSP不加重已有的线粒体损伤情况。
现代研究显示,皂苷类具有广泛的药理作用,但目前甾体皂苷类抗肝纤维化的作用研究报道较少,具体作用机制尚不清晰,该领域具有很大研究价值。近年文献报道,重楼皂苷(其含甾体皂苷化学成分,与SFSP所含甾体皂苷极为相似)分别以40、300 mg·kg-1灌胃时,具有抗大鼠肝纤维化作用[10-11]。肝星状细胞(HSC)的活化与增殖作为肝纤维化的中心环节已得到公认,本课题组前期研究发现,SFSP对HSC-T6的增殖具有极强的抑制作用。本研究结果显示,在相同给药途径情况下,与重楼皂苷比较,SFSP仅25 mg·kg-1剂量就能对肝纤维化大鼠血清及肝组织相关纤维化标志物的生成有明显下调作用,表现出良好的抗肝纤维化作用,有望成为新型抗肝纤维化药物。
TGF-β1/Smad信号通路是肝纤维化主要的信号转导途径[12],抑制TGF-β1是抗肝纤维化重要策略之一。TGF-β1以一种潜在的形式在ECM中释放,并且被激活,TGF-β1先与TGF-β受体Ⅱ结合,磷酸化TGF-β受体Ⅰ,共同形成异源四聚体进而活化,而后通过Smad2、Smad3、Smad4,激活下游的信号通路,进而激活HSC,导致肝纤维化的发生。目前认为Smad7是TGF-β1/Smad信号通路的最主要抑制性调控蛋白,上调Smad7是抑制TGF-β对HSC不良生物效应的有效措施之一。抑制Smad7的表观遗传,促进Smad2和Smad3的磷酸化,是HSC持续活化和肝纤维化的重要分子机制[13]。通过抑制TGF-β1的生成和激活,下调TβRⅠ/Ⅱ受体,以及靶向阻断Smad2/3蛋白的表达,上调TGF-β1/Smad信号转导通路的抑制因子Smad7的水平,是治疗肝纤维化的有效手段。α-SMA是HSC激活公认的标志物[14]。在本研究中,CCl4损伤明显增加α-SMA和TGF-β1 mRNA水平,相比之下,SFSP在纤维化肝脏中明显抑制HSC活化标志物α-SMA mRNA表达,通过下调TGF-β1、Smad4 mRNA的表达,来抑制TGF-β1/Smad信号通路的激活,减少HSC的活化,减轻CⅣ和PCⅢ沉积,发挥抗纤维化作用。在我们的研究中,SFSP抑制TGF-β1的表达,阻断Smad4表达,并上调Smad7基因的表达,发挥抗肝纤维化作用。这些结果表明,SFSP的抗肝纤维化作用可能是通过抑制TGF-β1/Smad途径介导的。
本研究首次开展了SFSP抗肝纤维化动物实验,综上所述,SFSP抑制TGF-β1/Smad信号通路,进而减少ECM合成,是其抗纤维化作用机制之一,是一种非常有潜在价值的新药。本研究为开发与应用SFSP作为治疗肝纤维化的潜在药物提供了依据,其相关详细机制值得进一步深入研究。
(致谢:本实验于广西医科大学药学院实验平台完成,感谢实验室老师和同学的指导与帮助!)
