结肠癌患者外周血γδT细胞Tim-3、PD-1`表达及其临床意义*
2019-05-05李晓咪陆慧敏石通国张光波陈卫昌
李晓咪 陆慧敏 李 歌 石通国 张光波 陈卫昌&
苏州大学附属第一医院消化内科1(215006)江苏省(科教强卫)胃肠道肿瘤免疫重点实验室2 江苏省(高校)临床免疫学重点实验室3
背景:肿瘤的发生与免疫系统功能密切相关,共刺激分子异常表达与执行固有免疫功能的γδT细胞功能异常有关。T细胞免疫球蛋白和黏蛋白分子-3(Tim-3)和程序性死亡分子-1(PD-1)是重要的负性共刺激分子,与相应配体结合后可影响T淋巴细胞免疫功能,从而介导肿瘤细胞免疫逃逸。目的:初步探讨结肠癌患者外周血γδT细胞表面Tim-3、PD-1表达及其临床意义。方法:选取2017年12月—2018年6月苏州大学附属第一医院44例住院结肠癌患者,采集术前外周血标本,40名健康志愿者作为对照组,以密度梯度离心法分离外周血单个核细胞(PBMC),流式细胞术检测γδT细胞表面Tim-3、PD-1表达,分析两者表达与结肠癌临床病理特征的相关性。结果:结肠癌患者外周血Tim-3+、PD-1+、Tim-3+PD-1+ γδT细胞比例均显著高于健康志愿者(P<0.05),并与肿瘤体积和TNM分析呈显著正相关(P<0.05),与患者性别、年龄、肿瘤部位、有无远处转移则无明显相关性(P>0.05)。结论:结肠癌患者外周血γδT细胞表面Tim-3、PD-1表达明显升高并与肿瘤临床病理分期相关,有可能成为评估结肠癌发生、发展的客观指标。
结直肠癌的发生、发展是一个多因素、多阶段、多种分子参与的过程,患者机体免疫状态在其中发挥重要作用[1]。众所周知,淋巴细胞是免疫系统的重要组分,T淋巴细胞根据T细胞受体(TCR)的组成差异,可分为αβT细胞和γδT细胞两类。γδT细胞是一类进化上保守的非主要组织相容性复合物(MHC)限制性固有T细胞,可快速识别外源性病原体和内源性应激诱导分子,并启动适应性免疫应答,是机体免疫防御系统第一道防线的重要组成部分。活化的γδT细胞在炎症和肿瘤免疫应答中发挥多种效应功能,如释放裂解酶以破坏细菌或损伤的细胞、分泌促炎细胞因子如干扰素-γ(IFN-γ)和肿瘤坏死因子-α(TNF-α),或发挥抗体依赖性细胞毒作用(ADCC)等[2]。
T细胞的活化需有两个信号:第一信号由TCR识别抗原呈递细胞(APC)表面的抗原肽-MHC复合物(p-MHC)启动;第二信号由T细胞与APC间共刺激分子的相互作用启动。共刺激分子大致可分为正性共刺激分子和负性共刺激分子两类,后者又称为免疫检查点(immune checkpoint),包括细胞毒性T淋巴细胞相关抗原-4(cytotoxic T-lymphocyte-associated antigen-4, CTLA-4)、淋巴细胞活化基因-3分子(lymphocyte activation gene-3, LAG-3)、T细胞免疫球蛋白和黏蛋白分子-3(T-cell immunoglobulin mucin-3, Tim-3)、程序性死亡分子-1(programmed death-1, PD-1)、B、T淋巴细胞衰减因子(B- and T-lymphocyte attenuator, BTLA)等。国内有学者发现Tim-3和PD-1在结直肠癌患者肿瘤组织和外周血CD4+T细胞表面高表达,可能通过引起CD4+T细胞功能耗竭,介导肿瘤细胞免疫逃逸,促进结直肠癌进展[3]。Tim-3和PD-1在结肠癌患者外周血γδT细胞表面的表达情况是否与既往研究结果存在差异,目前尚未见文献报道。本研究通过检测结肠癌患者和健康志愿者外周血γδT细胞表面的Tim-3、PD-1表达,初步探讨其表达变化在结肠癌发生、发展中的意义。
材料与方法
一、临床资料
2017年12月—2018年6月苏州大学附属第一医院普外科44例住院结肠癌患者纳入研究,所有入组患者均为初诊,入组前未接受过手术、放疗、化疗、生物治疗等抗肿瘤治疗,无全身性免疫系统疾病,术后病理证实为结肠癌;男性26例,女性18例,年龄37~93岁,平均(66.43±12.45)岁。另选取40名健康志愿者作为对照组,其中男性21例,女性19例,年龄30~75岁,平均(63.37±13.04)岁。病例组与对照组间性别、年龄构成差异无统计学意义(P>0.05)。研究方案经苏州大学附属第一医院医学伦理委员会审核批准实施(2018伦审批第046号),标本采集征得受检者知情同意并签署知情同意书。
二、主要试剂和仪器
人外周血淋巴细胞分离液(天津市灏洋生物制品科技有限责任公司);荧光抗体鼠抗人CD4-FITC、CD4-PE、CD3-PC5、CD3-PC7、γδT-FITC、IgG-PE、IgG-PC7、Tim-3-PE、PD-1-PC7(Biolegend公司)。CytomicsTMFC 500流式细胞仪(Beckman Coulter公司)。
三、方法
1. 标本采集:结肠癌患者术前使用EDTA抗凝管采集空腹外周血标本2 mL,以相同方法采集健康志愿者空腹外周血标本2 mL,标本于采集后2 h内进行检测。
2. 密度梯度离心法分离外周血单个核细胞(PBMC):所采集的外周血标本放入无菌离心管中,以无菌PBS稀释血液1倍,反复吹打均匀后,加入预先加有淋巴细胞分离液的离心管中(稀释血液与分离液之比为2∶1),1 800 r/min离心25 min;吸取中间白色的淋巴细胞白膜层,加入预装15 mL PBS的离心管中,1 800 r/min离心5 min;弃尽PBS,以15 mL PBS重悬细胞,1 200 r/min离心5 min。获得的细胞即为PBMC,用于后续实验。
3. 流式细胞术检测外周血Tim-3+、PD-1+、Tim-3+PD-1+γδT细胞比例:取7只无菌流式管,分别加入PBMC (1~2)×106个(100 μL),并依次标记①~⑦,按相应序号分别加入以下抗体:①空白对照组;②CD4-FITC 0.5 μL;③CD4-PE 0.5 μL;④CD3-PC5 0.5 μL;⑤CD3-PC7 0.5 μL;⑥CD3-PC5 0.5 μL +γδT-FITC 1.5 μL+IgG-PE 0.2 μL+IgG-PC7 0.2 μL;⑦ CD3-PC5 0.5 μL +γδT-FITC 1.5 μL+Tim-3-PE 3 μL +PD-1-PC7 3 μL。混合均匀后置于冰上避光孵育20 min,各管加1 mL PBS洗1遍,1 200 r/min 离心5 min;弃尽PBS,以300 μL PBS重悬细胞,上流式细胞仪检测,FlowJo流式细胞分析软件进行数据分析。
四、统计学分析
应用SPSS 23.0统计学软件,实验结果数据不符合正态分布,以M(P25~P75)表示,两组间比较采用两独立样本Mann-Whitney U检验,P<0.05为差异有统计学意义。
结 果
一、结肠癌患者外周血Tim-3+、PD-1+、Tim-3+PD-1+ γδT细胞比例变化
流式细胞分析显示,结肠癌患者外周血Tim-3+、PD-1+、Tim-3+PD-1+γδT细胞比例均明显高于对照组,差异有统计学意义(P<0.05)(图1)。
二、结肠癌患者外周血Tim-3+、PD-1+、Tim-3+PD-1+ γδT细胞比例与临床病理特征的关系
统计学分析显示,结肠癌患者Tim-3+、PD-1+、Tim-3+PD-1+γδT细胞比例与患者性别、年龄、肿瘤部位、有无远处转移无明显相关性(P>0.05),与肿瘤体积和TNM分期呈显著正相关,肿瘤体积越大、TNM分期越高,Tim-3+、PD-1+、Tim-3+PD-1+γδT细胞比例越高(P<0.05)(表1)。
右半结肠:盲肠、升结肠、结肠肝曲、横结肠;左半结肠:结肠脾曲、降结肠、乙状结肠[4]
TNM分期:根据2017 NCCN结肠癌临床实践指南
肿瘤体积V=ab2/2(cm3),a(cm)为肿瘤标本最大直径,b(cm)为肿瘤标本最小直径[5]
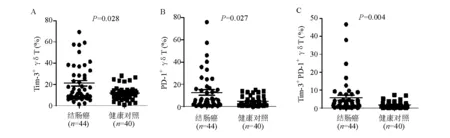
图1 结肠癌患者外周血Tim-3+、PD-1+、Tim-3+PD-1+ γδT细胞比例变化
讨 论
近年来,随着生活习惯和膳食结构的改变,在一些发展中国家,包括中国、俄罗斯、巴西等,结直肠癌发病率逐年上升[6]。结直肠癌发病机制复杂,机体免疫缺陷或免疫抑制是肿瘤发生、发展的主要原因之一[1]。γδT细胞是执行固有免疫功能的T细胞,其TCR由γ链和δ链组成,活化的γδT细胞可通过分泌细胞因子(IFN-γ、TNF-α)、释放颗粒酶和穿孔素以及通过Fas、TRAIL死亡受体途径发挥抗结肠癌作用[7]。目前研究表明,γδT细胞的活化和增殖需要CD28协同刺激信号,表明共刺激分子在γδT细胞的活化中起有重要作用[8]。
Gertner-Dardenne等[9]的研究发现,共刺激分子BTLA与其配体疱疹病毒入侵介质(HVEM)相互作用可负性调控γδT细胞分化和增殖,从而介导肿瘤细胞免疫逃逸。而与BTLA同为负性共刺激分子的Tim-3和PD-1在结肠癌患者外周血γδT细胞中作用的研究尚少。Tim-3是T细胞免疫球蛋白和黏蛋白结构域基因家族成员之一,PD-1为免疫球蛋白超家族成员,两者在多种免疫细胞表面均有表达,如T细胞、树突细胞(DCs)、单核细胞、肥大细胞、自然杀伤细胞(NK细胞)、肿瘤浸润性淋巴细胞(TILs),可能参与机体炎症和应激反应,同时其表达受肿瘤微环境中多种分子的调控。两者与相应配体结合后,T细胞出现“耗竭现象”,调节性T细胞(Treg细胞)介导的免疫抑制功能增强,促使肿瘤相关巨噬细胞(tumor-associated macrophage, TAM)向M2型极化,从而形成有利于肿瘤形成的微环境,进而促使肿瘤细胞发生免疫逃逸[10-12]。
研究发现Tim-3、PD-1在多种恶性肿瘤的TILs和外周血中呈高表达,如结直肠癌、肝细胞癌、胃癌、宫颈癌、卵巢癌、乳腺癌等,并与肿瘤进展和患者预后密切相关[3,10-11,13-14];Tim-3基因多态性与包括消化系统恶性肿瘤在内的多种恶性肿瘤风险增加密切相关[15]。有学者分析了Tim-3在结肠癌组织和相应正常结肠组织中的表达情况,发现其在结肠癌组织中呈高表达,并与肿瘤浸润深度、淋巴结转移、TNM分期和预后不良呈显著正相关[16]。但Zhang等[17]的研究发现,结直肠癌患者外周血和肿瘤组织中的Tim-3表达显著下调,并与肿瘤体积和TNM分期呈负相关,肿瘤体积越大、TNM分期越高,Tim-3 mRNA和蛋白表达水平越低。尽管有关Tim-3在结直肠癌中表达和功能的报道存在不一致性,但这些研究提示Tim-3在结直肠癌的发生、发展中扮演重要角色,有待进一步深入研究。Berntsson等[18]的研究发现结直肠癌组织中PD-1表达与肿瘤浸润深度、淋巴结转移和远处转移密切相关。上述数据均提示Tim-3和PD-1与结直肠癌的发生、发展有密切联系。然而,目前关于两者在结肠癌患者外周血γδT细胞表面表达情况的研究尚少。本研究检测了44例结肠癌患者和40名健康志愿者的外周血γδT细胞表面Tim-3、PD-1表达情况,发现结肠癌患者外周血Tim-3+、PD-1+、Tim-3+PD-1+γδT细胞比例均显著高于健康志愿者,进一步分析其表达与肿瘤临床病理特征的相关性,发现外周血Tim-3+、PD-1+、Tim-3+PD-1+γδT细胞比例与患者性别、年龄、肿瘤部位、有无远处转移无关,而与肿瘤体积和TNM分期显著相关,肿瘤体积越大、TNM分期越高,即肿瘤负荷越大,外周血γδT细胞表面Tim-3、PD-1表达水平越高。推测高表达的Tim-3和PD-1与相应配体结合后,发挥对γδT细胞功能的抑制作用,使其失去免疫监视、免疫清除能力,最终导致肿瘤发生、发展和转移。
综上所述,结肠癌患者外周血γδT细胞表面Tim-3、PD-1表达明显升高并与肿瘤临床病理分期相关,有可能成为评估结肠癌发生、发展的客观指标。本研究的不足之处在于样本量偏小且未能对高表达的Tim-3和PD-1如何影响γδT细胞功能作进一步研究分析。后续研究拟扩大样本量以验证本次结果,并对Tim-3、PD-1影响γδT细胞功能的可能分子机制进行深入探讨,从而更全面、充分地了解γδT细胞表面Tim-3、PD-1表达变化在结肠癌发生、发展中的作用,为结肠癌治疗提供新的靶点。
