哈维氏弧菌磷脂酶D对不同磷脂单分子层的吸附动力学研究
2019-04-29吴宗泽陈华勇王永华王方华
吴宗泽,陈华勇,杨 博,王永华,王方华
(1.华南理工大学生物科学与工程学院,广州 510006; 2.华南理工大学 食品科学与工程学院,广州 510640)
磷脂酶D(Phospholipase D,PLD)(EC 3.1.4.4)是一类能水解磷脂质生成磷脂酸和羟基化合物的酶[1]。除了具有水解活性外,PLD还可通过磷酰基转移作用催化磷脂质极性头部基团的转移反应,从而将大量磷脂酰胆碱(PC)催化合成为自然界稀有的磷脂质,如磷脂酰乙醇胺(PE)、磷脂酰丝氨酸(PS)、磷脂酰甘油(PG)等[2-3]。合成的磷脂质在食品、化妆品、药品中具有重要应用价值[1]。目前,磷脂酶 D已成为合成和改造磷脂质的重要工具[1]。从催化反应过程看,无论是催化磷脂质水解反应还是磷酰基转移反应,由于磷脂酶D的反应底物是不溶于水的磷脂,因此与脂肪酶类似,磷脂酶D也属于界面酶。界面酶催化水解反应的进程大致可分为两步,首先水中游离的酶蛋白在脂质底物存在的条件下,从水相聚集到“脂质-水界面”上。其次,脂质底物进入酶蛋白催化活性中心,发生相应的催化反应,生成目的产物[4]。已有研究表明,“磷脂质-水界面”的存在以及界面的质量对于磷脂酶D活力的充分发挥具有重要影响[5]。而界面吸附作为酶催化反应的首要步骤,在该过程中发挥着重要作用。但目前对于磷脂酶D而言,大部分研究集中在利用其进行特定结构磷脂的合成[3],对于酶蛋白对脂质界面吸附特性的研究鲜有报道。
来源于哈维氏弧菌的磷脂酶D是新发现的一种酶,目前对于该酶的酶学特性尤其是该酶对不同磷脂底物的吸附动力学尚未见有相关报道。单分子层膜是目前公认的研究酶蛋白与脂质相互作用的经典模型[6]。基于单分子层技术可实现脂质单分子层-水界面特性的精准控制,从而为分子水平研究酶蛋白在磷脂质-水界面上的吸附动力学奠定基础[7-9]。本研究首次利用单分子层技术研究该酶对不同磷脂底物的吸附动力学,以期深入了解该酶的界面吸附特性以及针对该酶进行开发与应用。
1 材料与方法
1.1 实验材料
1.1.1 原料与试剂
L-α-磷脂酰胆碱(≥97%)、L-α-磷脂酰肌醇(≥99%),L-α-磷脂酰丝氨酸(≥97%),L-α-磷脂酰乙醇胺(≥99%),L-α-磷脂酰甘油(≥98%),均购于Sigma公司;氨苄抗生素、pET21a表达载体、诱导剂IPTG,均购于Invitrogen公司;质粒提取试剂盒、BCA蛋白定量试剂盒,购于上海生工生物工程有限公司。其他试剂均为分析纯。
1.1.2 仪器与设备
葡聚糖凝胶G-25柱(1 000~5 000 Da,1 cm×20 cm,GEHealthcare Bio-Science AB),Q柱(5 mL预装柱,嫁接葡聚糖的Seplite 6FF,配体—CH2N+(CH3)Cl-,粒径50~150 μm,流速300~500 cm/h,工作温度4~40℃,pH范围2~12,储存缓冲液20%乙醇,温度4~8℃),HYG-C型恒温振荡培养箱,JY92-IIN超声破碎仪,Biologic LP蛋白层析仪(Bio-Rad 公司),ELx800酶标仪(BioTek 公司),Micro TroughX LB膜分析仪(配备有界面吸附专用反应槽,芬兰Kibron公司),DTCZ-240N SDS-PAGE电泳仪,Triple TOF 5600 LC-MS质谱仪(美国AB SCIEX公司)。
1.2 实验方法
1.2.1 失活型哈维氏弧菌磷脂酶D大肠杆菌重组表达菌株的构建
首先,从NCBI蛋白数据库中下载哈维氏弧菌磷脂酶D的完整蛋白序列(GenBank: WP_005435673.1)。用在线信号肽分析软件SignalP 4.1 server对其信号肽进行分析预测。去掉N端24个信号肽氨基酸后的蛋白序列称为成熟蛋白序列。编码磷脂酶D成熟蛋白(VhPLD)的基因序列委托上海生工生物工程有限公司参照大肠杆菌密码子偏好性进行优化,同时在优化的基因序列N端和C端分别添加NdeI和XhoI酶切位点并进行全基因序列的合成。合成的VhPLD基因用NdeI和XhoI内切酶酶切后连入用相同内切酶进行酶切的pET21a表达载体。将构建的质粒pET21a-VhPLD转化大肠杆菌DH 5α 感受态细胞并进行测序验证。为了避免酶水解磷脂从而对酶蛋白的吸附过程研究造成干扰,在已经构建的pET21a-VhPLD表达载体的基础上进一步引入针对催化活性位点His157的单点突变(H157A),从而使表达酶蛋白丧失水解活性。单点突变体的构建采用重叠延伸法进行。将构建的突变体pET21a-VhPLD-H157A转化大肠杆菌DH 5α 感受态细胞并进行测序验证。将测序正确的质粒进一步转化到E.coliShuffleT7感受态细胞中,阳性克隆鉴定成功后,获得失活型哈维氏弧菌磷脂酶D的大肠杆菌重组表达菌株。
1.2.2 失活型VhPLD的表达与纯化
将重组表达菌株接种于5 mL含有氨苄抗生素的LB液体培养基(0.5%酵母提取物,1%蛋白胨,1%NaCl)中,37℃下过夜培养,制备种子液。按5%接种量接种放大于含有氨苄抗生素的LB液体培养基中,37℃、200 r/min下培养2~3 h至OD600为0.6~0.8,加入诱导剂IPTG,至终浓度为0.05 mmol/L。调整培养温度到20℃,继续发酵培养24 h。将诱导表达后的发酵菌液离心(8 000 r/min,6 min,4℃),去上清液,菌体用50 mmol/L Tris-HCl、100 mmol/L NaCl (pH 8.0) 重悬,超声破碎15 min,离心(10 000 r/min,15 min,4℃),收集破碎上清,用0.45 μm滤膜过滤。将收集到的破碎上清液进行Ni2+亲和层析。蛋白上样后,用Buffer A(50 mmol/L Tris-HCl,100 mmol/L NaCl,pH 8.0)冲洗,紧接着用Buffer B(含有100~500 mmol/L咪唑的Buffer A)进行梯度洗脱,收集出峰的蛋白样品。将100 mmol/L 咪唑梯度洗脱收集的出峰样品用G-25柱脱盐后,上样Q柱阴离子交换层析,最终用含有300 mmol/L氯化钠的缓冲液(50 mmol/L Tris-HCl,pH 8.0)洗脱得到目的蛋白样品。所得到的蛋白样品经SDS-PAGE电泳检测其纯度,用BCA蛋白定量检测试剂盒测定其蛋白浓度,用Triple TOF 5600 LC-MS(AB SCIEX)质谱仪进行LC-MS/MS鉴定分析。
1.2.3 VhPLD对不同磷脂单分子层吸附动力学参数测定
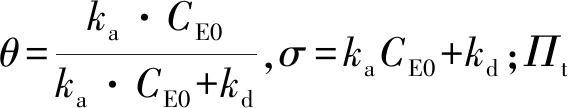
2 结果与讨论
2.1 失活型哈维氏弧菌磷脂酶D的表达与纯化
大肠杆菌表达系统相比于酵母表达系统,具有发酵周期短的优势。考虑到所表达目的蛋白来源于哈维氏弧菌这一原核细胞,因此在构建VhPLD重组表达体系的选择上,大肠杆菌表达系统成为本研究的首选。诱导表达后的电泳结果表明,虽然有部分目的蛋白以包涵体的形式存在于菌体破碎后的离心沉淀中,但破碎上清液中仍有部分可溶性蛋白存在。将破碎细胞上清液首先采用Ni2+亲和层析纯化,目的蛋白在含有100 mmol/L 咪唑的Buffer A 洗脱峰样品中得以富集。洗脱峰样品用G25柱脱盐去除所含有的咪唑后,用Q柱阴离子交换层析对样品作进一步纯化。目的蛋白用含有300 mmol/L氯化钠的50 mmol/L Tris-HCl (pH 8.0)洗脱缓冲液洗脱。电泳结果(如图1)表明,在54 kDa 左右处有明显的条带,蛋白大小与预期的结果类似(预测理论相对分子质量53 450.65 Da)。同时,取该蛋白条带用Triple TOF 5600 LC-MS (AB SCIEX)质谱仪进行LC-MS/MS分析鉴定,确认该条带即为要表达的目的蛋白。
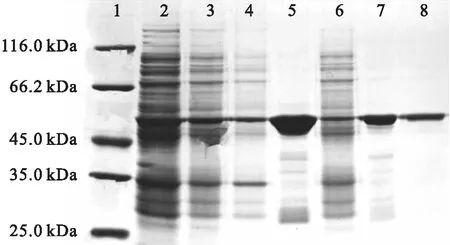
注:1.蛋白marker;2.菌体破碎液;3.菌体破碎后离心所得上清液;4.菌体破碎后离心所得沉淀;5.镍柱纯化所得100 mmol/L咪唑洗脱峰样品;6.镍柱纯化的上样穿过峰样品;7.G-25柱纯化的洗脱峰样品;8.Q柱纯化的300 mmol/L氯化钠梯度洗脱峰样品。
图1 失活型VhPLD的表达与纯化SDS-PAGE电泳图
2.2 VhPLD对不同磷脂单分子层的吸附动力学参数
单分子层最适合用来模拟细胞膜结构,基于此模型不仅可以研究界面酶分解脂质的动力学,还可以通过跟踪脂质分子面积的变化来研究蛋白质在磷脂单分子层上的吸附动力学,其中脂质分子面积的变化直接由界面表面压力的增加值(ΔΠ)进行精确监测[11-12]。磷脂分子是两亲性结构,由疏水性的酰基链尾端和一个极性头所组成。当含有磷脂的氯仿溶液滴加到水相表面时,随着氯仿有机溶剂的挥发,磷脂分子自然铺展开来,随即形成磷脂单分子层膜。单分子层技术正是基于该原理进行单分子层的制备,同时,利用高灵敏度探针精确测量磷脂单分子层的表面压力变化。选取常见的几种磷脂(PC、PE、PS、PG和 PI),测量VhPLD对不同磷脂的吸附动力学参数。同时,尝试比较不同初始表面压力条件下,酶蛋白吸附动力学参数的变化。对于不同的磷脂单分子层,选定的蛋白浓度范围为10~250 nmol/L,在不同的Πi下进行一系列的吸附动力学测定。
2.2.1 单一初始表面压力条件下VhPLD对不同磷脂单分子层膜的吸附动力学参数
由于膜组分通常形成水不溶性单分子层,因此膜表面浓度被定义为单位面积上界面的物质量。膜表面压力π被定义为水相表面张力(γ0)与薄膜覆盖表面的表面张力(γf)之差,其中γ0为72.8 mN/m[13]。表面压力是表征磷脂单分子层的一个重要的参数。Boisselier等[14]提出影响蛋白与脂质单分子层结合的因素有很多,如下相中缓冲液的组成、脂质膜的性质、蛋白的性质等。
在初始表面压力为15 mN/m的条件下(见图2),VhPLD对PC、PE、PS、PG和PI的吸附常数分别为(1.19±0.02)×104、(6.69±0.55)×103、(8.51±0.93)×103、(3.59±0.17)×103、(2.89±0.35)×103mol/(L·s)。VhPLD 对不同磷脂单分子层膜的吸附常数之间存在显著性差异(P<0.05),其中,吸附常数最大值出现在PC,最小值出现在PI。吸附常数值越大,表明酶蛋白越容易吸附到磷脂质-水界面上。VhPLD对PC、PE、PS的解离常数分别为(2.99±0.20)×10-3、(3.67±0.50)×10-3、(3.82±0.81)×10-3s-1,统计学分析表明3组数据之间无显著性差异(P>0.05)。而VhPLD对于PG和PI的解离常数分别为(1.17±0.24)×10-3s-1和(1.77±0.48)×10-3s-1,统计学分析表明2组数据之间无显著性差异(P>0.05)。然而,VhPLD对PC、PE和PS的解离常数与对PG和PI的解离常数之间存在显著性差异(P<0.05)。解离常数越小,表明酶蛋白与磷脂结合越紧密,不容易从界面上解离下来,反之,表明酶蛋白越容易与磷脂分离。在初始表面压力15 mN/m条件下,该酶对PC具有最大的吸附平衡常数((3.98±0.01)×106mol/L),其次是PG((3.07±0.15)×106mol/L),相反地,对于PE和PI的吸附平衡常数仅为(1.82±0.15)×106mol/L和(1.63±0.20)×106mol/L。吸附平衡常数反映的是酶对磷脂的亲和力(或者是偏好性)大小,吸附平衡常数值越大,表明酶对磷脂的亲和力越大,反之,亲和力越小。以上结果表明,在初始表面压力为15 mN/m的条件下,VhPLD对PC的亲和力最强,而对于PE和PI的亲和力最弱。在初始表面压力15 mN/m条件下,VhPLD对不同磷脂单分子层吸附偏好性顺序为PC>PG>PS>PE=PI。
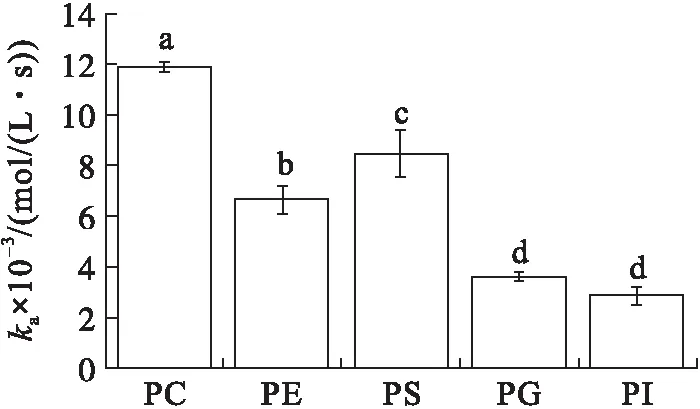
图2 初始表面压力15 mN/m的条件下VhPLD对PC、PE、PS、PG和PI的吸附动力学参数
在初始表面压力为20 mN/m条件下(见图3),与VhPLD在初始表面压力为15 mN/m条件下对不同磷脂的吸附常数趋势相同,VhPLD对PC的吸附常数最大((1.57±0.19)×104mol/(L·s)),其次为PS((1.26±0.10)×104mol/(L·s))。VhPLD对PG和PI的ka值分别为(3.72±0.12)×103mol/(L·s)和(3.49±0.35)×103mol/(L·s),均显著低于其他磷脂底物。然而,在20 mN/m条件下,VhPLD对于PE的解离常数((8.48±1.31)×10-3s-1)明显高于PC((3.80±1.40)×10-3s-1)和PS((4.26±0.97)×10-3s-1),该结果与在15 mN/m条件下结果有较大差异。VhPLD对于PG和PI的吸附平衡常数分别为(5.43±0.02)×106mol/L和(5.12±0.05)×106mol/L。该结果表明在初始表面压力20 mN/m条件下,酶对PG的亲和力最大,其次为PI,而对于PE的亲和力最小,吸附偏好性顺序依次为PG>PI>PC>PS>PE。
在初始表面压力为25 mN/m的条件下(见图4), VhPLD对PC的吸附常数最大((1.46±0.10)×104mol/(L·s)),对于PG((3.58±0.31)×103mol/(L·s))和PI((4.30±0.34)×103mol/(L·s))的吸附常数最小。在该初始表面压力条件下,VhPLD对于PC、PE和PS的解离常数之间不存在显著差异(P>0.05),该结果与在15 mN/m所测定的结果保持一致。而在该条件下获得的VhPLD对不同磷脂单分子层吸附偏好性顺序为PC>PS>PI>PE=PG。
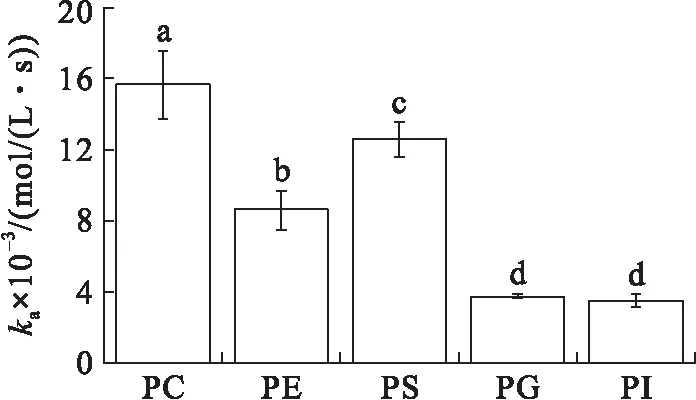
图3 初始表面压力为20 mN/m的条件下VhPLD对PC、PE、PS、PG和PI的吸附动力学参数
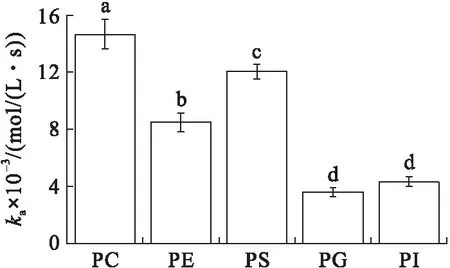
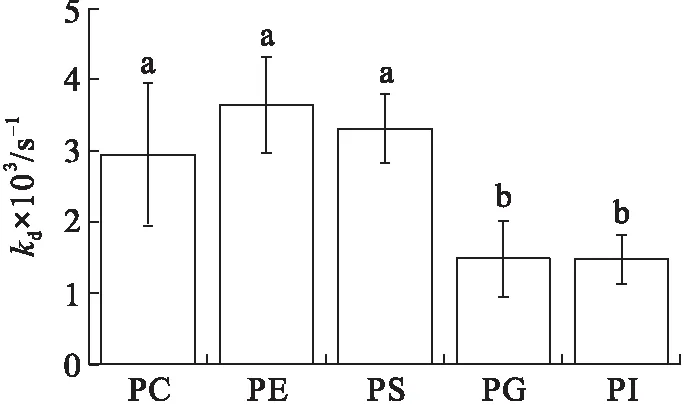
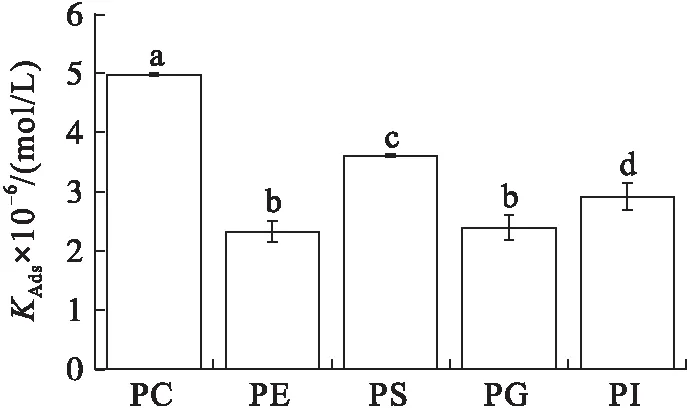
图4 初始表面压力为25 mN/m的条件下VhPLD对PC、PE、PS、PG和PI的吸附动力学参数
2.2.2 不同初始表面压力条件下VhPLD对单一磷脂的吸附动力学参数比较
相比于15 mN/m的初始表面压力条件,VhPLD在20 mN/m和25 mN/m条件下对PC、PE和PS的吸附常数均显著高于15 mN/m条件下相应的ka值(P<0.05),VhPLD在20 mN/m和25 mN/m条件下ka之间却没有显著性差异(P>0.05)。而对于PG而言,不同初始表面压力条件下ka之间没有显著性差异(P>0.05)。相反的,VhPLD在25 mN/m条件下PI的ka与在15 mN/m和20 mN/m条件下均有显著性差异(P<0.05)。
对于解离常数,除了在20 mN/m条件下对PE的kd值显著高于15 mN/m和25 mN/m条件下外,其他磷脂底物在不同初始表面压力下的kd值之间均没有显著性差异(P>0.05)。
不同初始表面压力条件对VhPLD的磷脂吸附亲和力具有较大的影响。对于PC及PS而言,亲和力随着表面压力的增加而逐渐增大,对于PE来说,其在20 mN/m条件下的亲和力要显著低于其他表面压力条件下的值,主要原因是由于在此表面压力条件下的kd值变大引起的。而对于PG和PI,最大的亲和力出现在20 mN/m条件下,主要是由于在此条件下酶的解离常数降低所导致。
3 结 论
酶蛋白对于磷脂质-水界面的吸附动力学参数与磷脂单分子层的种类及不同初始表面压力状态密切相关。在15 mN/m条件下,VhPLD对不同磷脂单分子层吸附偏好性顺序为磷脂酰胆碱>磷脂酰甘油>磷脂酰丝氨酸>磷脂酰乙醇胺=磷脂酰肌醇;在20 mN/m条件下,VhPLD对不同磷脂单分子层吸附偏好性顺序为磷脂酰甘油>磷脂酰肌醇>磷脂酰胆碱>磷脂酰丝氨酸>磷脂酰乙醇胺;而在25 mN/m条件下,VhPLD对不同磷脂单分子层吸附偏好性顺序则转变为磷脂酰胆碱>磷脂酰丝氨酸>磷脂酰肌醇>磷脂酰乙醇胺=磷脂酰甘油。该结果提示在表征酶对不同磷脂吸附动力学参数的时候,必须要强调所处的表面压力条件,否则单纯评价对于不同磷脂的吸附动力学参数是没有意义的。
