植入式心脏起搏器主要不良反应发生率的Meta分析
2019-04-29陶庆梅孙星河高乐翟伟梁伟孙凤
陶庆梅,孙星河,高乐,翟伟,梁伟,孙凤*
植入式心脏起搏器是一种植入于体内的电子治疗仪器,是治疗严重心律失常、部分心肌疾病及心力衰竭等疾病的一种有效手段[1]。目前,我国心脏起搏器的植入量在每百万人口中接近20台,且正在以每年15%左右的速度增长[2]。随着植入式心脏起搏器使用数量的增多,其不良反应也日益受到人们的关注,如电极移位、断裂、起搏阈值异常升高、感知过度、囊袋感染等已被频繁报道[3]。但目前尚缺乏大样本的调查数据对植入式心脏起搏器不良反应发生率进行全面报道。本研究系统收集国内外植入式心脏起搏器不良反应发生情况的文献,采用Meta分析总结植入式心脏起搏器不良反应发生率,并有针对性地提出风险控制建议,为今后提高植入式心脏起搏器的临床安全应用提供参考。
1 资料与方法
1.1 检索策略 中文数据库包括:中国生物医学文献服务系统(SinoMed)、中国期刊全文数据库(CNKI)、中文科技期刊全文数据库(VIP)和万方数据知识服务平台;英文数据库包括:PubMed、EMBase、Cochrane Library及临床试验注册平台(ClinicalTrails.gov)(http://www.clinicaltrails.gov),均从数据库最早收录时间检索至2016-11-01。中英文分别结合(植入式心脏起搏器)+(不良事件or不良反应or安全性)相关主题词和自由词进行检索。系统检索患者使用植入式心脏起搏器后所导致的囊袋感染、电池提前耗竭、电极脱位/移位、电极断裂、电极穿孔、电极阈值升高、膈肌刺激症状、皮肤破溃红肿、感知不良/过度、死亡等10种主要不良反应及其他(如囊袋血肿、起搏器综合征、起搏器功能不良、绝缘层/电极破损、心包穿孔等)不良反应的随访研究,并手工检索相关综述类文献后的参考文献补充未纳入的研究。
1.2 纳入与排除标准 纳入标准:(1)研究对象为使用植入式心脏起搏器的患者;(2)干预措施为使用植入式心脏起搏器;(3)报道了使用植入式心脏起搏器后囊袋感染、电池提前耗竭、电极脱位/移位、电极断裂、电极穿孔、电极阈值升高、膈肌刺激症状、皮肤破溃红肿、感知不良/过度、死亡或其他不良反应发生率或提供可统计发生率的数据及与其有关的主要影响因素;(4)研究类型为公开发表的评价植入式心脏起搏器安全性有关的病例对照试验(RCT)、类试验、队列研究或病例系列研究。排除标准:(1)动物实验;(2)研究对象未使用植入式心脏起搏器;(3)个案研究、案例研究;(4)文献综述、述评、专家意见、产品宣传等;(5)未报道不良反应发生例数、无法计算发生率等;(6)重复发表的研究。
1.3 文献信息提取 使用EpiData数据库编制资料提取表,提取的信息包括文献特征(第一作者、发表年份、研究类型、发表语言、样本量、质量评价)、研究对象基本特征(平均/中位年龄、男性比例、基础心脏疾病、主要伴随疾病、合并用药)、治疗方案(起搏器类型、随访时间)和不良反应(囊袋感染、电池提前耗竭、电极脱位/移位、电极断裂、电极穿孔、电极阈值升高、膈肌刺激症状、皮肤破溃红肿、感知不良/过度、死亡、囊袋血肿、起搏器综合征、起搏器功能不良、绝缘层/电极破损、心包穿孔等)的发生例数。上述不良反应为通过文献复习及专家咨询确定。考虑到部分有对照的研究是对两组或多组植入式心脏起搏器组(对比内容涉及起搏器类型、电极类型、植入方式、导丝定位方式、患者合并疾病及用药等)的安全性进行比较,本研究将其计入2个或多个子研究进行信息提取,共涉及524个植入式心脏起搏器组,统计不良反应发生率时,纳入至少发生1例不良反应的研究进行汇总。以每个植入式心脏起搏器组中不良反应发生例数作为分子,植入式心脏起搏器组总例数作为分母,计算不良反应发生率。
1.4 质量评价 对于RCT及类试验,按照Cochrane风险偏倚评估工具对每篇纳入文献进行质量评分,满分7分,总分≥4分为高质量文献[4];队列研究的质量评价采用纽卡斯尔-渥太华量表(Newcastle-Ottawa Scale,NOS)量表,满分9分,总分≥5分为高质量研究[5];病例系列研究采用英国国立临床优化研究所(National Institute for Clinical Excellence,NICE)推荐的质量评价标准,满分8分,总分≥4分为高质量研究[6]。文献检索、文献筛选、信息摘录和质量评价均由两名研究人员独立平行完成,出现疑问或意见不一致时,通过集中讨论(至少3人)或征求第三方专家意见解决。
1.5 统计学方法 采用SPSS 16.0和Meta-analyst统计学软件进行率的Meta分析。采用Q检验和P值分析各研究间的统计学异质性,用I2值评价异质性大小,当P≥0.10且I2≤25%时,表示各研究间无统计学异质性,采用固定效应模型进行Meta分析;若P<0.10或I2>25%,表示各研究间存在统计学异质性,对异质性来源进行分析,采用随机效应模型进行Meta分析计算各不良反应及总不良反应发生率的合并结果及其95%CI;根据随访时间、发表年份、起搏器类型进行亚组分析。以P<0.05为差异有统计学意义。
2 结果
2.1 文献检索结果 初检中文文献2 038篇,英文文献1 567篇,排除重复文献985篇后,剩余中文文献1 147篇,英文文献1 473篇。阅读题目和摘要后,剩余1 050篇,进一步阅读全文后最终纳入410篇文献,其中包括中文文献226篇,英文文献184篇。文献筛选流程见图1。
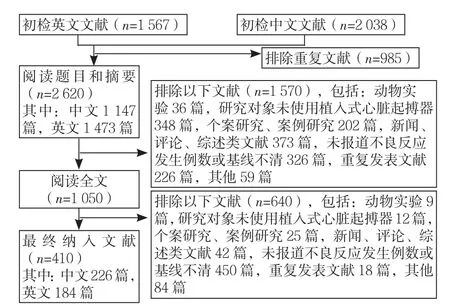
图1 文献筛选流程图Figure 1 Literature screening flow chart
2.2 文献基本特征 410篇文献共涉及524个植入式心脏起搏器组。文献发表年份为1964—2016年,中文文献226篇(占55.12%),英文文献184篇(44.88%);样本量范围为:4[7]~80 000例[8];365篇(89.02%)文献报道了中位/平均年龄,年龄跨度为 1 d[9]~104 岁[10-11];351 篇(85.61%)文献报道了男性比例,范围为27.50%[12]~100.00%[13]。289篇(70.49%)文献提及患者患有基础心脏疾病,143篇(34.88%)文献提及患者是否患有高血压、糖尿病等伴随疾病,74篇(18.05%)文献提及患者合并用药(包括抗生素、抗凝及抗血小板药物)。524个植入式心脏起搏器组中,临时起搏器63组(12.02%),永久起搏器457组(87.21%),未报道4组(0.77%);单腔起搏器136组(25.95%)、双腔起搏器164组(31.30%)、三腔起搏器〔包括心脏再同步治疗(CRT)〕19组(7.48%),205组(35.27%)为多种类型起搏器混合报道或未提供起搏器信息。243篇(59.27%)文献提及起搏器植入(穿刺)途径。
2.3 纳入文献质量评价 按照文献类型分类,RCT 55篇,其中≥4分的高质量研究21篇;类试验106篇,其中≥4分的高质量研究2篇;队列研究8篇,其中≥5分的高质量研究5篇;病例系列研究241篇,其中≥4分的高质量研究149篇。
2.4 不良反应发生率 Meta分析结果显示,植入式心脏起搏器组死亡发生率最高,为6.6%〔95%CI(4.8%,8.9%)〕,其次为其他〔4.5%,95%CI(4.0%,5.2%)〕、皮肤破溃红肿〔3.6%,95%CI(1.8%,7.0%)〕和电极脱位/移位〔3.4%,95%CI(2.9%,4.0%)〕,再次为电极阈值升高〔2.9%,95%CI(1.9%,4.5%)〕、感知不良/过度〔2.6%,95%CI(1.8%,3.8%)〕、电池提前耗竭〔2.3%,95%CI(1.4%,4.0%)〕等。总的不良反应发生率为7.5%〔95%CI(6.7%,8.4%)〕(见表1)。

表1 植入式心脏起搏器不良反应发生率的Meta分析结果Table 1 Meta-analysis of the incidence of major adverse events of cardiac pacemaker implantation
2.5 亚组分析
2.5.1 随访时间 随访时间3 d~6年,6~8周内可观察短期并发症,与组织水肿消退恢复有关[14-15],根据随访时间分为<6周、≥6周,部分文献因未提供随访时间,未纳入本亚组分析。Meta分析结果显示,<6周时植入式心脏起搏器组电极阈值升高发生率最高,为12.5%〔95%CI(6.6%,22.5%)〕,其次为感知不良/过度〔7.0%,95%CI(1.7%,24.2%)〕、电极脱位/移位〔5.4%,95%CI(3.2%,9.1%)〕和囊袋感染〔4.7%,95%CI(1.6%,13.3%)〕,总的不良反应发生率为7.3%〔95%CI(5.5%,9.8%)〕;≥6周时植入式心脏起搏器组死亡发生率最高,为6.0%〔95%CI(3.8%,9.3%)〕,其次为其他〔4.1%,95%CI(3.1%,5.6%)〕、电极脱位/移位〔3.2%,95%CI(2.5%,4.0%)〕和电池提前耗竭〔2.6%,95%CI(1.5%,4.6%)〕,总的不良反应发生率为7.1%〔95%CI(5.8%,8.7%)〕(见表2)。
2.5.2 发表年份 1977年双腔起搏器应用于临床,1998年三腔起搏器面世,2000年开始出现全自动起搏器,根据发表年份分为2000年以前、2000年及以后,Meta分析结果显示,2000年以前植入式心脏起搏器组电极阈值升高发生率最高,为13.0%〔95%CI(9.3%,17.9%)〕,其次为死亡〔8.6%,95%CI(5.9%,12.4%)〕、感知不良/过度〔7.0%,95%CI(3.0%,15.7%)〕和囊袋感染〔4.0%,95%CI(1.9%,8.4%)〕,总的不良反应发生率为7.7%〔95%CI(5.5%,10.8%)〕;2000年及以后植入式心脏起搏器组死亡发生率最高,为6.2%〔95%CI(4.4%,8.6%)〕,其次为其他〔4.7%,95%CI(4.1%,5.4%)〕、皮肤破溃红肿〔3.6%,95%CI(1.7%,7.7%)〕和电极脱位/移位〔3.4%,95%CI(2.9%,4.0%)〕,总的不良反应发生率为7.5%〔95%CI(6.7%,8.4%)〕(见表3)。
2.5.3 起搏器类型 根据起搏器类型分为单腔起搏器、双腔起搏器、三腔起搏器,部分文献因未提供起搏器类型信息,未纳入本亚组分析。Meta分析结果显示,单腔起搏器囊袋感染发生率最高,为11.5%〔95%CI(8.0%,16.2%)〕,其次为死亡〔10.6%,95%CI(3.7%,26.7%)〕、电极脱位/移位〔4.9%,95%CI(1.8%,12.7%)〕和其他〔3.0%,95%CI(1.3%,7.0%)〕,总的不良反应发生率为8.7%〔95%CI(4.2%,16.9%)〕;双腔起搏器死亡发生率最高,为13.9%〔95%CI(5.2%,32.1%)〕,其次为电极脱位/移位〔4.4%,95%CI(2.9%,6.6%)〕、囊袋感染〔4.1%,95%CI(1.6%,10.2%)〕和其他〔3.8%,95%CI(1.9%,7.3%)〕,总的不良反应发生率为8.6%〔95%CI(6.1%,11.9%)〕;三腔起搏器电极脱位/移位发生率最高,为7.7%〔95%CI(3.6%,15.6%)〕,其次为电极阈值升高〔5.0%,95%CI(0.7%,28.2%)〕、死亡〔3.0%,95%CI(0.4%,19.4%)〕和膈肌刺激症状〔2.1%,95%CI(0.8%,5.0%)〕,总的不良反应发生率为8.1%〔95%CI(4.7%,13.5%)〕(见表4)。
3 讨论
传统的心脏起搏治疗主要针对缓慢性心律失常。随着起搏技术的进步及循证医学发展,心脏起搏内容不断增加,1980年出现了植入型心律转复除颤器(implantable cardioverter defibrillator,ICD)预防和治疗恶性心律失常,2001年出现CRT治疗心力衰竭[16]。植入式心脏起搏器需长期置于人体内,因此需要采取特别措施,进行严格控制管理以保证其安全、有效。在我国,心脏起搏器属于《医疗器械分类目录》中用于心脏病的治疗、急救装置类产品,监管类别为Ⅲ类,分类编号为6821[17]。国家对医疗器械按照风险程度实行分类管理,第Ⅲ类具有较高风险。评价植入式心脏起搏器的风险程度,应当考虑起搏器的预期目的、结构特征、使用方法等因素[18]。在2005年全国医疗器械监督管理工作会议上,确定了医疗器械不良反应重点监测品种,植入式心脏起搏器被列为全国8个省市的重点监测品种之一[19]。
基于植入式心脏起搏器在临床的广泛应用和植入式心脏起搏器安全性问题的凸显这一现实背景,针对植入式心脏起搏器安全使用采取风险控制措施刻不容缓。但是本研究通过查阅现有植入式心脏起搏器相关文献发现,目前鲜有大样本调查数据支持的植入式心脏起搏器不良反应相关研究,也未见研究用数据证明植入式心脏起搏器不良反应产生的原因。想要控制植入式心脏起搏器不良反应的发生,首先必须追根溯源,找到究竟是哪些因素引起不良反应的发生,才能有针对性地采取风险控制措施。本研究从植入式心脏起搏器不良反应发生情况入手,采用Meta分析的方法,探索植入式心脏起搏器不良反应发生率,为今后植入式心脏起搏器的安全性研究提供依据。
本研究筛选出与植入式心脏起搏器不良反应相关的研究文献410篇,包括RCT 55篇、类试验106篇、队列研究8篇、病例系列研究241篇,共涉及524个植入式心脏起搏器组。Meta分析结果显示,总的不良反应发生率为7.5%〔95%CI(6.7%,8.4%)〕。死亡发生率最高,为6.6%〔95%CI(4.8%,8.9%)〕,其次为其他〔4.5%,95%CI(4.0%,5.2%)〕、皮肤破溃红肿〔3.6%,95%CI(1.8%,7.0%)〕和电极脱位/移位〔3.4%,95%CI(2.9%,4.0%)〕,再次为电极阈值升高〔2.9%,95%CI(1.9%,4.5%)〕、感知不良/过度〔2.6%,95%CI(1.8%,3.8%)〕、电池提前耗竭〔2.3%,95%CI(1.4%,4.0%)〕、电极穿孔〔1.7%,95%CI(1.0%,3.0%)〕、电极断裂〔1.5%,95%CI(0.7%,3.0%)〕、膈肌刺激症状〔1.2%,95%CI(0.8%,1.6%)〕。在PubMed中检索植入式心脏起搏器不良反应相关综述及Meta分析,缺乏同类型研究。选取仅涉及特定人群或特定类型植入式心脏起搏器报道不良反应发生率的综述类及多中心研究结果,本研究与其进行对比,可以看到电极脱位发生率与KIRKFELDT等[20]对荷兰1997—2008年植入式心脏起搏器及CRT电极不良反应发生率的统计接近。与荷兰2003年1月—2007年11月对植入式心脏起搏器患者的多中心队列研究FOLLOWPACE[14]进行对比,本研究总的不良反应发生率较低(7.5%与9.2%),皮肤破溃发生率较高(3.6%与0.53%),电极脱位发生率较高(3.4%与1.58%,但与其2周内电极脱位发生率相近),电极断裂发生率较高(1.5%与0.4%),膈肌刺激症状发生率较高(1.2%与0.66%)。考虑总的不良反应发生率偏低的原因在于,FOLLOWPACE研究[14]涉及气胸等操作并发症及脉冲发生器程序事件等范围更广的不良反应;Meta分析归纳研究的随访时间范围大,可能是本研究电极脱位发生率与该研究短期发生率接近的原因;作为多中心队列研究,仅涉及经验丰富的临床中心,其各不良反应报道率低于Meta分析结果是可以理解的。ARMAGANIJAN等[21]综合了CTOPP、DANISH和UKPACE 3个研究的数据,探讨≥75岁患者植入式心脏起搏器并发症发生率是否更高,结果显示,<75岁与≥75岁患者电极移位发生率分别为1.1%和2.0%,均低于本研究的3.4%;围术期死亡率分别为0.7%和0.5%,均低于本研究的6.6%;电极断裂发生率分别为3.6%和2.7%,均高于本研究的1.5%;总的不良反应发生率分别为3.4%和5.1%,均低于本研究的7.5%。因电极断裂与电极使用时间有关,考虑该研究平均随访5.1年,时限较长,可能涉及更高的电极断裂发生率。此外该研究揭示,<75岁组〔(66.9±8.1)岁〕电极断裂发生率更高;本研究涉及人群年龄跨度大(1 d~104岁),可能与电极断裂发生率较低有关。因预后与患者因素如性别、年龄、并发疾病、体质指数(BMI)及术者因素如中心累计手术量等均有关[14,22],考虑本研究死亡率较高与研究涉及人群的异质性有关。
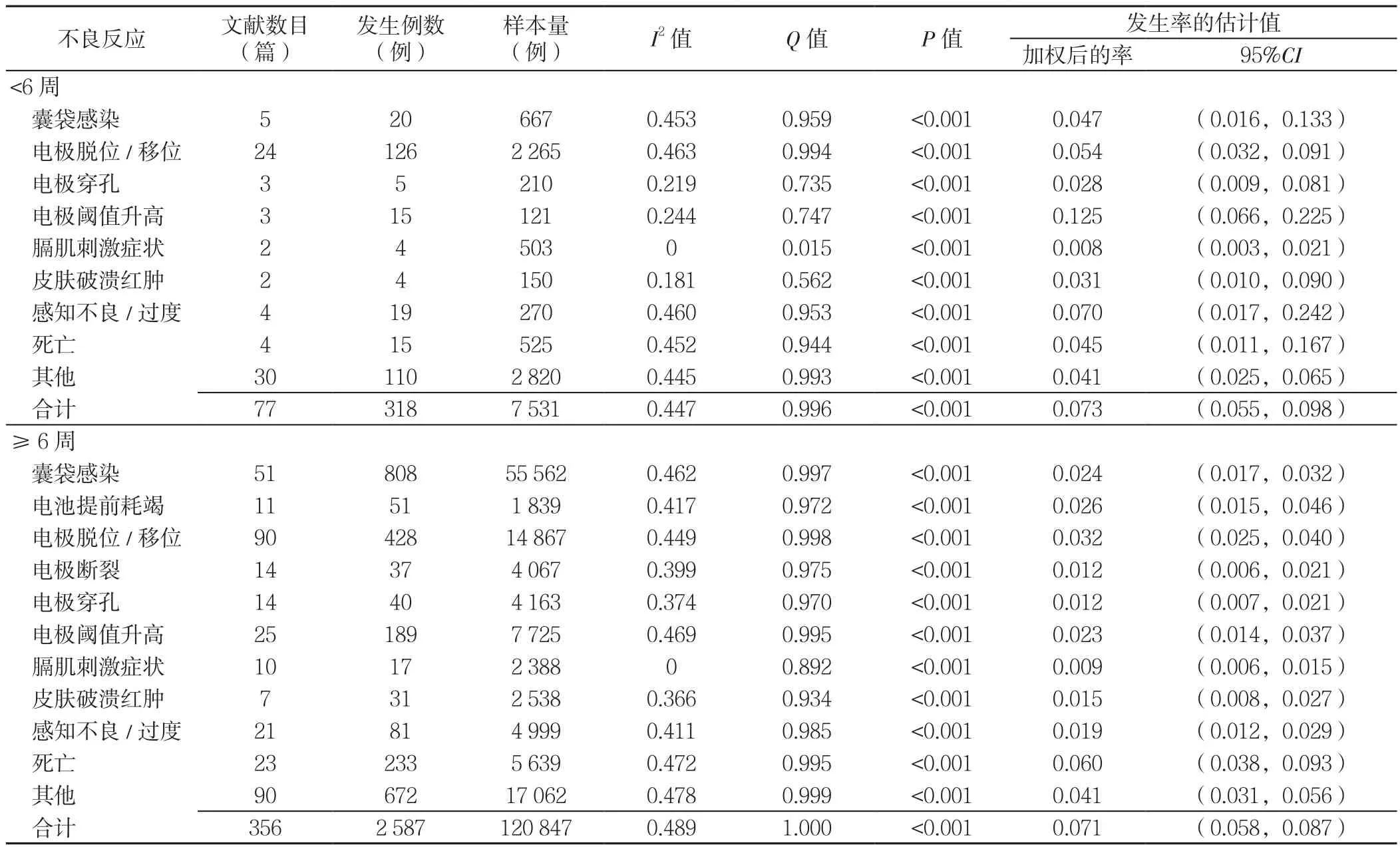
表2 不同随访时间植入式心脏起搏器不良反应发生率的Meta分析Table 2 Meta-analysis of the incidence of major adverse events of cardiac pacemaker implantation according to the follow-up period
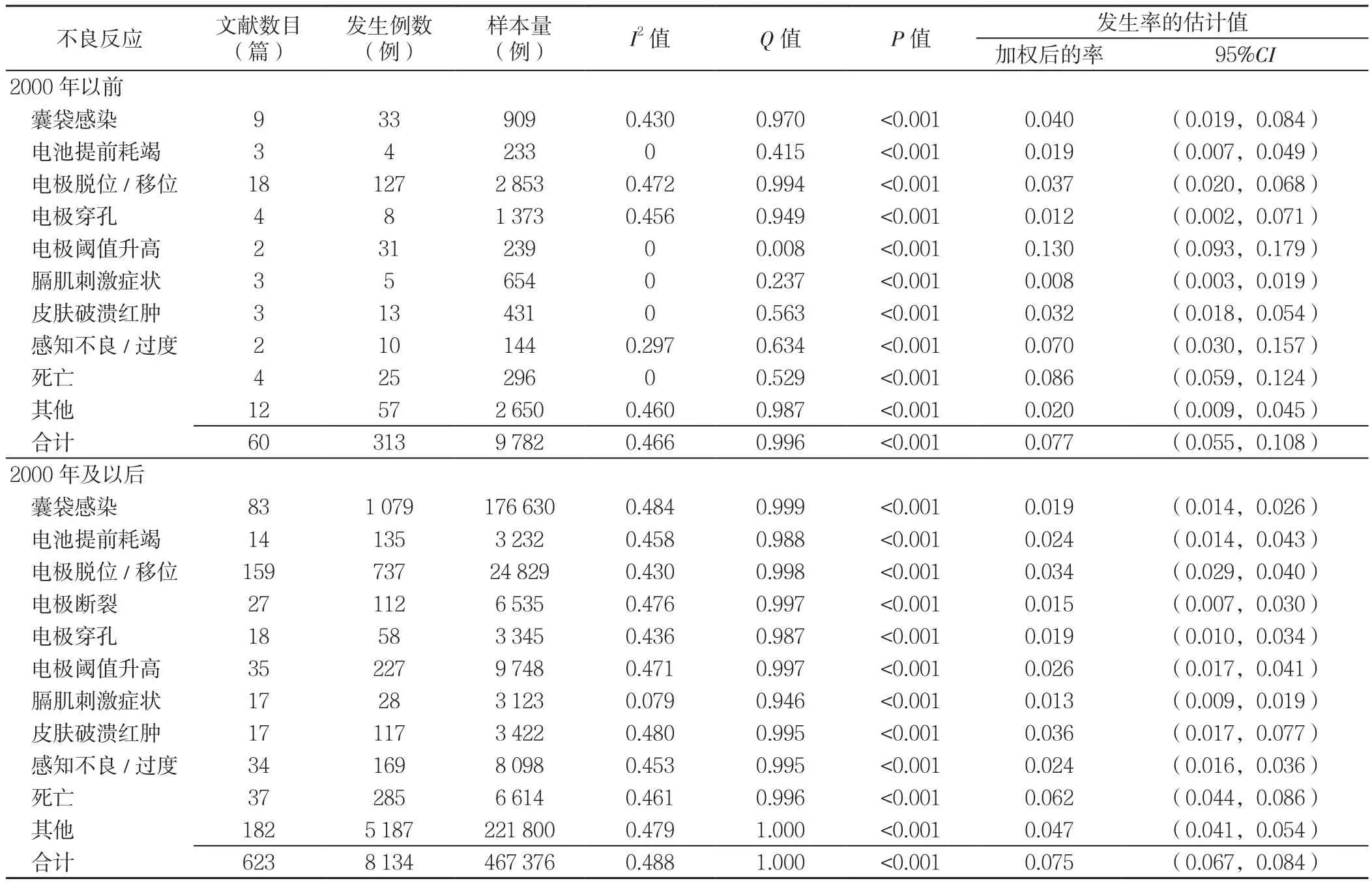
表3 不同发表年份植入式心脏起搏器不良反应发生率的Meta分析Table 3 Meta-analysis of the incidence of major adverse events of cardiac pacemaker implantation according to the publication year of the studies
因缺乏头对头直接比较,亚组分析结果仅具有优先的提示意义。可见,随访时间较长的研究,不良反应发生率反而更低,考虑与中心规模、患者一般情况有关,更大的中心及患者一般状况更好,易于长时间随访,倾向于报道较低的不良反应。2000年及以后,不良反应发生率似有下降趋势。单腔起搏器不良反应发生率稍高,考虑与其中包含临时起搏器、涉及患者合并疾病多、病情较重有关。
本研究仍存在一定的局限性:(1)受文献的质量、异质性等因素的影响较大。本次纳入的研究报道由于跨地域、时间范围较大,文献存在信息提供不全面、不良反应报道存在异质性等问题,涉及不良反应发生率的主要影响因素如患者特点、植入式心脏起搏器类型、植入式心脏起搏器为首次植入或升级、手术中心规模、术者经验水平等无法全面获得,难免会影响本研究结果的准确性。(2)由于仅纳入公开发表的文献,发表偏倚也是不可忽视的一个问题。(3)亚组分析时部分亚组所包含的文献数目和样本量较少,可参考性有限。(4)纳入的大多数研究仍为病例系列研究。因此,本研究的结果仍需要进一步大规模前瞻性研究进行验证和补充。综合以上原因,在外推本次研究结果时需谨慎。
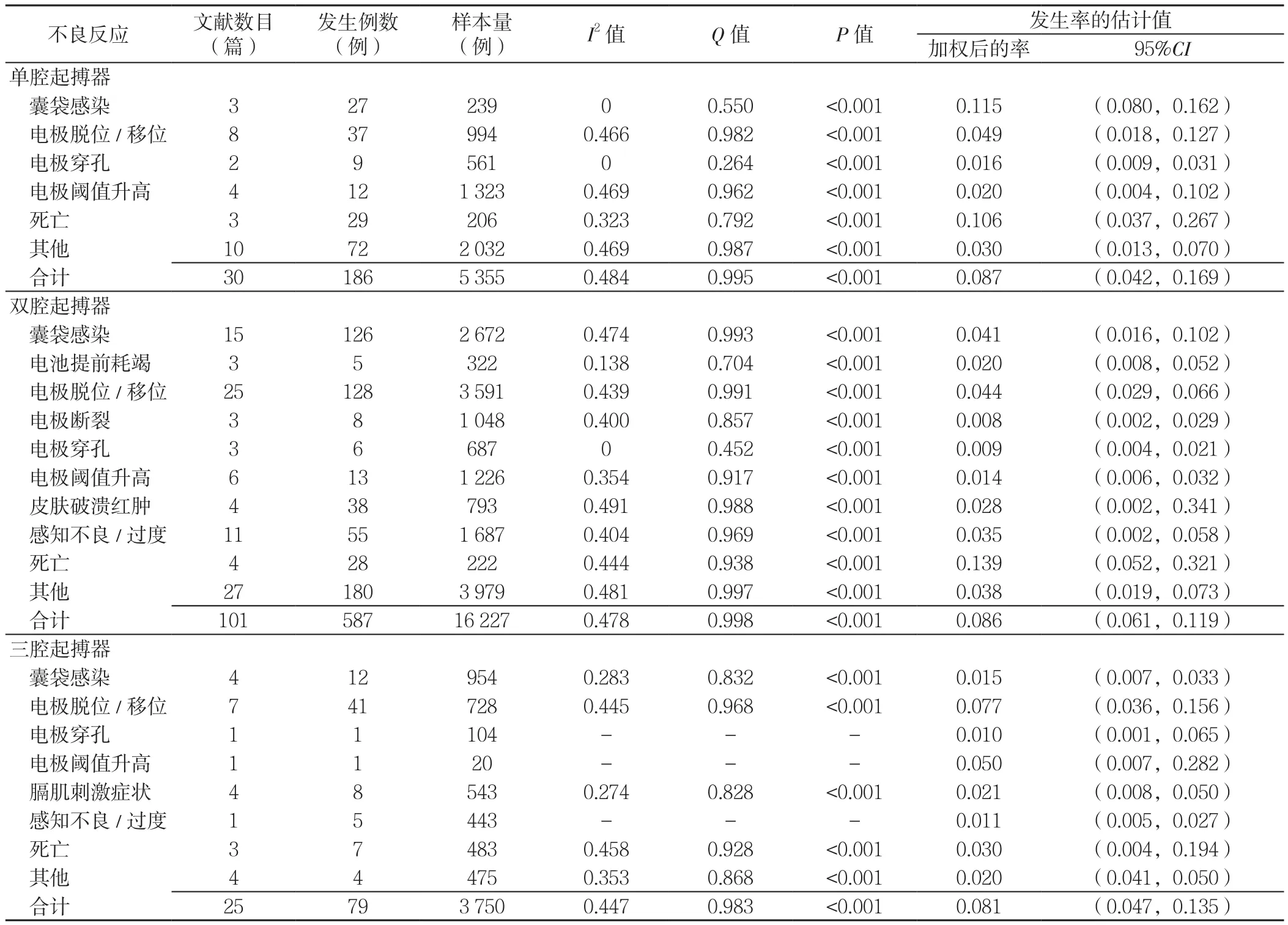
表4 不同类型植入式心脏起搏器不良反应发生率的Meta分析Table 4 Meta-analysis of the incidence of major adverse events of cardiac pacemaker implantation according to the type of pacemaker
总之,全因死亡、皮肤破溃红肿、电极脱位/移位、电极阈值升高、感知不良/过度、电池提前耗竭是植入式心脏起搏器较为频发的不良反应,在植入植入式心脏起搏器后,需要医务人员密切监测和观察其主要不良反应,尤其要加大对有严重基础疾病的高危人群的监测频率,对术后患者进行终身随访,一旦发现并发症,及时采取措施,防止或避免严重不良反应的发生,从而争取较好的长期疗效并提高患者的生命质量。
