多发性骨髓瘤合并高淀粉酶血症一例报道并文献复习
2019-04-29郭茂东丁进陈燕萍王群英翁翔叶晓华
郭茂东,丁进,陈燕萍,王群英,翁翔,叶晓华*
多发性骨髓瘤(multiple myeloma,MM)是一种以浆细胞恶性增殖并分泌大量单克隆免疫球蛋白为特征的恶性血液系统疾病,临床以骨痛、贫血、肾功能损害为主要表现[1]。当MM伴发髓外浸润时,其临床表现复杂多样,累及消化系统可出现腹痛、腹胀、呕吐等非特异性症状。血淀粉酶是临床最为常用的生化指标,用于诊断胰腺及腮腺疾病。MM合并高淀粉酶血症报道较少。当MM合并血淀粉酶水平升高并出现消化系统症状时,临床极易误诊为胰腺疾病。本研究报道1例因腹痛、高淀粉血症而被误诊为急性胰腺炎的MM患者。通过回顾性分析该例患者的诊断和治疗过程,同时针对本疾病的临床特点、生物学行为和预后进行文献复习,目的在于提高临床医生对MM合并高淀粉酶血症的认识。
1 病例简介
患者,男,65岁,因“上腹痛3 d”至当地医院就诊,门诊查血淀粉酶21 213 U/L,诊断为“急性胰腺炎”。予禁食、补液、抑酸、抑酶等治疗后症状无缓解。为求进一步诊治,患者于2016-08-08转至金华市中心医院。入院查体:体温36.8 ℃,脉搏64次/min,呼吸17次/min,血压145/87 mm Hg(1 mm Hg=0.133 kPa),神清,精神软,贫血貌,巩膜无黄染,浅表淋巴结未触及肿大,无肝掌及蜘蛛痣,心率64次/min,律齐,未闻及病理性杂音,双肺呼吸音清,未闻及干湿啰音。腹软,中上腹轻压痛,无反跳痛,肝脾肋下未触及,肝区叩击痛(-),Murphy征阴性(-),移动性浊音(-),肾区叩痛(-),肠鸣音正常,双下肢无水肿。神经系统查体阴性。实验室检查:血常规:白细胞计数6.3×109/L,血红蛋白88 g/L,血小板计数256×109/L,超敏C反应蛋白12.7 mg/L。生化指标:清蛋白34.1 g/L,丙氨酸氨基转移酶(ALT)41 U/L,天冬氨酸氨基转移酶(AST)37 U/L,肌酐115 μmol/L,乳酸脱氢酶553 U/L,血淀粉酶22 743 U/L,尿淀粉酶24 672 U/L,血脂肪酶56 U/L,β2微球蛋白0.97 mg/dl,免疫球蛋白IgG 33.90 g/L,IgA 0.40 g/L,IgM 0.32 g/L,血к轻链1.92 g/L,血λ轻链9.64 g/L,尿к轻链0.72 mg/dl,尿λ轻链11.90 mg/dl。腮腺B超未见腮腺炎及腮腺肿瘤征象;腹部CT:胰腺未见明显异常,胸腰椎体多发穿凿样骨质破坏(见图1);颅脑CT:颅骨多发骨质破坏并软组织影(见图2);骨盆X线片:骨盆多发虫蚀状骨质破坏改变(见图3)。骨髓涂片:浆细胞系统异常增生,原幼浆细胞占60%,可见双核、多核浆细胞(见图4)。诊断“多发性骨髓瘤IgG型”明确。确诊后予VTD(硼替佐米+沙利度胺+地塞米松)方案化疗。1周后患者腹痛缓解,复查血淀粉酶降至1 524 U/L。此后继续予原方案化疗,每4周给药1次,期间多次复查血淀粉酶波动于1 627~5 693 U/L。患者在第2次化疗结束后复查骨髓穿刺涂片示骨髓中原幼浆细胞降至42%,考虑效果不佳,改用VMD(硼替佐米+环磷酰胺+地塞米松)方案化疗,患者化疗4周后因继发肺部感染死亡。
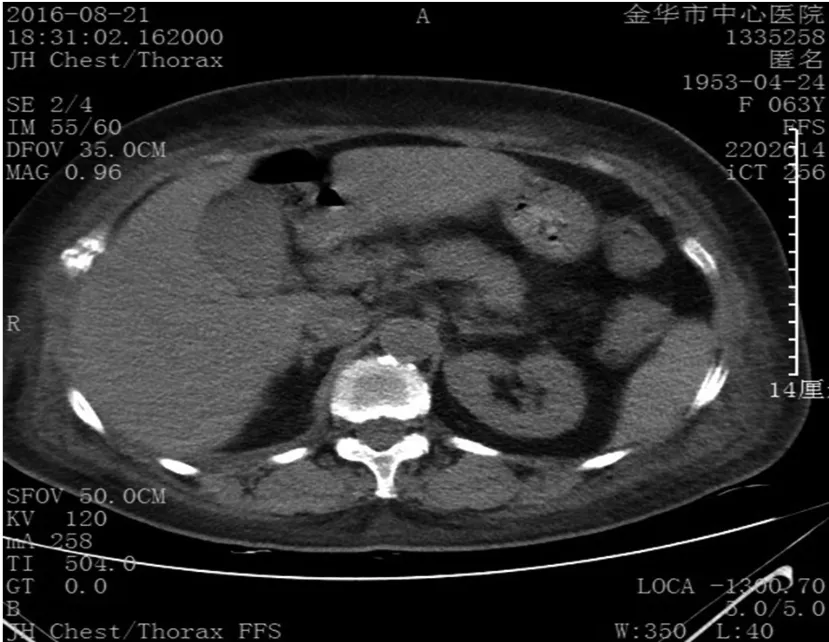
图1 腹部CT提示胰腺未见明显异常,胸腰椎体多发穿凿样骨质破坏Figure 1 Abdominal CT scan shows no obvious abnormalities of the pancreas and multiple areas of farfetched like bone destruction in thoracic vertebra
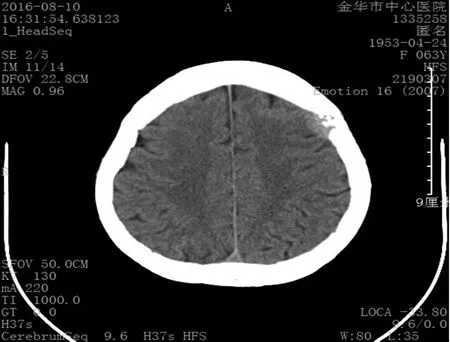
图2 颅脑CT可见颅骨多发骨质破坏并软组织影Figure 2 Brain CT scan shows soft tissue shadows and multiple bone destruction in the skull
2 文献复习
以“淀粉酶”“高淀粉酶血症”和“多发性骨髓瘤”为中文关键词检索万方数据知识服务平台和中国知网数据库,以“amylase”“hyperamylasaemia”和“multiple myeloma”为英文关键词检索PubMed数据库,检索时间均截至2017年10月,获取文献25篇[2-26],其中英文文献21篇[2-22],中文文献4篇[23-26]。共报道MM合并高淀粉酶血症患者26例,现将文献报道的26例及本病例共27例患者的临床资料进行总结分析。27例患者中,男15例,女12例;发病年龄42~85岁,平均发病年龄65岁。文献资料中共有21例患者具体描述临床症状,包括腰背痛8例,腹痛、呕吐7例,胸痛、咳嗽、呼吸困难3例,乏力、食欲不振1例,全身骨痛1例,上腹部不适1例,其中以腹痛、呕吐等消化道症状就诊比例高达33.3%(7/21)。20例患者报道了血淀粉酶水平,1 132~31 070 U/L,平均6 396 U/L。淀粉酶同工酶分型结果显示22例为唾液型淀粉酶(S-AMS),其余5例未进一步分型。27例患者中,24例报道了M蛋白分型结果,其中λ轻链16例,к轻链8例,λ∶к为2∶1。重链类型分类中IgA型8例,IgG型6例,IgD型5例,1例为无分泌型。治疗及预后方面,共有15例患者采用一线或二线骨髓瘤化疗方案治疗,2例进行自体骨髓移植,1例未治疗,其余9例具体治疗方案不详。在最终获得随访资料的13例患者中,最长生存期为30个月,中位生存期仅为7个月(见表1)。
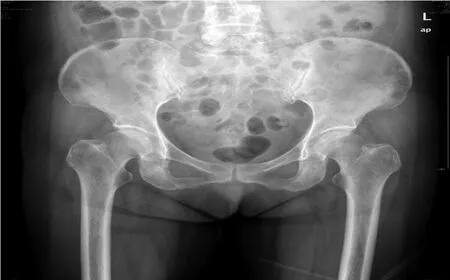
图3 骨盆X线片示骨盆多发虫蚀状骨质破坏改变Figure 3 Pelvic X-ray shows multiple worm-eaten bone destruction in the pelvis
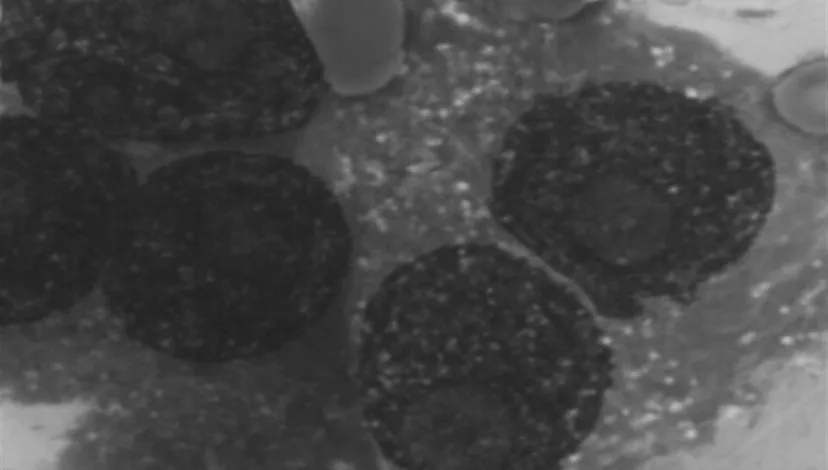
图4 骨髓涂片示浆细胞系统异常增生,原幼浆细胞占60%Figure 4 Bone marrow aspiration smear shows plasma cell hyperplasia(immature plasma cells accounting for 60%)
3 讨论
血淀粉酶可分为S-AMS和胰型淀粉酶(P-AMS)两种同工酶,分别占血清总淀粉酶活性的60%和40%。P-AMS只存在于胰腺,而S-AMS广泛分布于腮腺、肺、汗腺、乳腺、胃肠道及泌尿生殖系统。临床上,血淀粉酶是诊断急性胰腺炎的重要生化指标之一,血淀粉酶水平>3倍参考范围上限值对胰腺炎诊断的特异度为95%[27]。此外,高淀粉酶血症亦可见于腮腺炎、消化道穿孔、肠系膜栓塞、异位妊娠破裂等腹腔脏器损伤以及慢性肾功能不全、巨淀粉酶血症等。近年来,恶性肿瘤合并高淀粉酶血症报道逐年增多,但多见于肺癌、卵巢癌、胃癌等上皮源性肿瘤[28-29],MM少见。1988年日本学者HATA等[3]首次报道1例MM合并高淀粉酶血症患者。至今国内外文献仅报道26例,其中国内报道4例。回顾性分析上述27例(包括本病例)MM合并高淀粉酶血症患者,其中男性稍多于女性,平均发病年龄为65岁,骨髓瘤轻链分型以λ型多见,常见重链类型依次为IgA、IgG、IgD型,而IgM型罕见。

表1 MM合并高淀粉酶血症患者的临床特点及治疗转归Table 1 Clinical characteristics and treatment outcome of patients with multiple myeloma with hyperamylasaemia
MM合并高淀粉酶血症的临床表现复杂多样且缺乏特异性,在文献具体描述临床表现的21例患者中,依次表现为腰背痛、腹痛、呕吐、胸痛、呼吸困难等。其中以腹痛、呕吐等消化道症状就诊比例高达33.3%。本组资料中,4例MM合并高淀粉酶血症因伴腹痛而被误诊为胰腺炎[13,15,17],误诊率高达14.81%(4/27)。就本病例而言,该患者以急性腹痛就诊,查血淀粉酶水平>3倍参考范围上限值,根据2013年中华医学会消化病学分会制定的急性胰腺炎诊断标准[30],临床拟诊急性胰腺炎。但随后按急性胰腺炎治疗效果差,并且腹部CT无胰腺形态学改变,均不支持急性胰腺炎诊断。在确诊MM后,患者血淀粉酶水平随着化疗进行而显著下降,最终证实高淀粉酶血症与MM相关。由此可见,伴有消化道症状的MM合并高淀粉酶血症极易与急性胰腺炎混淆,临床需注意鉴别。腹部影像学检查是鉴别急性胰腺炎和MM合并高淀粉酶血症的有效手段。此外,淀粉酶分型在鉴别上述两种疾病中具有重要意义。国外病例资料表明,相较于P-AMS,MM合并高淀粉酶血症多表现为S-AMS水平升高[12,16]。因此,当出现腹痛伴血淀粉酶水平升高而难以用胰腺疾病解释时,应进行淀粉酶同工酶检测,这对高淀粉酶血症的病因鉴别诊断有重要价值。
一般认为,恶性肿瘤导致的血淀粉酶水平多>1 000 U/L[31]。在20例记录血淀粉酶水平的患者中,平均血淀粉酶水平为6 396 U/L,最低为1 132 U/L。有研究认为血淀粉酶水平与肿瘤消长有相关性,可作为评估MM患者疾病程度和预后的良好指标。当MM患者出现血淀粉酶水平升高时,其髓外转移的风险增加[4-5]。此类患者常瘤负荷更大,病情进展更快,预后更差。本组13例获得随访资料的患者中位生存期仅为7个月,远低于MM患者3~4年的中位生存期。
治疗方面,由于MM合并高淀粉酶血症发病率极低,缺乏大规模前瞻性研究,目前尚无标准治疗方案。传统化疗方案虽能一定程度减轻患者临床症状并降低血淀粉酶水平,但完全缓解率低。硼替佐米等靶向药物以及自体骨髓移植对MM合并高淀粉酶血症亦无显著疗效[32]。因此对于MM合并高淀粉酶血症合理的治疗方案仍需后续研究进一步探讨。
MM合并高淀粉酶血症详细分子机制尚未明确。研究表明,染色体结构异常可能是导致骨髓瘤细胞合成分泌淀粉酶机制之一。针对MM合并高淀粉酶血症患者的细胞遗传学研究发现,S-淀粉酶基因(AMY-1)所在的1号染色体短臂存在多种形式的染色体结构畸变,包括1号染色体片段缺失[20]以及AMY-1基因与23号染色体abl原癌基因片段易位[32]等。有学者认为上述染色体多种结构畸变可能通过改变AMY-1基因调控元件的功能或数量,从而导致淀粉酶异常表达[32-33]。
总之,本研究通过对MM合并高淀粉酶血症患者的临床特点进行分析,旨在提高临床医生尤其是消化科、血液科医生对MM合并高淀粉酶血症的认识。临床工作中遇到高淀粉酶血症特别是伴有腹痛症状的患者,接诊医生应详细询问患者病史,并进行全面体格检查,条件允许的情况下尽快完善胰腺影像学检查以及淀粉酶同工酶检测,必要时结合腮腺B超等检查,综合分析患者临床资料,最大限度减少误诊。
