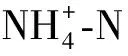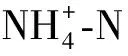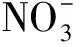局部根系水分胁迫下氮素形态对水稻幼苗生理特性和根系生长的影响
2019-04-29高志红陈晓远
高志红,陈晓远,曾 越
(韶关学院 英东农业科学与工程学院,广东 韶关 512005)
干旱缺水是影响农业生产力提高的重要因素。水稻是广东省种植面积最大的作物,也是需水最多的作物,其需水量约占广东农业用水量的65%~70%。实行节水栽培,提高植株的用水效率和对适度水分胁迫的适应性将是广东今后发展水稻生产的必然选择。
局部根系水分胁迫(Partial root-zone drying,简称PRD)作为一种新近发展起来的节水灌溉技术方法,正逐渐受到研究者的关注[1]。局部根系水分胁迫下,非胁迫一侧的根系仍然能够吸收水分、养分,而胁迫侧根系则通过产生水分胁迫响应信号(如ABA、pH) 并经木质部传输到地上部分,调节叶片气孔开度,减少奢侈的蒸腾耗水[2],提高水分利用效率(简称WUE)[3-7]。在葡萄、果树、玉米等作物上进行的分根试验结果表明,只给一半根区土壤供水就可以使幼苗保持正常生长,显著提高用水效率[3-5,8]。然而, 作物WUE的高低除与供水量和供水方式有关外,还与肥料的种类、施用量和施肥方式等密切相关[9]。因此,有必要开展局部根系水分胁迫下作物对水肥耦合效应的响应研究。
氮是植物生长发育不可缺少的营养元素。许多研究表明,氮肥供应可以减小干旱胁迫对植物生长的影响[10-12]。其中,通过氮素营养形态的不同组合调控水稻生长发育和用水效率的研究近年来受到越来越多国内学者的关注[13-14],并且多数研究结果显示,在水分胁迫条件下,单一供应铵态氮或硝态氮营养均会使水稻生物量的积累降低,铵态氮和硝态氮配合施用则能够促进植株生长,改善其水分利用[15-16]。由此可见,当前研究主要集中在揭示氮素形态和水分胁迫的相互作用对水稻的影响机制,并以此优化氮素配比,提高水稻水分利用效率(WUE)。然而,尽管研究显示局部根系水分胁迫或氮素供应可以提高植物WUE[17-18],但对局部根系水分胁迫和氮素形态的相互作用却知之甚少[2]。
本研究的目的是了解局部根系水分胁迫和不同形态氮素配比的相互作用如何影响水稻幼苗的光合生理特性和氮素积累,探讨有利于水稻WUE提高的铵、硝营养形态配比和根系供水模式。
1 材料和方法
1.1 供试材料及试验设计
供试水稻(OryzasativaL.)品种为金优402。试验于韶关学院农业基础广东省实验教学示范中心温室内进行。试验采用营养液培养方法。水稻种子经30% H2O2溶液浸泡15 min,无菌水洗净后,用清水浸种24 h,取出后在32 ℃恒温培养箱中催芽24 h,再用砂培法于温室内进行育苗,温室内温度白天约为30 ℃,光合有效辐射为1 200~1 500 μmol/(m2·s),夜晚为27 ℃。培养至一叶一心时,挑选生长一致的幼苗,移栽到打好孔的PVC板上,每个孔内移入1株水稻,用海绵固定后放在装有全营养液的培养钵内进行培养,营养液采用国际水稻研究所(IRRI)的常规营养液配方并略作改进,并添加2 mmol/L的硅酸钠(pH 值4.9~5.1),以保持营养液中的SiO2含量为0.2 mmol/L,添加氮素用量5%的双氰胺2 mg/L,以抑制硝化作用。混合氮营养液采用硫酸铵与硝酸钙试剂配制。采用5%聚乙二醇6000(PEG 6000)模拟水分胁迫,加入量为100 g/L。
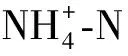
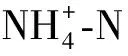
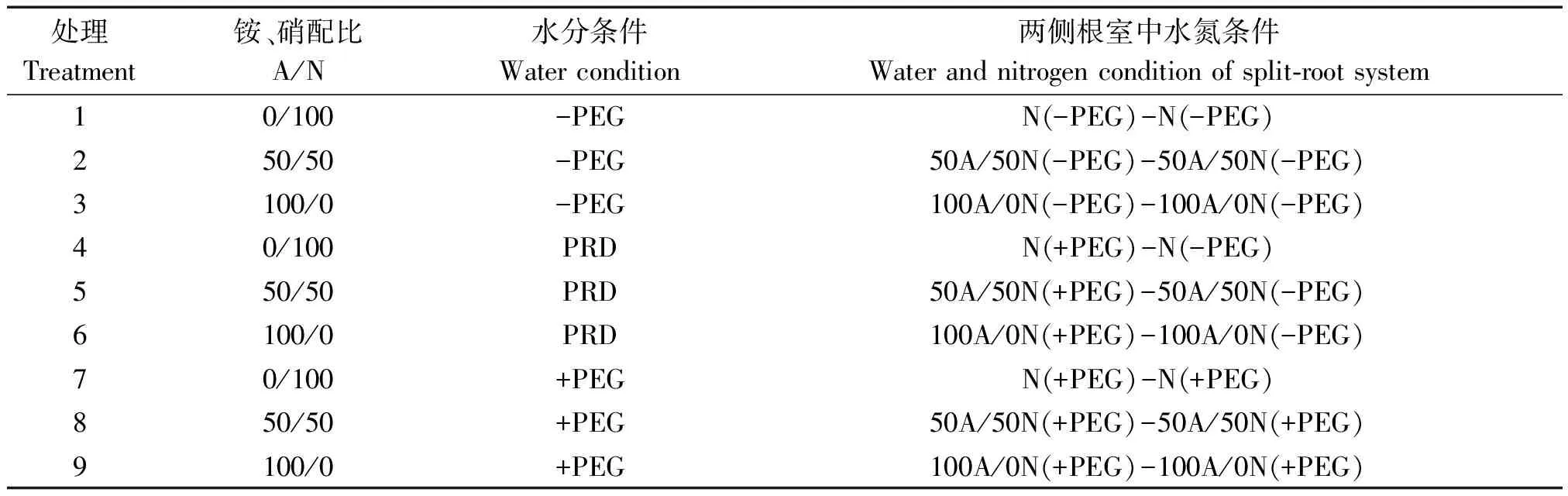
表1 试验处理设置Tab.1 Treatments of the experiment
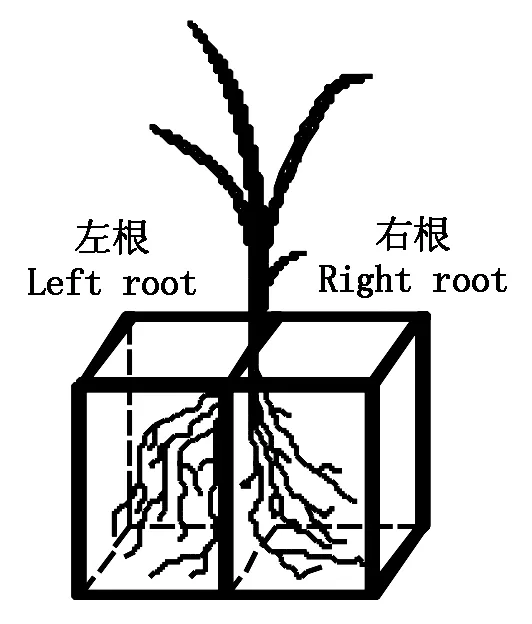
图1 水稻幼苗分根培养Fig.1 Schematics view of split-root system of rice seedling
培养期间,每2 d 更换1次营养液,每天早、晚各调1次pH值。用0.1 mol/L NaOH和HCl将培养液pH值调到4.9~5.2。水分胁迫开始后第2天开始取样测定,每隔2 d取样1次,第4次取样后解除水分胁迫,水分胁迫解除后再连续取样测定2 d。
1.2 测定项目和方法
1.2.1 植株叶片和茎秆全氮 靛酚蓝比色法:取0.3 g烘干、磨碎的样品放入消煮管中,加入8 mL的硫酸,轻轻摇匀后在瓶口放一弯颈小漏斗,在KDN-04消化炉进行消煮。在消煮过程中重复3~5次加入H2O2,加入量逐渐减少,直到消煮液无色后取出。将消煮液无损地洗入100 mL容量瓶中,用水定容,后用H2SO4-H2O2测定。
将待测液用水准确稀释10倍,吸取稀释后的溶液1.00 mL于50 mL容量瓶中,加入1 mL EDTA-甲基红溶液,用氢氧化钠溶液调节至pH值6左右,再依次加入5 mL酚溶液和5 mL次氯酸钠溶液,摇匀,用水定容,待1 h后,用1 cm的比色皿在625 nm波长处比色,用空白试验溶液调节零点。
1.2.2 植株铵态氮和硝态氮净吸收量 铵态氮和硝态氮净吸收量=试验开始前营养液中铵态氮和硝态氮含量-试验结束后营养液中铵态氮和硝态氮含量。
铵态氮的测定:靛酚蓝比色法。吸取各处理培养液,放入50 mL容量瓶中,依次加入5 mL酚溶液和5 mL次氯酸钠碱性液,摇匀放置1 h后,加入1 mL掩蔽剂以溶解可能生成的沉淀物,然后用水定容,用1 cm比色皿在625 nm波长处进行比色。用空白试验溶液调节零点。绘制标准曲线从中查得显色液中氮的质量浓度(mg/L)。
计算公式为:水样中铵态氮含量(mg/L)=p×50/V
其中,p.从工作曲线上查得显色液中氮的质量浓度(mg/L);50.显色液体积(mL);V.吸取水样体积(mL)。
硝态氮的测定:紫外分光光度计法,吸取各处理的培养液直接在紫外分光光度计上用220,275 nm的波长和1 cm石英比色皿测定吸收值A=A220-A275。再从工作曲线上读取水样中硝酸根含量(mg/L)。
1.2.3 营养液质量的净减少值 营养液被植物吸收前后都用天平称量,相减得出植物净吸收营养液的质量。左根室与右根室中的营养液分别称质量。
1.2.4 光合作用 采用LI-6400便携式光合作用测定系统测定。
1.2.5 根系形态 采用加拿大REGENT根系分析系统(EPSON TWAIN PRO)分析测定根长、表面积、体积、分形维数等根系形态指标。
1.3 统计分析
试验数据均采用Microsoft Excel软件进行统计分析,对各处理间的差异进行0.05水平上的显著性检验。
2 结果与分析
2.1 水稻幼苗全氮含量
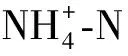
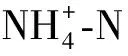
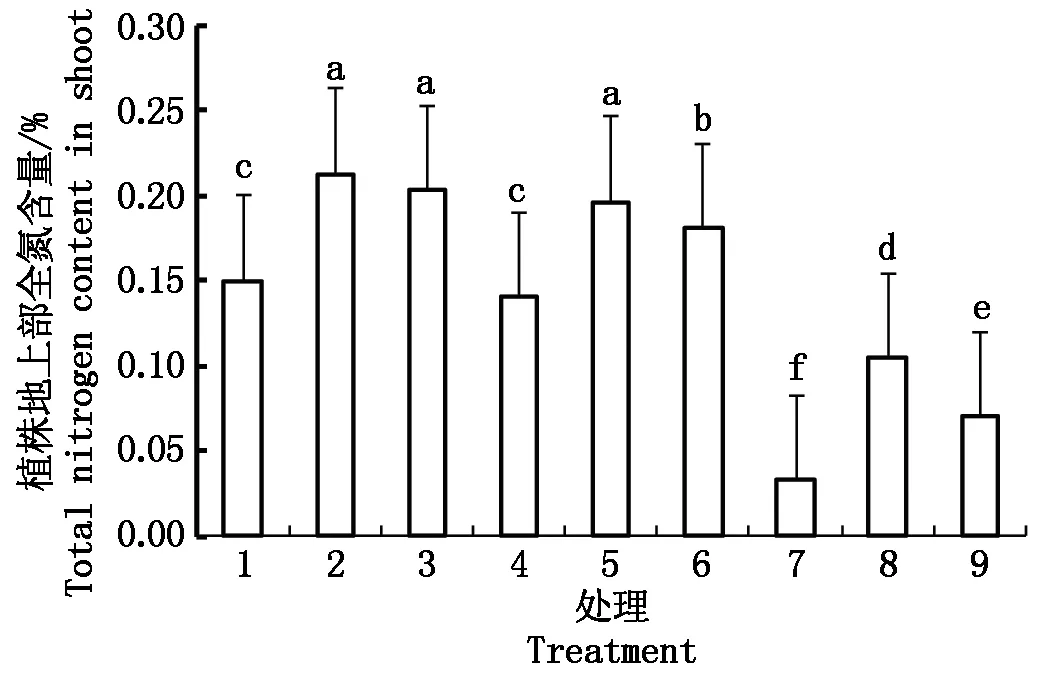
图中不同小写字母表示处理间差异达0.05显著水平。图3-5同。Different small letters in the figure mean significant difference among treatment at 0.05 level. The same as Fig.3-5.
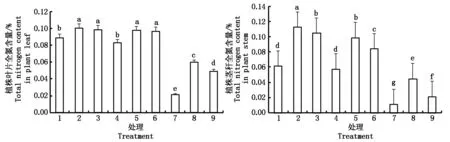
图3 局部根系水分胁迫下不同形态氮素营养对水稻幼苗叶片和茎秆氮素含量的影响Fig.3 Effects of N form on rice seedling leaf and stem nitrogen content under condition of PRD
2.2 水稻幼苗氮素吸收量
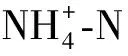
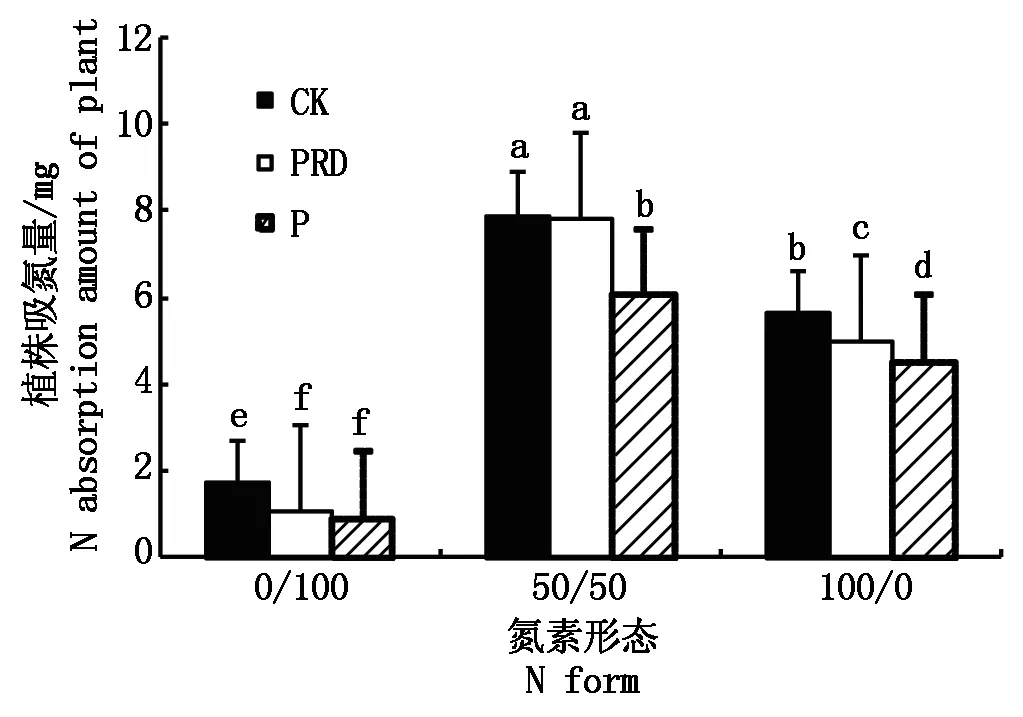
图4 局部根系水分胁迫下不同形态氮素营养对水稻氮素吸收量的影响Fig.4 Effects of N form on N absorption amount of rice under condition of PRD
从图5可以看出,氮素形态为50/50的处理,不同水分条件下均以吸收铵态氮为主,其中非水分胁迫条件下铵态氮的吸收量最大,为全根水分胁迫的1.5倍,局部水分胁迫条件的次之,两者的差异不显著。非水分胁迫下,铵态氮的吸收量为硝态氮的1.92倍,局部根系水分胁迫下,前者为后者的1.96倍。全根水分胁迫下铵态氮和硝态氮的吸收量差异最大,前者为后者的2.23倍。水稻对硝态氮的吸收在非水分胁迫和局部根系水分胁迫之间的差异不显著。
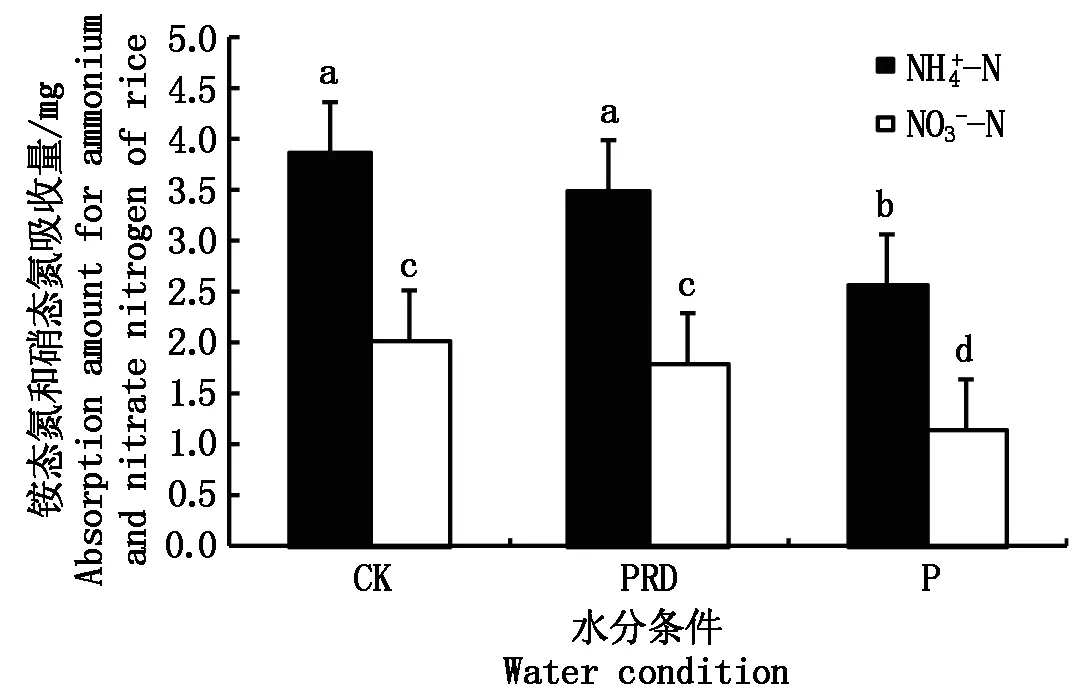
图5 不同水分条件下50/50氮素形态配比处理对水稻吸收铵态氮和硝态氮的影响Fig.5 Effects of N form of 50/50 on ammonium and nitrate nitrogen absorption of rice under different water condition
2.3 水稻幼苗生理特性
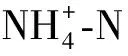
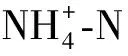
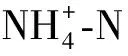
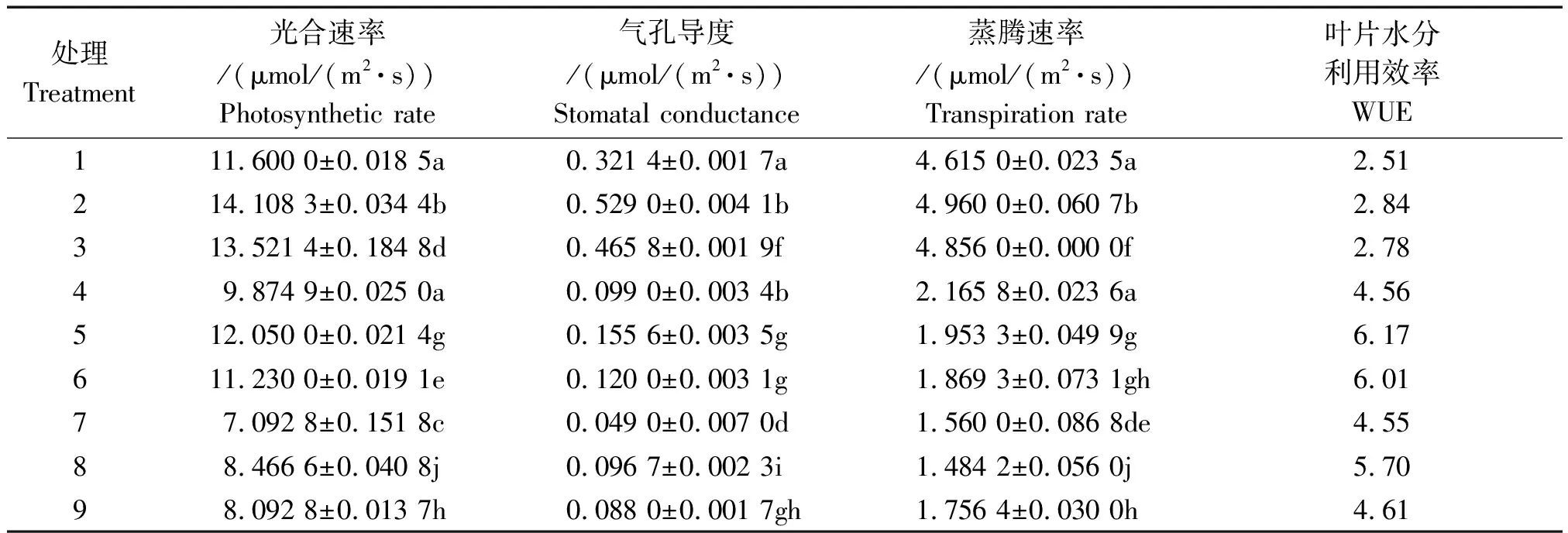
表2 局部根系水分胁迫下不同形态氮素营养对水稻幼苗生理特性的影响Tab.2 Effects of N form on rice seedling physiological functional properties under condition of PRD
注:表中不同小写字母代表各处理间差异达0.05显著水平。表3同。
Note: Different small letters indicates significant difference among treatments at 0.05 level. The same as Tab.3.
2.4 水稻根系形态
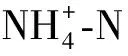
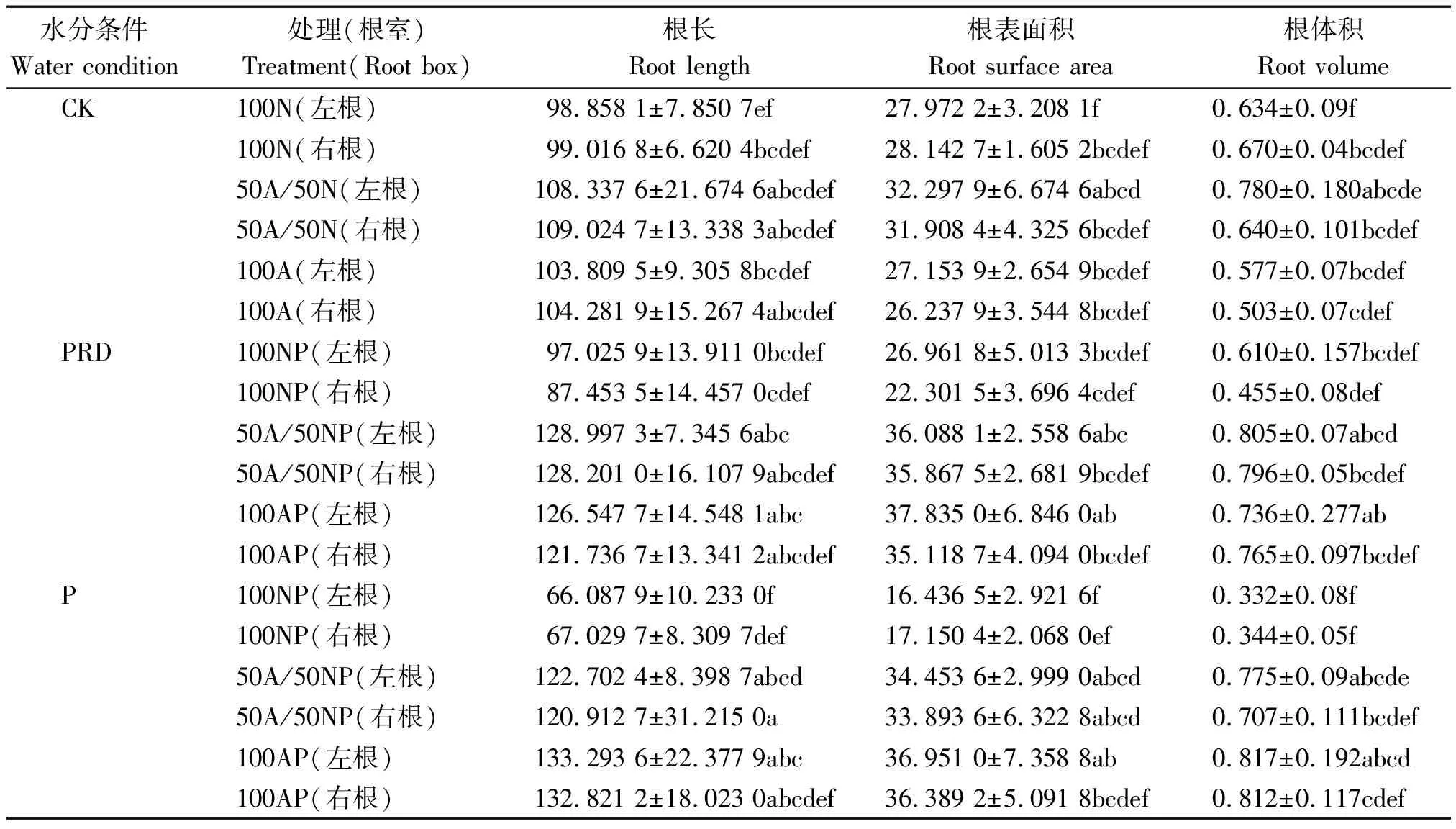
表3 局部根系水分胁迫下不同形态氮素营养对水稻根系形态的影响Tab.3 Effects of N form on rice seedling root morphology under condition of PRD
3 讨论与结论
3.1 局部根系水分胁迫下不同形态氮素营养对水稻幼苗氮素吸收和含氮量的影响
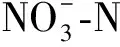
3.2 局部根系水分胁迫下不同形态氮素营养对水稻幼苗生理特性的影响