影响肝内胆管癌手术预后的危险因素Logistic回归分析
2019-04-29杨娟母齐鸣谭琴
杨娟,母齐鸣,谭琴
(航空工业三六三医院肝胆胰外科,四川 成都610041)
肝内胆管癌(intrahepatic cholangiocarcinoma,ICC)是发病率仅次于肝细胞癌的一种原发性肝癌,多由肝内胆管结石、胆管畸形、原发性硬化性胆管炎或肝炎病毒感染所致[1],但由于起病较为隐匿,通常缺乏胆道梗阻性黄疸与肝脏占位性功能衰竭等特异性表现。目前临床主张通过外科根治性手术完整切除肿瘤,在确保切缘阴性与剩余肝脏能代偿患者术后肝功能前提下拟定切除范围,患者术后3年生存率可达50%左右[2]。但由于ICC具有较强侵袭性,患者术后致死原因主要为肿瘤复发与远处转移,于术后24~32个月尤为高发[3],总体预后不佳,故早期明确ICC患者肿瘤复发、转移风险,可为手术切除范围及术后预防性治疗策略提供参考,在尽可能满足抗肿瘤疗效情况下也避免了过度治疗,有助于改善患者术后中远期生存质量。基于上述原因,本研究通过回顾性资料分析,旨在找出影响ICC患者术后预后的高危因素,现报告如下。
1 资料与方法
1.1 病例选择
128例ICC患者均为2011年1月至2015年12月期间于我院实施外科手术治疗的病例。根据术后3年内复发、转移情况分为预后不良组(n=60)与对照组(n=68)。纳入标准:①病理学检查与术中所见均符合ICC相关诊断标准[4];②年龄≤80岁;③采取胆管癌根治性切除术+肝叶切除术+胆道系统血管切除重建+区域淋巴结清扫术治疗;④术后3年内随访结局明确。排除标准:①诊断为肝细胞癌、远端胆管癌及其伴发的肝内转移癌;②术前已采取其他抗肿瘤治疗措施;③围术期因素或胃肠道并发症导致死亡;④手术前后未完善相关检查或临床资料不完整;⑤术前已合并其他部位恶性肿瘤。
1.2 方法
回顾统计范畴如下,①基线资料:通过病例资料获取年龄、性别、肝功能Child-Pugh分级[5],其中肝功能Child-Pugh分级通过对肝性脑病、腹腔积液、总胆红素、白蛋白及凝血酶原时间(PT)延长情况评价为1~3分,分数越高表示偏离正常水平越严重,合计总分进行评级,5~6分为A级,7~9分为B级,≥10分为C级;②手术处理:通过手术记录获取切缘快速冷冻病理检查结果、肝门阻断时间、有无行联合经导管动脉化疗栓塞(transcatheter arterial chemo embolization,TACE);③肿瘤病理资料:肿瘤直径、病灶数目、肿瘤分化程度、门静脉浸润、神经丛浸润、淋巴结转移、大体分型、Bismuth-Corlette肝门胆管癌分型[6],均通过手术切取的病灶组织病理学检测结果获取。其中Bismuth-Corlette肝门胆管癌分型以肿瘤位于左右肝管汇合处以下为Ⅰ级,以肿瘤仅累及汇合处为Ⅱ级,以肿瘤累及单侧次级胆管为Ⅲ级,以肿瘤累及双侧次级胆管为Ⅳ级;④生化指标:丙氨酸转氨酶(ALT)、甲胎蛋白、癌胚抗原、糖类抗原19-9(CA19-9),均为患者术前血常规检查获得静脉血样,充分凝血并离心后提取血清,采用与上述指标对应的酶联免疫吸附法(ELISA)试剂盒,严格按照说明书滴加试剂与操作酶标仪,计算待测样品相关指标浓度。
1.3 统计学处理
在Excel 2013中建立患者档案,资料处理采用SPSS 19.0统计软件,连续变量通过对比参考截断值转化为二分类变量,与常规分类变量均通过例数(百分率)形式描述;其中无序分类变量单因素比较采用χ2检验,有序分类变量单因素比较采用Mann-Whitney U检验;以单因素比较结果有统计学意义的指标为自变量,并进行赋值,纳入非条件Logistic二元回归模型进行筛选;无特殊说明均以α=0.05为检验水准,P<0.05为单因素比较有统计学意义或Logistic回归筛选为独立危险因素。
2 结果
2.1 基线资料比较
两组患者年龄、性别比较,差异均无统计学意义(均P>0.05),而预后不良组的肝功能Child-Pugh分级明显高于对照组(P<0.05)。见表1。

表1 两组患者基线资料单因素比较结果 例(%)
2.2 手术处理单因素比较
预后不良组的半肝切除率及联合TACE率均明显低于对照组(均P<0.05),而两组肝门阻断时间的差异无统计学意义(P>0.05)。见表2。

表2 两组患者手术处理单因素比较结果 例(%)
2.3 肿瘤病理单因素比较
预后不良组的肿瘤直径<5 cm的比例、病灶单发率、肿瘤高分化率、门静脉浸润阴性率、淋巴结转移阴性率、肿块型大体分型率、Bismuth-Corlette肝门胆管癌分型Ⅰ+Ⅱ型率均明显低于对照组(均P<0.05),而两组神经丛浸润率间的差异无统计学意义(P>0.05)。见表3。
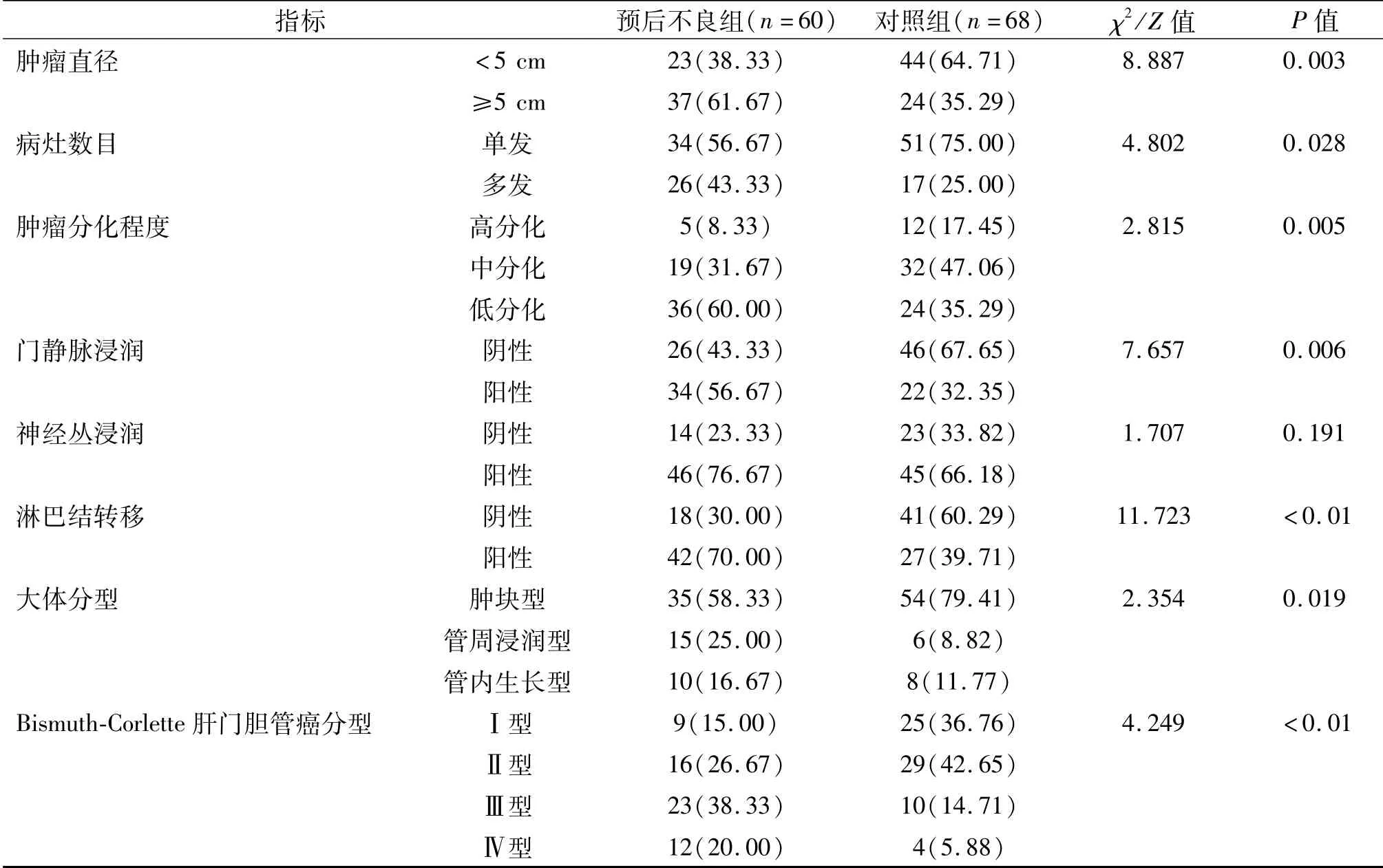
表3 两组患者肿瘤病理单因素比较结果 例(%)
2.4 生化指标单因素比较
两组ALT值的差异无统计学意义(P>0.05),而预后不良组甲胎蛋白、癌胚抗原、CA19-9均明显高于对照组(均P<0.05)。见表4。
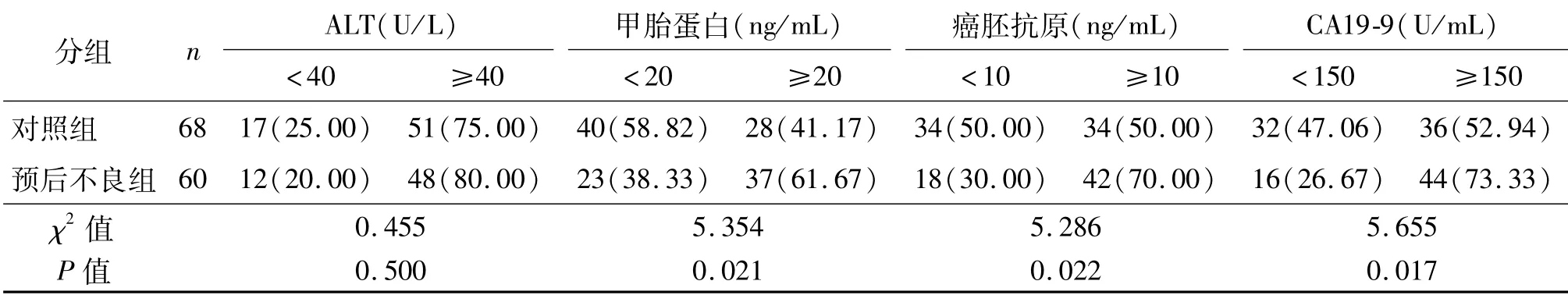
表4 两组患者生化指标单因素比较 例(%)
2.5 独立危险因素筛选
非条件Logistic二元回归模型显示,肿瘤直径≥5 cm、门静脉浸润阳性、淋巴结转移阳性、Bismuth-Corlette肝门胆管癌分型级别较高及CA19-9≥150 U/mL均是导致ICC患者术后预后不良的独立危险因素(均P<0.05)。见表5。
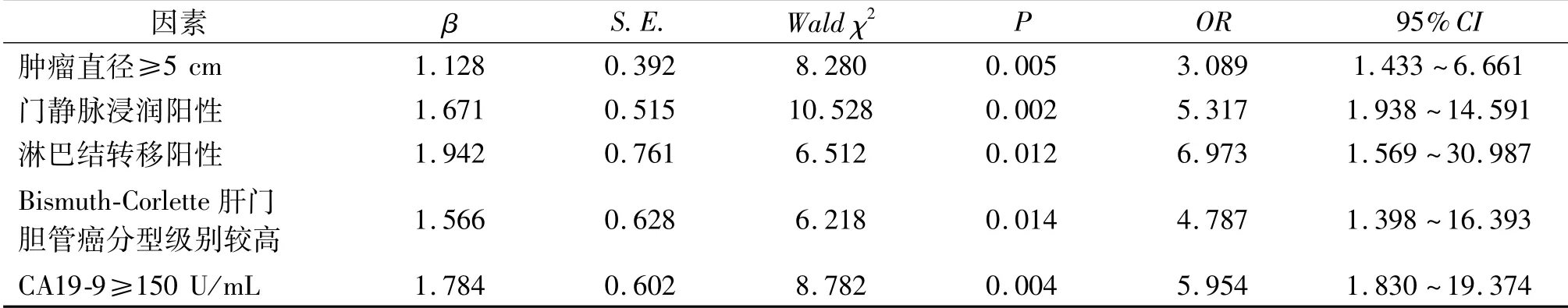
表5 非条件Logistic二元回归参数结果
3 讨论
既往临床就肿瘤直径对ICC患者预后的影响一直存在争议,部分研究显示肿瘤直径≥3 cm与<3 cm的ICC患者生存期无明显差异[7]。然而近期研究显示,肿瘤体积增大表明患者病程较长,肿瘤生长时间跨度较大,另一方面表示其组织学分化程度偏低,生长浸润更为迅速[8],二者综合作用下,肿瘤极容易发展至侵犯周围脂肪层与神经丛的规模,手术切除难度更大,一旦残留微小癌灶,成为术后复发与转移的潜在散播源。本研究中,肿瘤直径≥5 cm及Bismuth-Corlette肝门胆管癌分型级别较高均是ICC患者预后不良的独立危险因素。这表明针对体积较大或Bismuth-CorletteⅢ、Ⅳ型的ICC,尤其需重视病灶累及范围的检查,术中适当扩大肝切除区域,术后早期选择TACE或内镜下局部放疗辅助根治。相关研究显示,Bismuth-CorletteⅢ、Ⅳ型ICC需根据具体受累情况积极采取半肝切除术,对切除侧半肝予以血流阻断,对保留侧肝脏实施胆管引流,该术式具有较强可行性与临床应用价值[9]。
众所周知,淋巴结清扫不规范往往难以达到预期治疗效果,但清扫范围过广,并不会延长患者术后生存期[10],反而会加大术后并发症发生风险。尤其是腹主动脉旁淋巴结转移阳性ICC,多认为不可根治,生存质量不能改观,故需在术中配合快速冷冻组织病理学检查,以准确辨认切缘与淋巴结受累情况再选择适宜的手术操作。ICC突破胆管壁后向侧方浸润极易累及门静脉,为癌灶血道转移提供解剖条件[11],加之血管血供尤其丰富,术中出血量将极大增加,对术野清晰度与术式安全性产生负面影响,根治效果受到限制。本研究结果显示,门静脉浸润、淋巴结转移均是术后复发、转移的高危因素,提示临床应对肝十二指肠韧带淋巴结进行骨骼化清扫,必要时可扩大至腹腔干、肝总动脉与胰头后部的淋巴结区域,并重建受侵犯的血管。不同于胃癌、大肠癌等病灶,ICC周围区域淋巴结分布较少。有报道显示,转移淋巴结比例≥0.20的ICC患者中位生存期为24个月,显著高于转移淋巴结比例<0.20 ICC患者的13个月[12],因此转移淋巴结比例对门静脉周围胆管癌患者生存期有较高预测价值。
血清肿瘤标志物是目前临床常用辅助诊断指标,检测简便、敏感性强,对肿瘤确诊并减少不必要的侵入性探查有重要意义,也可辅助评估手术根治的可行性。CA19-9属于典型高分子链状糖蛋白抗原,能被单克隆抗体116NS19-9识别[13],多分布于正常人胰腺、胆管上皮细胞,癌变组织能激活黏蛋白表达基因,促使CA19-9糖脂化后游离进入组织液与外周血液。因此该指标对胆管癌、胰腺癌均有较高灵敏度,但缺乏特异性,在高胆红素血症、细菌性胆管炎、慢性肝炎、肝内胆管结石及其他恶性肿瘤中也会显著上升[14],临床仍需结合其他检查项目以获得全面的诊断信息。本组数据显示,CA19-9≥150 U/mL是ICC手术患者不良预后的独立危险因素,说明临床需重视ICC患者术前与随访血清肿瘤标志物检测特征,积极监测肿瘤进展程度,为临床预防其复发、转移提供指导证据。李辽等[15]认为,ICC瘤体CA19-9阳性率高于癌旁不典型增生组织与远端胆管组织,其表达异常往往伴随肿瘤细胞表面黏附力改变,更易于脱离原发部位产生浸润与转移,因此将其水平用于评估ICC癌灶恶性程度有较大潜力。
综上所述,ICC手术患者一旦出现肿瘤直径≥5 cm、门静脉浸润、淋巴结转移、Bismuth-Corlette肝门胆管癌分型级别较高及CA19-9≥150 U/mL等,提示存在肿瘤术后转移、复发的高风险,临床应针对性加强监测管理,尽可能早期采取预防措施以改善患者预后。
