待宰时间对小尾寒羊应激水平和羊肉品质的影响
2019-04-28王静璇韩振民罗海玲郭慧媛
王静璇 罗 洁 韩振民 张 昊,4 罗海玲 郭慧媛
(1.中国农业大学北京食品营养与人类健康高精尖创新中心, 北京 100083; 2.湖南农业大学食品科学技术学院, 长沙 410128;3.中国农业大学食品质量与安全北京实验室, 北京 100083; 4.中国农业大学畜产品北京市高等学校工程研究中心,北京 100083; 5.中国农业大学动物科学技术学院, 北京 100193)
0 引言
肉羊在运输过程中不可避免会遭受一些应激源,这将引起肉羊的不舒服并影响到羊肉品质[1]。运输应激能够显著提高β-脑内酚和肾上腺素类固醇的含量[2-3],也影响肌糖原代谢,引起羊肉pH值的升高,最终表现为“黑切羊肉”的出现[4]。因此,有必要在肉羊运输后、宰杀前留出一个适应时段,以尽可能减少应激水平,补充肌肉中糖原含量[5-6]。
在许多欧洲和北美国家,肉羊通常是在运输后的当天屠宰,而在其他国家如澳大利亚、新西兰和中国,肉羊更多的是在运输后的次日进行屠宰[7]。实际上,一些屠宰场为了提高现有空间的利用,正在考虑减少或者省略待宰这一环节,以求能有更多的产出量[8],但是这样是否危害到肉羊动物福利和肉的品质尚不清楚[9-10]。一些学者认为,待宰能够减少运输后肉羊体内皮质醇含量,恢复肌肉糖原浓度,减少动物组织的脱水作用,减少胴体的质量损失[11-12];另一些学者认为,待宰环境本身有碍于驯养动物休息或者从断水断粮的情况下恢复体能[13];有的学者观测到,长时间的待宰与胴体质量和肉的品质下降存在关联[14]。因此,需要从待宰时间对动物福利和肉品质的影响方面出发,对待宰时间进行进一步的探究。
本文通过研究不同待宰时间对5 h运输后小尾寒羊胴体指标、细胞学指标,血浆皮质醇质量浓度、肌酸激酶活性、乳酸脱氢酶活性、血浆葡萄糖浓度以及羊肉pH值、温度、保水性、剪切力、肌糖原含量等指标的影响,以期确定宰前适宜的待宰时间,降低小尾寒羊应激水平并提高羊肉的品质。
1 材料与方法
1.1 材料与试剂
氯化钙、氢氧化钠、碘化钾、碘、高氯酸均为分析纯,北京化学试剂公司;动物糖原,纯度大于85%,美国Sigma公司。
1.2 仪器与设备
AY220型电子天平,日本SHIMADZU公司;TP3001型针式温度计,北京世纪晨曦科技有限公司;Warner-Bratzler型WBS剪切仪,美国G-Rmanufacturing公司;UV-2102型紫外可见分光光度计,上海优尼柯仪器有限公司;DZQ400-2D型真空包装机,上海鼎利轻工机械制造有限公司;WSC-S型色差计,上海精密实验设备有限公司;Hanna99163型便携式pH计,意大利Hanna科学仪器公司;SysmexFS00型血细胞分析仪,日本TOA医用电子公司;3K3O型低温高速离心机,德国Satorios公司;TMS-1024i型全自动生化仪,日本TOKYO BOEKI公司。
1.3 研究方法
1.3.1实验设计
实验在北京市房山区的北京卓宸清真牛羊肉食品公司进行,气温为20℃左右。实验肉羊选取内蒙古地区同一养殖场(相同饲养环境和饲喂模式)的小尾寒羊72只(同为18月龄),体质量为(40±1.8) kg,并分别对其进行编号。实验当天肉羊运输前不禁食,将称量活体质量后的肉羊装载上两辆相同规格的运输货车,这一过程由小尾寒羊熟悉的饲养员进行,并在整个过程中保持操作柔和,减少肉羊的应激反应。运输的车辆长、宽、高分别为7.2、2.4、2.0 m,平均每只羊的占用面积为0.9 m2。从养殖场到屠宰场经历5 h的公路运输,两辆货车由经验丰富的驾驶员驾驶并同时出发到达,时速大约80 km/h,运输过程中对肉羊禁食禁水。
到达养殖场后,卸载过程不采用斜坡,车厢高度与卸载台面等高,卸载完成后将肉羊随机分为6组:L0,待宰时间为0 h;L3,待宰时间为3 h;L6,待宰时间为6 h;L12,待宰时间为12 h;L18,待宰时间为18 h;L24,待宰时间为24 h。每组12只,分别在规格和环境相同的待宰圈待宰(0 h待宰组除外),待宰圈平均每只肉羊占用面积0.8 m2。待宰圈温度20℃左右,保持适宜的光照并控制噪声,待宰期间提供饮水但禁食。
待宰后、屠宰前对各组肉羊称量屠宰体质量,而后进入标准屠宰流程,经过放血、去头蹄、剥皮、摘除内脏、冲淋等工艺后,对胴体进行热胴体质量的称量。随后进入4℃冷却间进行24 h的冷却,冷却结束后再称量其冷却胴体质量。
1.3.2胴体指标的测定
通过待宰与屠宰过程中各环节称量的肉羊质量,计算以下胴体指标:
体质量损失计算公式为
W=L-S
肉羊的屠宰率计算公式为
D=C/L×100%
式中L——活体质量
S——屠宰体质量
C——冷却胴体质量
1.3.3血液指标的测定
血液样品的采集在肉羊放血时进行,分别用加抗凝剂EDTA-K2(乙二胺四乙酸二钾)的试管和不加抗凝剂的试管采集两种血液样品,其中加抗凝剂的血液样品保存在4℃冰箱中,测定血液成分。红细胞压积(PCV)用标准毛细管微血球容量计的方法进行测定;红细胞计数(RBC)和血红蛋白质量浓度(HGB)用血液分析仪测定;嗜中性淋巴细胞比率以瑞氏染色血涂片的方法测定。
不加抗凝剂的样品2 h内在4℃下3 500g离心15 min分离血浆并在-80℃冷冻保存,用于随后血液生化指标的测定。血浆中皮质醇(COR)质量浓度用ELISA试剂盒测定;肌酸激酶(CK)活性、乳酸脱氢酶(LDH)活性、血浆葡萄糖(GLU)浓度用全自动生化仪测定。
1.3.4肉质指标的测定方法
(1)胴体温度
每组肉羊胴体分别在屠宰后的45 min以及1.5、3、6、12、24 h时间点测定胴体温度。针式温度计探头插入羊左侧胴体第13肋骨,背最长肌深2 cm处测定,每只重复测定3次,取其平均值。
(2)胴体pH值
pH值的测定采用带有刀头的便携式pH计进行,在每次测定pH值时在室温(20℃)下对pH计进行校准。每组肉羊胴体在屠宰后的45 min以及1.5、3、6、12、24 h分别在羊左侧胴体第13肋骨处测定其pH值,探头在羊背最长肌深2 cm处测定,每处重复测定3次,取其平均值。
(3)羊肉保水性
肉的保水性通常采用滴水损失率和蒸煮损失率来表征,测定方法根据Honikel经典方法进行。
①滴水损失率:取胴体冷却24 h后的背最长肌,去除脂肪和筋腱,切成2 cm厚的肉样,修成长3 cm、宽2 cm的长条,并称其质量W1后,用铁丝钩住肉块的一端,悬挂于聚乙稀的塑料袋中(肉样不得与塑料袋壁接触),扎紧袋口后悬挂于4℃冷库中。24 h后取出并用滤纸擦去肉样表面的汁液,再次称其质量W2。利用两次称量的差值计算肉的滴水损失率,每只胴体做3个平行。滴水损失率计算公式为(W1-W2)/W1×100%。
②蒸煮损失率:取羊胴体冷却24 h后的背最长肌,去除脂肪和筋腱,切成2.5 cm×2 cm×2 cm肉样,精确称其质量W3;将肉样密封并真空包装,在80℃水浴锅中加热到肉样中心温度75℃,水浴后的肉样连同袋子于4℃冷却30 min,打开真空袋并用滤纸吸干肉表面的水分,再次称量肉样的质量W4,利用两次称量的质量差计算肉的蒸煮损失率,每只胴体做3个平行。蒸煮损失率计算公式为(W3-W4)/W3×100%。
(4)剪切力
剪切力测定使用背最长肌,取冷却24 h的肉样,去除脂肪和筋腱,切成5 cm×3 cm×4 cm肉样,抽真空包装并在80℃水浴锅中加热到肉样中心温度75℃,水浴后的肉样袋在常温下冷却至室温,然后打开真空袋并用滤纸吸干肉表面的水分,沿着肌纤维方向,切成1 cm×1 cm×3 cm的方块,用WBS型剪切仪测定肉柱的剪切力,每头胴体做6个平行,取平均值。
(5)肌肉中糖原含量
羊肉中糖原含量的测定采用DREILING等[15]的碘盐显色法进行。取2 g背最长肌肉样切碎,加入8.5%的冰浴高氯酸并匀浆,4℃、15 000g离心10 min,过滤并取上清液为提取液。碘显色剂的配制:将0.26 g碘和2.6 g碘化钾溶于10 mL超纯水中作为A液,100 mL饱和氯化钙为B液,将1.3 mL的A液与B液混合即为碘显色剂。取糖原标样配制成一定浓度梯度,取每个浓度标样或稀释后的肉样提取液0.4 mL加入到2.6 mL碘盐显色液中并混匀,放置30 min后460 nm比色,以糖原浓度为横坐标,在波长460 nm吸光度作为纵坐标绘制标准曲线,根据标准曲线和样品稀释倍数计算样品糖原含量。
1.3.5数据分析
实验数据采用SPSS 21.0统计软件分析差异显著性,各表中数值表示为平均值±标准差,不同处理组之间的差异采用ANOVA方差分析,以P<0.05作为差异显著性判断标准。
2 结果与分析
2.1 胴体指标
本实验不同待宰组选用的小尾寒羊运输前质量L与宰杀体质量S没有显著性差异(P>0.05),但体质量损失W却随待宰时间的延长而增加。如表1所示,待宰24 h组体质量损失最大,为1.71 kg,12 h和18 h次之,分别损失1.36 kg和1.39 kg。0、3、6 h待宰组体质量损失较少,大约在1 kg左右。此外,屠宰率D、热胴体质量H和冷却胴体质量C随待宰时间的延长大体呈减小趋势,说明过长时间的待宰会造成羊胴体损失的增加。EKIZ等[16]将这一变化归结于待宰期间的禁食。因此在实际生产过程中,24 h的禁食待宰会对小尾寒羊的体质量损失、热胴体质量和冷却胴体质量产生负面影响。

表1 待宰时间对胴体指标的影响Tab.1 Effects of lairage time on body weight and weight loss of sheep
注:同行中不同字母表示差异显著(P<0.05),下同。
2.2 细胞学指标
动物受刺激后,儿茶酚胺升高或交感神经活动引起脾脏收缩,导致红细胞从脾脏释放到血液中,促使红细胞压积(PCV)、血红蛋白质量浓度(HGB)以及红细胞计数(RBC)升高。从表2可知,不待宰与待宰3、6、12 h组肉羊的血液PCV、HGB以及RBC含量无显著性差异(P>0.05)。但待宰24 h组的肉羊血液PCV、HGB以及RBC值明显高于其他几组,这表明长时间的禁食待宰能够引起血液红细胞浓度的升高。在TADICH等[2]的研究中,PCV值也出现升高的现象,这可能与肉羊长时间未饮水而造成的脱水作用有关。
动物对应激的反应在血液中的体现还包括中性粒细胞的增加和淋巴细胞的下降。由表2可以看出,运输结束后(即0 h待宰组)嗜中性淋巴细胞比率是1.13,而后待宰能够显著降低嗜中性淋巴细胞比率(P<0.05),最低值0.54出现在待宰12 h,但是随着待宰时间的延长,从待宰12 h到24 h嗜中性淋巴细胞比率呈上升趋势,在待宰24 h后比值恢复到运输结束后水平。过长时间的待宰(24 h)能够给肉羊带来新的应激,这种应激的来源可能是长时间待宰禁食,肉羊饥饿引起的焦虑。

表2 待宰时间对血液细胞学指标的影响Tab.2 Effects of lairage time on haematological parameters
2.3 血液指标
肉羊受到刺激后,交感-肾上腺髓质系统即刻兴奋并释放儿茶酚胺类激素,进而引起机体循环和代谢的相应变化。应激状态下,动物内分泌功能发生改变,其中血浆皮质醇(COR)水平的变化最为明显[17]。如图1(图中不同字母表示差异显著,下同)所示,待宰0 h,即运输刚结束时,小尾寒羊中血浆COR质量浓度在各组中最高,为52.43 ng/mL,说明5 h的运输已对肉羊产生应激。待宰3 h与0 h肉羊的COR质量浓度无显著性差异(P>0.05),说明待宰3 h不足以让肉羊得到恢复,而待宰时间为6、12、18 h均能使小尾寒羊的血浆COR质量浓度显著降低(P<0.05),12 h时降低至(39.98±5.04)ng/mL。待宰24 h,肉羊的COR质量浓度又显著升高(P<0.05),说明长时间的禁食会对小尾寒羊产生新的应激。
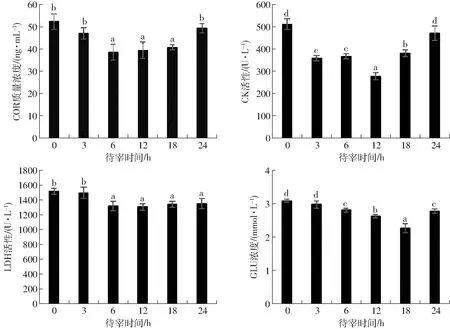
图1 待宰时间对羊血液指标的影响Fig.1 Effect of lairage time on blood parameters
肌酸激酶(CK)和乳酸脱氢酶(LDH)一般存在于细胞内,当生物体剧烈运动、肌肉损伤或受到应激时,细胞破裂,血液中CK和LDH含量增加[18]。本实验中,待宰0 h小尾寒羊血浆CK和LDH活性在各组中最高,分别达到503.33 U/L和1 528.5 U/L。待宰3、6、12、18 h组血浆CK活性比0 h和24 h组显著降低(P<0.05),12 h时降低至(277.64±19.88)U/L,6、12、18、24 h待宰组血浆LDH活性比0、3 h组显著降低(P<0.05)。根据KNOWLES等[19]的解释,这样的结果是由小尾寒羊在装车、运输、卸车过程中,人为或动物之间挤擦引起的机体创伤造成的,因此建议在肉羊运输前后要注意人工操作的柔和,避免对羊产生肌体损伤。
血糖含量的升高主要是因为动物在应激后,儿茶酚胺和糖皮质激素被释放,肝糖元分解加速引起的[20]。本研究中,0 h待宰组血糖(血浆葡萄糖)浓度为3.081 mmol/L,与待宰3 h一样显著高于其他几组(P<0.05),待宰6 h组血糖浓度仍然维持在较高的水平,在待宰12 h后小尾寒羊血糖浓度才显著下降(P<0.05),待宰18 h后,血糖浓度达到最低值2.259 mmol/L;但待宰24 h组肉羊血糖浓度又有所上升。综上所述,一定的待宰时间(6、18 h)能够让肉羊从之前的应激中得到休息,但是长时间的禁食待宰(18、24 h)可对肉羊造成新的应激。
2.4 羊肉品质
2.4.1羊胴体温度和pH值
pH值是反映宰后肉品质的重要指标。活体动物的肌肉pH值在7.0左右,宰杀之后,由于缺氧条件下的糖酵解,肌肉pH值会有所下降,因此,羊肉的最终pH值取决于宰前肉羊肌糖原的浓度。由图2可知,待宰时间对羊肉最终pH值的影响显著(P<0.05),最高值出现在0 h待宰组,最低pH值出现在待宰18 h组,其中0~12 h待宰组之间的pH值以及12 h和24 h待宰组之间的pH值并无显著性差异(P>0.05)。DEVINE等[21]报道,pH值影响肌肉中内源性蛋白酶活性,进而对肌肉的保水性、嫩度等有很大的影响。在本研究中,待宰时间为12~18 h能够显著降低羊肉的pH值,12 h时降低至5.57±0.14,而过长时间的待宰反而使pH值进一步提高,对肉的品质产生不利影响。
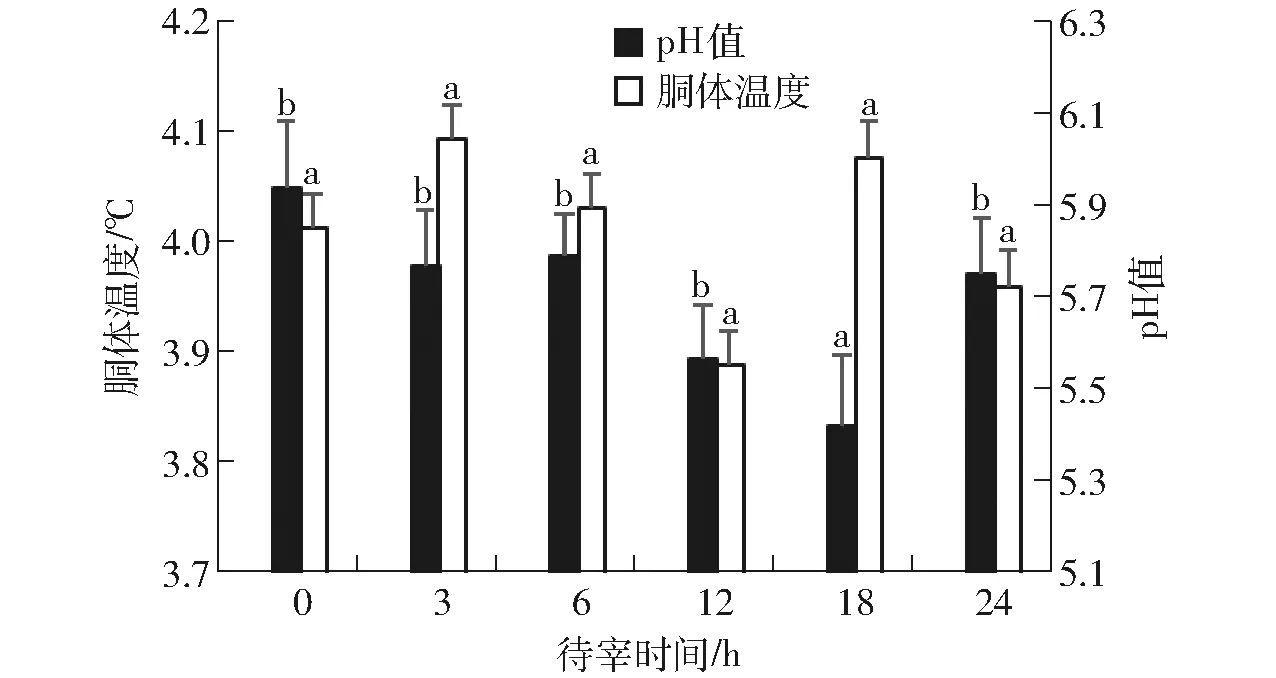
图2 待宰时间对羊胴体温度和pH值的影响Fig.2 Effect of lairage time on carcass temperature and pH value
2.4.2羊肉保水性
肉的保水性常用滴水损失率和蒸煮损失率进行评价,待宰时间对羊肉蒸煮损失率的影响不显著(P>0.05),但对滴水损失率的影响显著。由图3可知,随着待宰时间的延长,羊肉的滴水损失率不断增加,待宰12 h和18 h组滴水损失率达到最大,但待宰24 h羊肉的滴水损失率减小,与待宰0、3 h之间无显著性差异(P<0.05)。有研究表明,最终pH值与肉的保水性有直接联系,高pH值往往伴随着高保水性[16]。待宰0 h和24 h组有较高的最终pH值,相应的滴水损失率也低。LISTE等[22]观察到与不经待宰的羔羊相比,待宰12 h的羔羊肉有较低的保水性,与本实验结果相似,待宰18 h之内对羊肉的保水性是不利的。
2.4.3羊肉剪切力及肌糖原含量
剪切力不仅是反映肌肉嫩度的指标,更是决定消费者对肉接受性的关键指标[23]。在本研究中,随着待宰时间的延长,羊肉剪切力呈现先下降后升高的趋势。与不待宰的羊肉相比,待宰6、12、18 h的羊肉剪切力显著降低,分别为4.62、4.54、4.97 kg/cm2,平均下降了30.01%。但随着待宰时间延长至24 h后,剪切力又呈现上升的趋势。

图3 待宰时间对羊肉滴水损失率和羊肉蒸煮损失率的影响Fig.3 Effect of lairage time on meat drip loss and meat cooking loss
出现这样趋势的可能原因是,过长时间的待宰大量消耗肉羊肌肉内的糖原,导致其最终pH值较高,BOEHM等[24]报道,当pH值在5.8~6.3范围内时,肌肉中内源性蛋白酶活性仅是最高活性的30%。降低了对肌纤维蛋白的降解效率,导致羊肉不能得到有效的嫩化,剪切力偏高。图4是宰后45 min时肌肉中糖原的含量,待宰0 h肌肉中糖原含量最低,相对应的羊肉具有最大的剪切力,而糖原含量最高的12 h待宰组((7.74±0.98)mg/g)羊肉的剪切力最低,说明待宰12 h能够让小尾寒羊从运输的应激时大量的肌糖原消耗后得到补充,阻止pH值的升高而产生嫩度较差的羊肉。
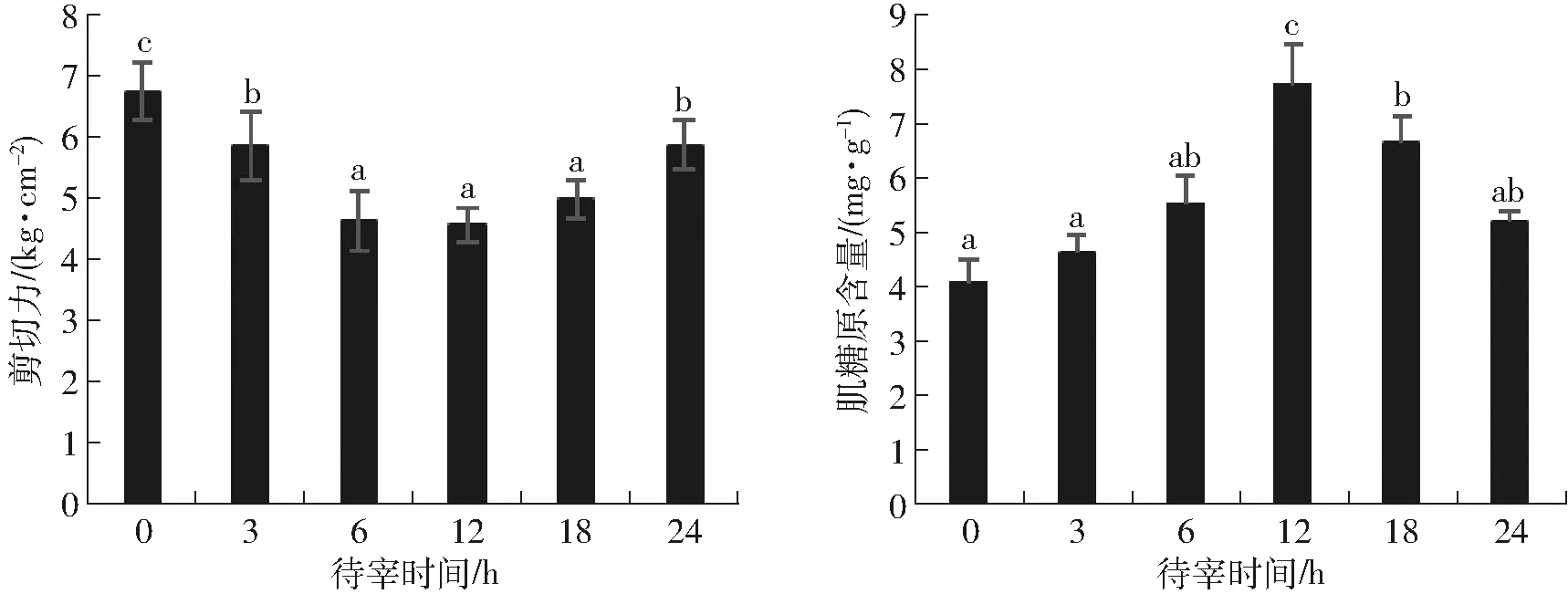
图4 待宰时间对羊肉剪切力和宰后45 min时肌肉糖原含量(质量比)的影响Fig.4 Effect of lairage time on WB shear force and glycogen content after 45 min of slaughter
3 结论
(1)总体来说,禁食待宰对小尾寒羊的胴体指标是不利的,随着待宰时间的加长,肉羊的体质量损失显著升高(P<0.05)。
(2)待宰6~12 h能够使小尾寒羊从宰前运输等造成的应激中得到缓解,降低血红蛋白浓度、嗜中性粒细胞与淋巴细胞比值、血浆皮质醇质量浓度、血糖浓度以及血浆肌酸激酶的活性,极大提高了小尾寒羊的动物福利。待宰时间继续延长,当达到24 h后又会对小尾寒羊产生新的应激。
(3)在羊肉品质方面,12~18 h的待宰时间能够提高肌糖原含量,降低羊肉最终pH值,提高羊肉的嫩度。
(4)综合应激、胴体和羊肉品质指标,待宰12 h能够在保证小尾寒羊最低的体质量损失和正常水平的屠宰率的情况下,让肉羊从应激中得到缓解,提高羊肉品质。
