申克孢子丝菌酵母相形成过程中转录组表达谱变化及差异表达基因功能分析
2019-04-28韩昌旭侯彬彬晋亮张振颖
韩昌旭 侯彬彬 晋亮 张振颖
1香港大学深圳医院皮肤科 518000;2大连医科大学附属第二医院皮肤科 116000;3空军特色医学中心皮肤科,北京 100142
孢子丝菌病是由申克孢子丝菌及其复合体引起的皮肤、皮下组织及附近淋巴管的慢性感染性疾病,是最常见的皮肤深部真菌病。孢子丝菌属于双相性病原真菌,自然环境中呈腐生状态生长,无致病性,入侵宿主后其生存环境发生骤变,菌体为适应变化的环境发生形态转换,呈寄生状态生长并致病[1]。深入探究孢子丝菌感染宿主的过程对选择新的药物作用靶点和研发新的抗真菌药物至关重要。转录组学是研究特定的细胞或组织在特定的功能状态下基因组产生的全部转录物的种类、结构和功能,可以揭示生物学进程或疾病发生的分子机制。探究孢子丝菌致病的酵母相形成过程中转录组学的变化将有助于阐明孢子丝菌致病性形成的分子机制,开发新的抗真菌药物作用靶位。本研究通过RNA-seq高通量测序方法,对孢子丝菌菌丝及酵母相细胞的两个逆转录文库进行测序分析,组装获得筛选后的单基因簇(unigene),再基于基因在不同样品中的表达量识别差异表达基因,对其进行模式聚类、功能注释以及富集性分析来进行功能预测。
材料与方法
一、申克孢子丝菌菌株及培养
申克孢子丝菌标准菌株ATCC10268为大连医科大学真菌中心保存菌株,用沙氏液体培养基(SDA)在25℃振荡(100 r/min)培养96 h获得菌丝相菌体,转种于脑心浸液(BHI)液体培养基,37℃振荡(100 r/min)培养36 h获得酵母相菌体。4℃下3 000×g离心5 min,弃上清液收集菌体,部分用于制片、镜检,其他在-80℃冻存备用。
二、总RNA提取
分别取孢子丝菌菌丝相和酵母相200 mg,液氮研磨,采用植物总RNA提取试剂盒(美国Promega公司),按照说明书提取总RNA。紫外分光光度计测定吸光度A260和A280,计算RNA纯度和浓度。
三、mRNA富集纯化
以带有Oligo(dT)的磁珠(美国Thermo Fisher科技公司)富集真核生物mRNA,按照mRNA纯化试剂盒的操作说明书进行,使用生物素-磁珠法从总RNA中富集纯化mRNA,紫外分光光度计测定A260和A280,计算RNA纯度和浓度。
四、链特异性文库构建
加入碎片化缓冲液将mRNA打断成短片段,以mRNA为模板,用六碱基随机引物合成一链cDNA,加入缓冲液、dNTPs和DNA聚合酶I和RNase H合成二链cDNA,随后利用AMPure XP磁珠纯化双链cDNA。对纯化的双链cDNA先进行末端修复、加A尾并连接测序接头,再用AMPure XP beads进行片段大小选择。之后用USER酶降解含有碱基U的cDNA第二链,使最终的测序信息都来自于第一链cDNA,从而保留mRNA的链方向性。最后进行PCR(美国Bio-Rad生命医学产品有限公司)扩增,并用AMPure XP beads纯化PCR产物,得到链特异性cDNA文库。
使用Qubit3.0进行初步定量,稀释文库至1mg/L,随后使用Agilent 2100检测文库插入片段的大小,符合预期后,使用Q-PCR方法对文库的浓度进行准确定量(文库有效浓度>2 nmol/L),以保证文库质量。库检合格后,把不同文库按照有效浓度及目标下机数据量的需求分组后进行HiSeq测序。共取3个样本,每个样本选取3个生物学重复的RNA样品混合后进行RNA-Seq转录组测序,取所有样本检测的平均值。
五、数据分析
将下机数据进行过滤得到有效数据(clean reads),将短reads进行拼接组装获取较长的unigene序列集。将clean reads与组装获取的unigene序列进行比对,得到Mapped Data,进行插入片段长度检验、随机性检验等文库质量评估;根据基因在不同样品或不同样品组中的表达量进行差异表达分析,对筛选后的基因(unigene)进行功能注释,包括与数据库(NR、Swiss-Prot、KEGG、COG、KOG、GO、Pfam)的比对,同时还进行编码区序列(CDS)预测及基因在每个样品中的表达量分析。最后,应用功能软件对差异表达基因进行模式聚类、功能注释以及富集性分析。
结果
一、测序质量评估
1.测序reads评估:评估显示原始序列中含有带接头的、低质量的reads。菌丝相菌体clean reads达到97.72%,酵母相菌体达到97.88%(图1),获得14.76 Gb有效数据(clean Data),各样品有效数据均达到7.36 Gb,Q30碱基占比(碱基质量值≥30)≥94.85%,即14.76 Gb的有效数据中94.85%的碱基正确率为99.9%。将各样品的clean reads进行组装,获得43 863条unigene,其中17 667条长度在1 kb以上。基于unigene库进行基因结构分析,共获得11 783条简单重复序列标记。
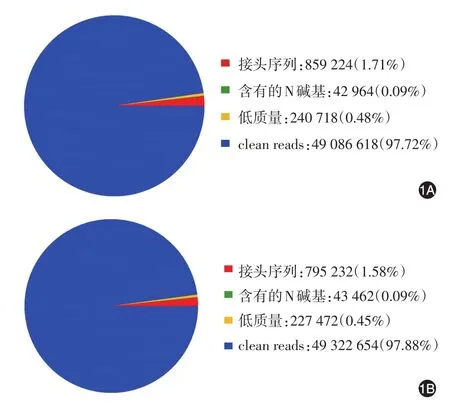
图1 申克孢子丝菌测序reads评估1A:菌丝相菌株;1B:酵母相菌株
2.测序饱和度分析:使用各样品的Mapped Reads对检测到的基因数目的饱和情况进行模拟,绘制曲线图(图2),各曲线越往右延伸,斜率越小,逐渐趋于平坦,提示各样品随着测序数据量的增加,新检测到的基因越来越少,趋于饱和,有效测序数据量充足。
3.测序随机性评价:本研究中转录组建库为链特异性建库,出现了GC分离的现象,且整个测序过程基本稳定不变,呈水平线。见图3。
4.比对分析:将各样品的有效数据与组装得到的转录子或unigene库进行序列比对,菌丝相与早期酵母相的clean reads分别为49 086 618、49 322 654,mapped reads(比对到Transcript或unigene的Reads)分别为46 356 350、46 833 812,匹配率分别为94.44%、94.95%。将Mapped Reads用于后续的分析。
二、差异表达基因分析
1.酵母相差异表达基因数量分析:以差异倍数≥2或≤1/2且错误率<0.01作为标准筛选差异表达基因。与菌丝相相比,酵母相10 969条基因表达上调,199条下调,29 163条未见改变。见图4。
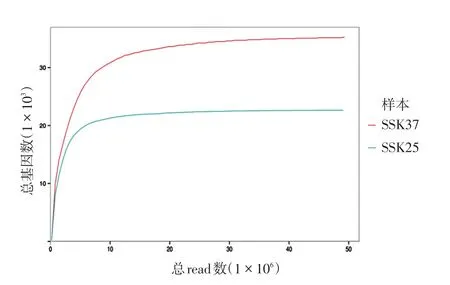
图2 转录组测序数据饱和度模拟图
图3 申克孢子丝菌菌丝相(3A)和酵母相(3B)菌体碱基含量分布图
2.差异表达基因的GO功能注释:差异基因GO富集柱状图显示,差异基因主要参与信号传导、细胞组分生物代谢等过程。挑选富集最显著的30条GO词条,其中29条与生物过程相关,1条与分子功能相关,见图5。
3.差异表达基因的通路分析:对差异表达基因KEGG的注释结果按照KEGG中通路类型进行分类,结果显示,差异表达基因参与蛋白磷酸化、细胞内蛋白转运、细胞蛋白修饰、小GTP酶介导的信号转导、囊泡介导转运、翻译、细胞内信号转导、微管形成、ATP合成偶联质子转运等过程(图6)。参与真菌形态形成的两个重要信号转导通路MAPK及双组分信号通路中的16条基因和参与几丁质合成代谢的16条基因均被证实在早期酵母相上调表达。表1列举了在酵母相中表达上调的3条参与MAPK信号转导通路的基因、3条双组分信号传导通路的基因和4条几丁质合成代谢的基因。
讨论
对孢子丝菌双相转换过程进行深入研究不仅有助于深刻理解孢子丝菌病的发病机制,还有助于研发新型的抗真菌药物。迄今,孢子丝菌的基因组序列尚未被完全公布及注释,转录组学研究可作为基因组学研究的一种有利补充。
在温度诱导下由菌丝相向酵母相发生形态转换的过程被认为是孢子丝菌毒力基因表达及致病性形成的过程[2]。虽然Pho85[3]、蛋白激酶C[4]、脑苷脂[5]被认为是与孢子丝菌形态转换有关的毒力分子,但启动其双相转换的具体机制尚不明确。我们先前研究证实,菌丝相孢子丝菌在BHI液体培养基培养36 h即出现酵母相的部分形态特征[6],故本研究中我们比较菌丝相和早期酵母相转录组图谱的差异,以期明确孢子丝菌双相转换过程的启动机制。
本研究表明,与菌丝相比较,酵母相上调表达的基因多达10 969条,下调表达的基因仅为199条。进一步对差异基因进行模式聚类、功能注释以及富集性分析,表明上述基因参与蛋白磷酸化、细胞内蛋白转运、细胞蛋白修饰、小GTP酶介导的信号转导、囊泡介导转运、翻译、细胞内信号转导、微管形成、ATP合成偶联质子转运等诸多过程,提示孢子丝菌形态转换过程涉及的机制十分复杂。
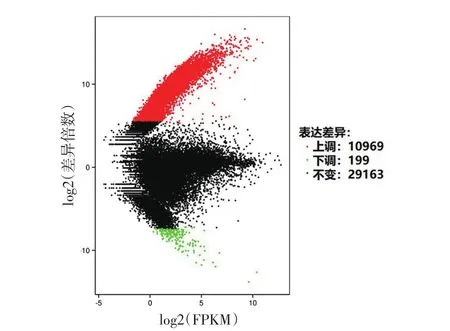
图4 酵母相和菌丝相申克孢子丝基因差异表达图FPKM:fragments per kilobase of exon per million reads mapped,每千个碱基转录每百万映射读取的片段
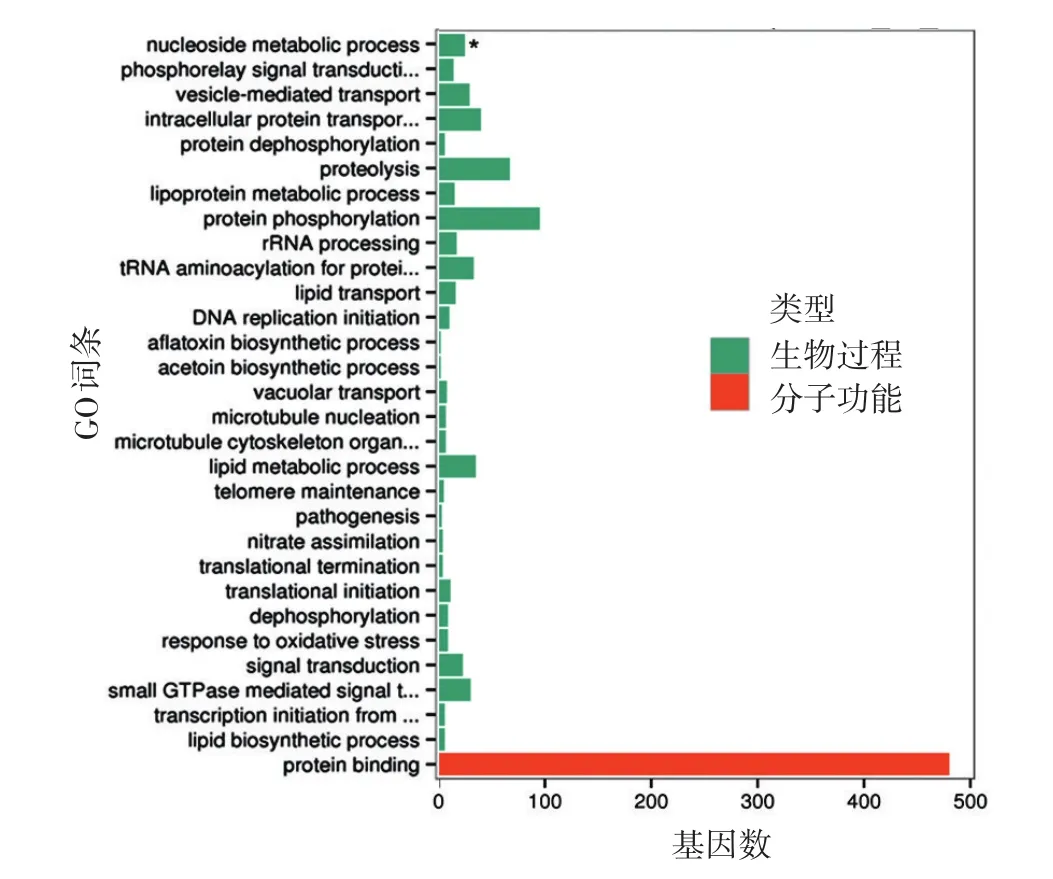
图5 酵母相和菌丝相申克孢子丝菌差异表达基因GO富集柱状图
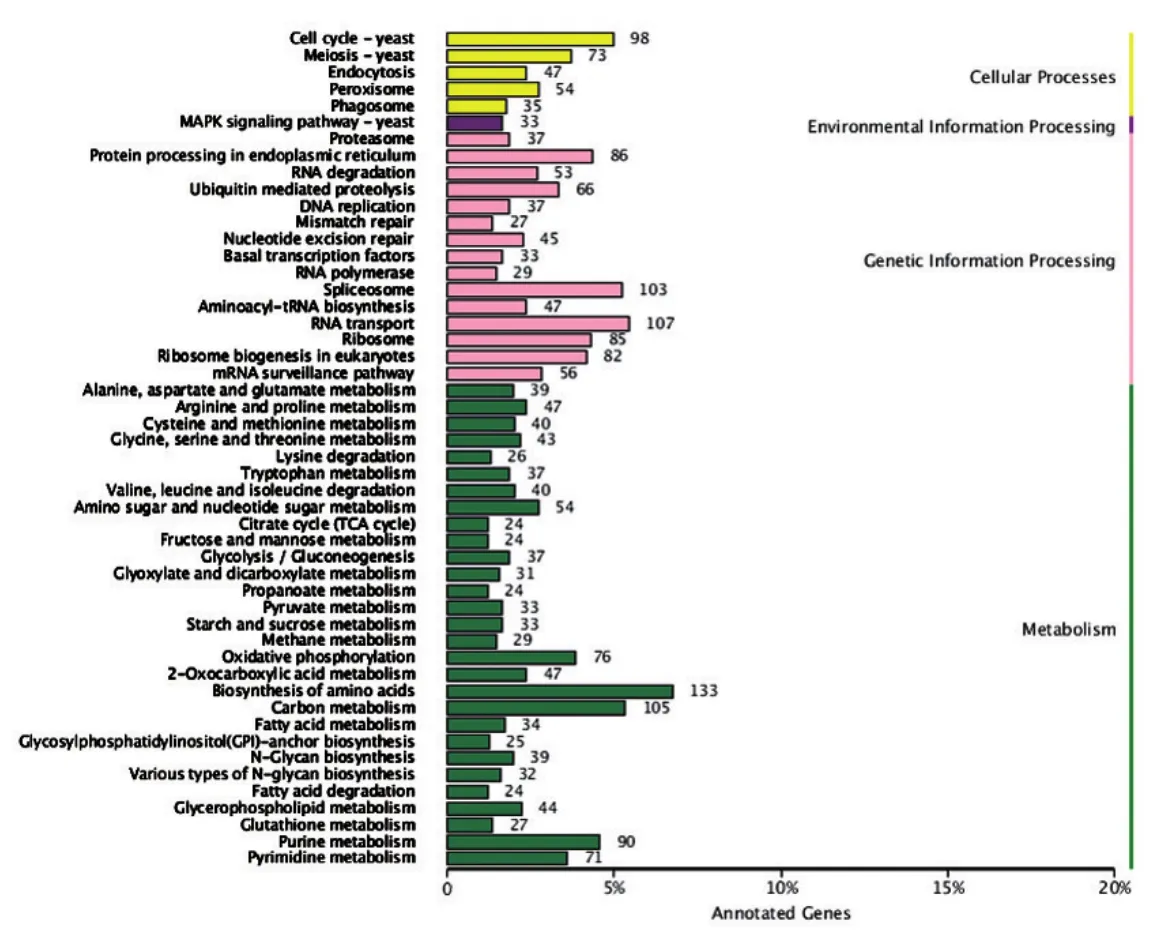
图6 酵母相和菌丝相申克孢子丝菌差异表达基因KEGG分类图
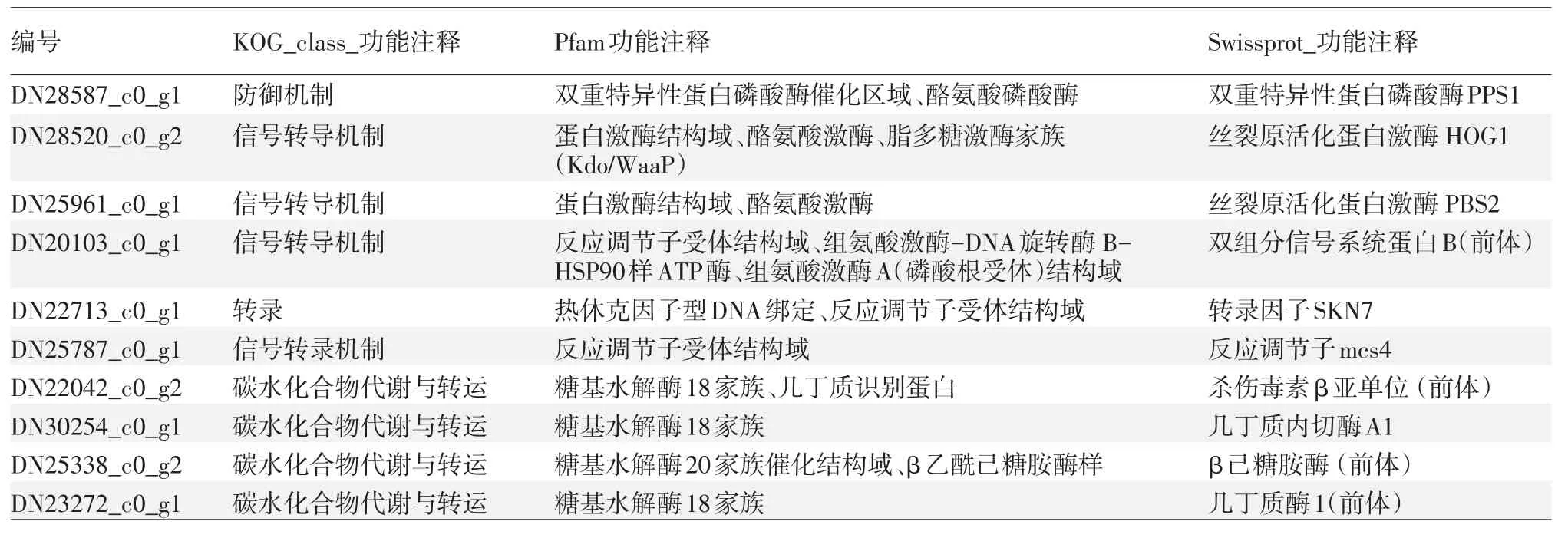
表1 申克孢子丝菌酵母相较菌丝相表达上调的部分基因的功能注释
值得关注的是参与真菌形态形成的两个重要信号转导通路MAPK及双组分信号通路中的16条基因也被证实在早期酵母相上调表达。MAPK通路在病原真菌中具有重要调控功能,参与细胞壁的完整性通路、孢子壁的完整性通路、孢子壁的组装通路、菌丝的生长通路、信息素的反应通路、高渗透性甘油通路的信号调控,进而调控病原真菌的生长、繁殖、应激及形态形成[7]。MAPK通路受控于其上游信号传导通路——双组分信号通路,而后者在病原真菌中具有广泛的调节作用,包括细胞壁的生物合成、毒力基因的表达、耐药性、形态形成等[8-10]。我们既往研究发现,孢子丝菌双组分信号系统组氨酸蛋白激酶DRK1和MAPK通路中丝氨酸蛋白激酶Ste20的蛋白水平在酵母相早期上调,DRK1/Ste20基因表达被干扰后,其向酵母相形态转化受阻,菌株毒力减弱,提示二者在孢子丝菌形态转化及致病性形成过程中起重要作用[11]。本研究中我们在酵母相中鉴定出上调表达的9条MAPK通路基因和7条双组分信号通路基因,推测双组分信号通路、MAPK信号传导通路参与孢子丝菌对外界环境因素的感知、菌丝相向酵母相的形态转化及菌体致病性形成的过程。
几丁质又称甲壳素,是由N-乙酰-β-D-氨基葡萄糖以β-1,4糖苷键连接而成的高分子生物多聚体,既是真菌细胞壁的重要组成部分,也是其重要毒力因子[12]。细胞壁是真菌抵御渗透压和外界机械损伤的重要屏障,几丁质富集是真菌细胞抵抗或适应恶劣的外部环境的主要手段,而几丁质暴露会造成分生孢子的毒力减弱,有利于诱发抗真菌免疫应答,减轻组织炎症损伤[13]。几丁质合成酶是控制几丁质合成的关键酶。本研究鉴定出包括几丁质合成酶及内切几丁质酶在内的16条基因在酵母相上调表达,提示孢子丝菌菌丝相向酵母相转换的早期几丁质合成代谢发生改变,可能参与孢子丝菌酵母相的形态形成及致病性产生。
综上,我们应用RNA-seq高通量测序方法对早期酵母相及菌丝相申克孢子丝菌的转录组学进行比较,差异表达基因的鉴定与功能注释有助于我们对孢子丝菌致病性形成的分子机制有更深刻的认识,也为孢子丝菌病治疗药物的研发提供新的思路,如脊椎动物体内不存在双组分信号蛋白及几丁质成分,故二者均可作为理想的药物作用靶点。将来我们拟通过基因敲除或干扰技术构建基因缺陷株,对重要差异基因做进一步的功能研究。
