过敏性紫癜患者CD4+T细胞叉头框蛋白3基因甲基化水平及其与调节性T细胞的关系
2019-04-28树叶罗鸯鸯罗勇奇汤建萍肖嵘
树叶 罗鸯鸯 罗勇奇 汤建萍 肖嵘
1湖南省儿童医院皮肤科,长沙 410007;2中南大学湘雅二医院皮肤科,长沙 410008
过敏性紫癜的病因复杂,常在特定的遗传易感性基础上,由感染和过敏等环境因素诱发,但具体的发病机制仍不清楚。CD4+CD25+调节性T细胞(regulatory T cells,Treg)作为具有免疫抑制功能的T细胞,可以防止机体免疫系统过度活化,维持免疫平衡状态,避免机体出现一系列自身免疫疾病。多项研究发现,某些自身免疫性疾病伴随出现CD4+CD25+Treg数量下降和/或功能损伤[1-3]。叉头框蛋白3(forkhead box protein 3,Foxp3)主要表达于Treg,对该细胞的发育、分化成熟、维持免疫抑制功能起关键作用,被公认为CD4+CD25+Treg的标志[4-5]。Foxp3基因对维持免疫平衡有重要作用,其移码突变可造成编码蛋白scurfin缺陷,进一步造成小鼠致死性淋巴细胞增殖性疾病[5]。影响Foxp3基因表达的原因很多,近年研究表明,表观遗传学甲基化状态对人Treg的Foxp3基因具有重要的调控作用[6-7]。我们检测过敏性紫癜患者CD4+CD25+Treg比例和Foxp3基因mRNA及启动子区甲基化水平,探讨甲基化调控Foxp3基因在过敏性紫癜发病机制中的作用。
对象与方法
一、一般资料
2015年3月至2016年10月在中南大学湘雅二医院皮肤科收集20例过敏性紫癜住院患者和20例健康体检者。20例患者均符合过敏性紫癜国际诊断标准(下肢出现紫癜或瘀点,血小板数目正常,合并以下任意1项:腹痛、关节炎或关节肿痛、肾脏受累、组织病理示IgA血管炎)[8],排除其他原因所致的血管炎和紫癜,无其他免疫系统疾病、无糖皮质激素或免疫抑制剂治疗史。所有病例均有皮肤紫癜症状,其中12例伴关节肿痛,6例合并腹痛及粪便隐血,11例合并肾脏损害(出现蛋白尿和/或尿红细胞计数阳性),部分患者同时出现关节、消化道和肾脏损害,参照文献[9]进行临床评估,评分为4.7±1.65。患者组男女比例13∶7,年龄(26.15±18.13)岁。健康对照组中男女比例12∶8,年龄(28.56±17.45)岁,无过敏性疾病或免疫性疾病史。两组间性别、年龄差异均无统计学意义(均P>0.05)。本研究经湖南省儿童医院医学伦理委员会批准(批件号:HCHLL-2016-006),患者均签署知情同意书。
二、外周血单个核细胞(PBMC)及CD4+T细胞的分离
采集受试者外周静脉血60 ml,肝素抗凝,采用人淋巴细胞分离液(瑞典GE Healthcare公司)通过密度梯度离心法分离PBMC。采用人CD4+T细胞阳性磁珠分选试剂盒(德国Miltenyi公司)分选CD4+T细胞亚群。
三、流式细胞仪分析CD4+CD25+Treg比例
参考流式细胞仪检测说明书,将分离的CD4+T细胞首先进行细胞膜CD4-FITC、CD25-PerCP单克隆抗体双标记,破膜固定后进行FoxP3-PE单克隆抗体胞内染色。CD4-FITC、CD25-PerCP、Foxp3-PE单克隆抗体均为美国BD公司产品。应用流式细胞仪(美国BD公司)和CellQuest software软件分析CD4+CD25+Treg的比例。
四、荧光实时定量PCR分析CD4+T细胞中Foxp3 mRNA水平
参照说明书,采用Trizol RNA提取试剂(美国Life Science公司)提取CD4+T细胞亚群的总RNA,应用紫外分光光度仪测定RNA纯度。采用PrimeScriptTMRT试剂盒(日本TaKaRa公司)按照说明书合成cDNA第一链。采用SYBR®Premix Ex TaqTM试剂盒(日本TaKaRa公司),以cDNA为模板,配制RT-PCR反应体系:上游引物0.4 μl,下游引物0.4 μl,无酶水7.2 μl,2×SYBR Premix Ex Taq realtime PCR mix 10 μl,cDNA 2 μl,总体积20 μl。Foxp3正向引物5′-CAAGTTCCACAACATGCGAC-3′,反向引物5′-ATTGAGTGTCCGCTGCTTCT-3′;以β肌动蛋白作为内参照,正向引物5′-GCACCACAC CTTCTACAATGAGC-3′,反向引物5′-GGATAGCAC AGCCTGGATAGCAAC-3′。由上海铂尚基因生物公司合成引物。应用Rotor-Gene 3000实时PCR仪(澳大利亚Corbett Research公司)扩增,反应条件:95℃预变性30 s;95℃变性5 s,60℃退火延伸20 s,45个循环。采用2-ΔΔCt表示靶基因的相对表达量,患者组ΔCt=患者样品Ct值均值-内参Ct值,对照组ΔCt=对照样品Ct值均值-内参Ct值,ΔΔCt=患者组ΔCt-对照组ΔCt。
五、Foxp3启动子甲基化片段扩增与测序
参照说明书,使用基因组DNA提取试剂盒(北京天根生化科技有限公司)提取CD4+T细胞总DNA。使用EpiTect®Bisulfite试剂盒(德国Qiagen公司)对总DNA进行亚硫酸盐转化。使用甲基化特异性PCR试剂盒(北京天根生化科技有限公司)扩增Foxp3启动子甲基化片段。参考UCSC Genome Browser上人Foxp3基因的DNA序列,采用软件MethPrimer设计甲基化引物,正向引物5′-TATA ATTAAGAAAAGGAGAAATATAGAGAG-3′,反向引物5′-TCAACCTAACTTATAAAAAACTATCAC-3′。
将扩增产物和载体pGEM-T easy vector(美国Promega公司)连接,然后转化DH5α大肠杆菌感受态细胞(北京天根生化科技有限公司),在氨苄西林(+)5-溴-4-氯-3-吲哚-β-D-吡喃半乳糖苷(+)异丙基硫代半乳糖苷(+)LB平板上培养。根据蓝白挑选原则,选择10个阳性克隆,送至深圳华大基因公司测序。每例受试者选择10个克隆,根据测序结果,分析CG位点的变化,进而计算甲基化水平。若CG位点全部保持不变,则甲基化水平为1,若全部变化,则为0。
六、统计学分析
使用SPSS16.0软件分析数据。计量资料以±s表示。采用独立样本t检验比较样本均数,单因素直线相关分析评估指标的相关性,计算Pearson相关系数。P<0.05认为差异有统计学意义。
结果
一、患者及健康对照组外周血CD4+CD25+Treg比例
见图1、表1。与健康对照组相比,过敏性紫癜患者外周血Treg在CD4+T细胞中的百分比显著降低(P<0.05)。
二、患者及健康对照组CD4+T细胞中Foxp3基因mRNA表达水平及Foxp3基因启动子区甲基化水平
与健康对照组相比,患者组外周血CD4+T细胞Foxp3 mRNA的表达水平显著降低(P<0.01),见表1。
亚硫酸氢钠测序结果显示,患者组外周血CD4+T细胞Foxp3基因启动子区8个CG位点的总甲基化水平较健康对照组显著升高(P<0.01)(表1)。患者平均甲基化水平也较健康对照组显著升高(t=3.610,P<0.01)。见图2。
三、患者CD4+T细胞Foxp3基因启动子区域甲基化水平与临床病情评分和肾损害的相关性
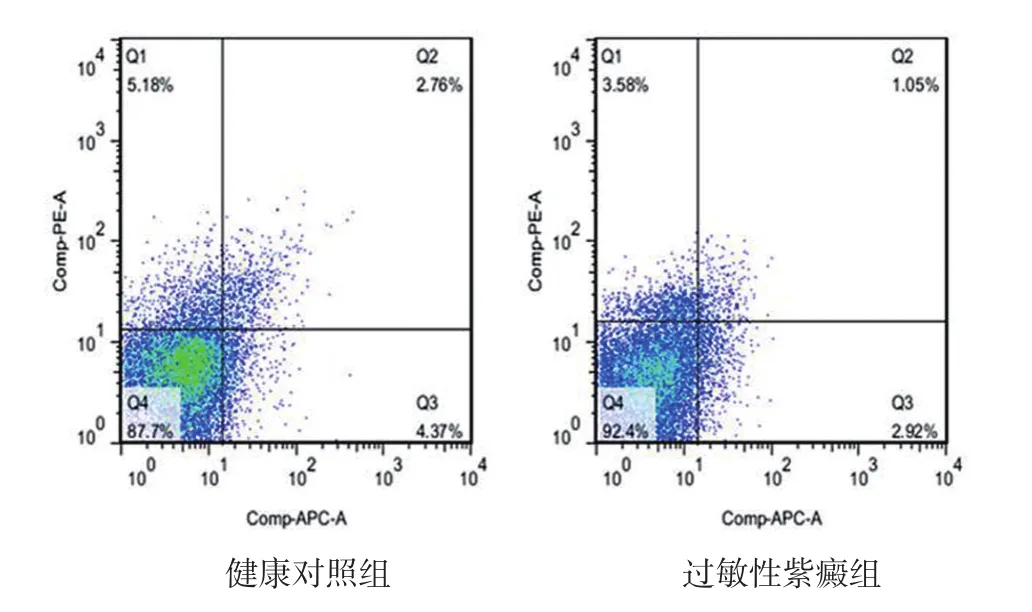
图1 流式细胞仪检测CD4+CD25+Treg在CD4+T细胞中的比例与健康对照组相比,过敏性紫癜组CD4+CD25+Treg在CD4+T细胞中的比例显著降低
表1 过敏性紫癜患者外周血CD4+T细胞中CD4+CD25+Treg比例以及Foxp3 mRNA和基因启动子区总甲基化水平(±s)

表1 过敏性紫癜患者外周血CD4+T细胞中CD4+CD25+Treg比例以及Foxp3 mRNA和基因启动子区总甲基化水平(±s)
组别患者组健康对照t值P值例数20 20 Treg比例(%)1.668±0.959 2.741±1.131 2.552<0.05 Foxp3 mRNA(2ΔΔCt)0.380±0.226 1 9.503<0.01 Foxp3启动子区甲基化水平0.712±0.164 0.453±0.147 3.610<0.01

图2 过敏性紫癜(HSP)患者及健康对照组CD4+T细胞Foxp3基因启动子8个CG位点平均甲基化水平HSP患者(20例)各CG位点的平均甲基化水平较健康对照组(20例)明显升高
患者外周血CD4+T细胞Foxp3启动子区总甲基化水平与CD4+CD25+Treg比例呈显著负相关(r=-0.490,P<0.05),但与临床病情评分呈显著正相关(r=0.486,P<0.05),见图3、4。肾损害组(11例)CD4+T细胞Foxp3启动子区总甲基化水平(0.749±0.095)显著高于无肾损害组(9例,0.643±0.075),P<0.05。
讨论
DNA甲基化主要在转录水平调控基因表达,并且DNA甲基化的信息可随DNA的复制而遗传,是表观遗传学最重要、最经典、研究最深入的内容之一。CpG岛位于基因的启动子、增强子或其他区域,是基因转录的起始区。DNA甲基化主要发生在5′-CpG-3′的C上,生成5-甲基胞嘧啶,甲基通过阻碍蛋白质与DNA结合降低基因转录,下调基因表达。近年研究发现,多种自身免疫性疾病如系统性红斑狼疮(SLE)、硬皮病、干燥综合征中,多种基因受到DNA甲基化的调控而过表达或低表达,在不同程度上影响了疾病的发生、进展和预后[10-12]。环境诱发因素如细菌、病毒、特定过敏原、日光、硅、疫苗或者药物可以通过DNA甲基化途径,影响某些基因的表达,在一定程度上参与发病。
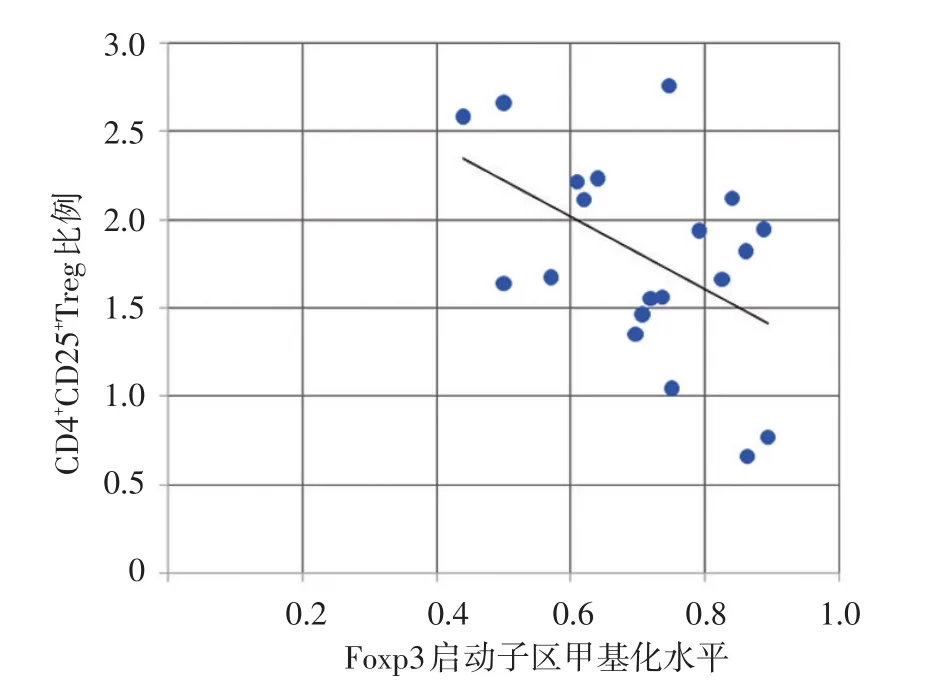
图3 20例过敏性紫癜患者Foxp3基因启动子区甲基化水平与CD4+CD25+Treg百分比呈显著负相关
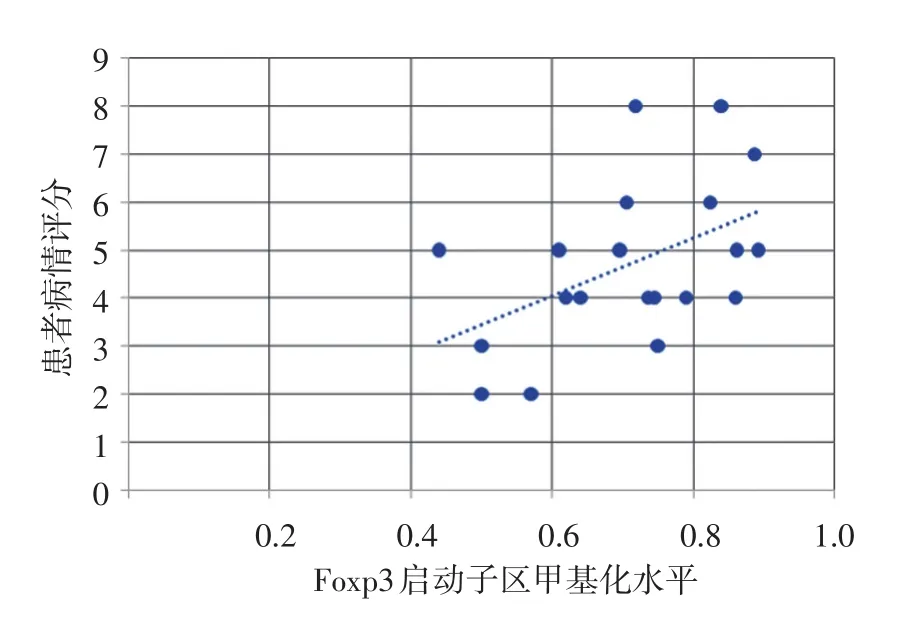
图4 20例过敏性紫癜患者Foxp3基因启动子区甲基化水平与病情评分呈显著正相关
CD4+CD25+Treg是具有免疫抑制调节功能的成熟T细胞亚群,其数量下降和/或功能降低有可能破坏机体固有的免疫平衡,引起自身免疫性疾病。Tselios等[13]发现,CD4+CD25+Treg的数量和SLE的疾病活动程度呈明显负相关,其改变可灵敏地反映SLEDAI的变化,故可以作为一种评价SLE疾病活动度的生物标记。活动性类风湿性关节炎患者外周血CD4+CD25+Treg数量降低,并且与类风湿性关节炎病情活动性评分、C反应蛋白及红细胞沉降率呈负相关[14]。流式细胞仪检测发现,进行期银屑病患者外周血中CD4+CD25+Treg数量较健康人明显下降,治疗后和疾病缓解期Treg数量上升[15]。Antiga等[16]用流式细胞仪、酶联免疫吸附实验和免疫组化方法发现,在系统性硬化和硬斑病患者的皮损和外周血中,CD4+CD25+Treg比例和白细胞介素10、转化生长因子β的表达均比健康人减少。
我们检测发现,过敏性紫癜组较健康对照组外周血CD4+T细胞中Foxp3基因表达降低,CD4+CD25+Treg百分比下降。推测Treg数量下降导致免疫抑制功能降低,破坏患者的免疫自稳状态,诱发过度免疫反应,这可能是过敏性紫癜的发病机制之一。进一步比较发现,患者组较健康对照组CD4+T细胞中Foxp3启动子区甲基化水平明显升高。上述结果证实,患者Foxp3基因和Treg的表达下降受到DNA甲基化的调控[6-7]。最后,我们分析探讨Foxp3启动子区甲基化水平的相关因素,发现患者外周血CD4+T细胞Foxp3启动子区甲基化水平与CD4+CD25+Treg比例呈显著负相关,但与临床病情评分呈显著正相关,且肾损害组CD4+T细胞Foxp3启动子区甲基化水平明显升高。提示过敏性紫癜患者CD4+T细胞Foxp3基因启动子区高甲基化,抑制Foxp3基因,进一步影响Treg的产生,这可能是过敏性紫癜免疫紊乱的发病机制之一,需要进一步深入研究。
