弥散张量成像联合磁共振波谱在颅脑损伤昏迷患者预后评定中的应用
2019-04-28张晓峰张明文于志虎朱林周雁玲
张晓峰,张明文,于志虎,朱林,周雁玲
南方医科大学附属小榄医院神经外科,广东中山528415
前言
人类意识包括觉醒和高级意识活动[1]。网状上行激活系统(Ascending Reticular Activating System,ARAS)位于脑干连接丘脑、额叶底面和大脑皮层,是维持觉醒的关键。颅脑损伤后原发和/或继发损伤侵及ARAS 后,会导致患者出现不同程度的意识障碍[2]。目前还没有创伤性脑损伤(Traumatic Brain Injury,TBI)后昏迷患者意识恢复情况的预判方法,但神经影像技术的发展给我们提供一个新的角度来认识意识障碍。
TBI 致残患者中,40.0%~87.5%存在弥漫轴索损伤。弥散张量成像(Diffusion Tensor Imaging, DTI)是利用水分子弥散运动的各向异性作为成像原理的磁共振技术,能间接反映神经纤维结构的变化,可很好地评价外伤后轴索损伤情况[3]。有研究探讨了DTI参数变化与昏迷程度之间的相关性[4],研究也多使用弥散各向异性(Fractional Anisotropy,FA)及表观弥散系数(Apparent Diffusion Coefficient,ADC)作为参数进行评估[5-6],但是大多数研究对昏迷病人的长期观察不足。Cecil等[7]通过动物实验发现在颅脑损伤几分钟内,乙酰天门冬氨酸NAA出现下降并在48 h达到最低,实验发现磁共振波谱(Magnetic Resonance Spectrum, MRS)也可以反映脑损伤的严重程度。虽既往的相关研究发现MRS与脑损伤的严重程度相关[8],但对昏迷患者的临床预后研究仍显不足。
为了分析昏迷病人脑内感兴趣区DTI 参数的时空变化,本研究采用了以下4 个参数进行研究:(1)FA,代表空间内水分子弥散的特征,用来反映组织结构的方向性;(2)平均弥散系数(Mean Diffusivity,MD),三轴方向弥散系数的平均值,用来反映感兴趣区组织内水分含量变化;(3)轴向弥散系数(Axial Diffusivity,Da),用来反映轴突传导方向上的结构变化;(4)径向弥散系数(Radial Diffusivity,Dr),用来反映在弥散受限方向上的平均弥散系数(与Dr 垂直方向),Dr 升高能反映出纤维上少突胶质细胞的损伤,从而减弱对垂直方向上弥散的限制。同时本研究也结合MRS 的变化,测定乙酰天门冬氨酸NAA(反映神经元的密度和活性)、胆碱CHO(反映神经胶质细胞的变化)、肌酐Cr(在维持细胞能量代谢中起到重要作用)和乳酸Lac(无氧代谢的标志)。神经外科通常应用修订版昏迷恢复量表(Coma Recovery Scale-Revised, CRS-R)以及改良格拉斯哥预后评分(Modified Glasgow Outcome Score,mGOS)对脑损伤患者进行预后评估[9-11],MRS和DTI可以发现常规CT和MRI 不能检出的解剖和代谢变化,并在昏迷不同时期测量上述参数进行动态观察,对于损伤预后的判断更加精准[7,12]。
本研究通过将TBI 患者急性期及慢性期DTI 和MRS的定量分析参数与恢复期的神经功能评分进行分析,探讨DTI 联合MRS 在急性期及慢性期对昏迷TBI患者预后的评估。
1 病例与方法
1.1 病例选取
选取10例意识程度不同而且住院观察超过两周的TBI患者(男5例,女5例),平均年龄为45.5岁(表1)。在入组时要求患者各项生命体征平稳且在颅脑损伤后72 h内到南方医科大学附属小榄医院神经外科接受治疗,以排除不同治疗方案所带来的偏差。正常对照组选取与患者年龄、性别以及教育程度匹配的健康人(男5例,女5例),平均年龄为48.0岁。
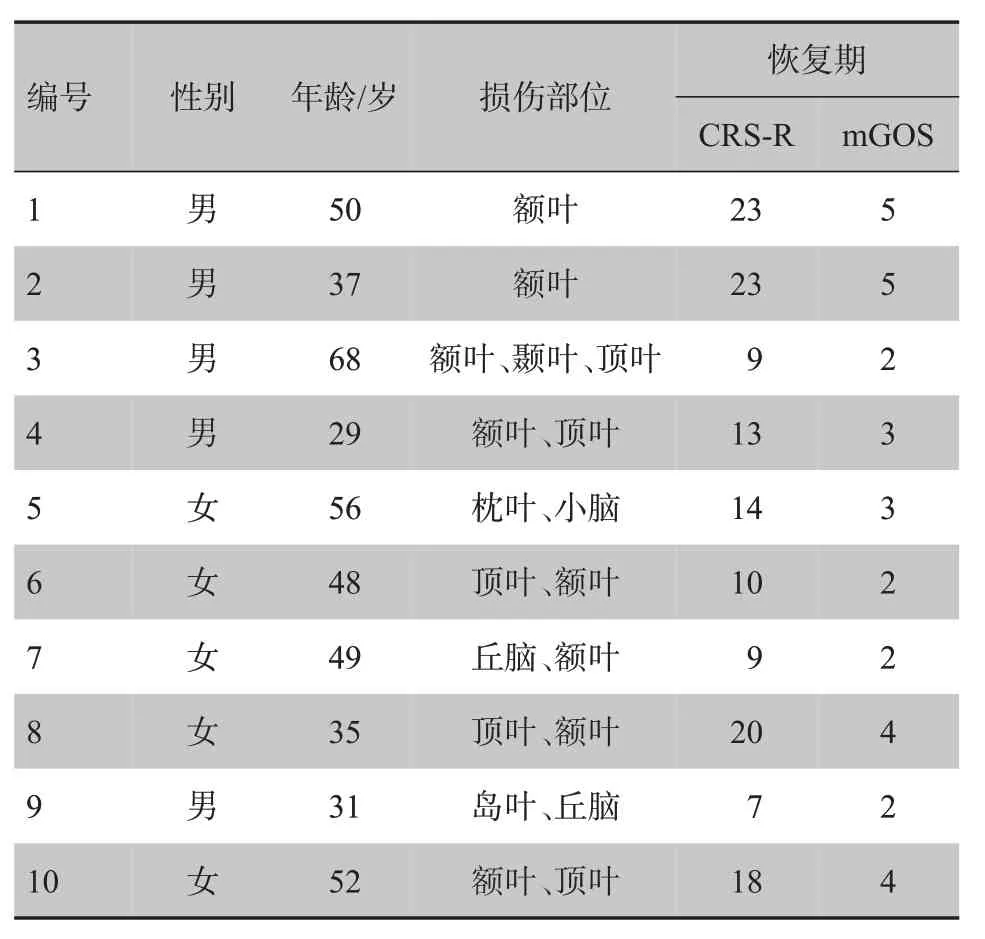
表1 入组患者的基础信息Tab.1 General clinical information of enrolled patients
如果存在以下情况的将予以排除:(1)既往有神经系统疾病病史患者;(2)外伤合并低氧血症患者;(3)磁共振检查禁忌症的患者,如体内有金属异物或植入物。
1.2 数据采集
入组患者于急性期(入院后第2周)和慢性期(入院后第4 周及以后)分别行影像学检查,并在恢复期(出院3月后)评定病人恢复情况。正常对照组选取健康人,仅进行一次影像学检查。影像学检查包括常规磁共振检查(T1WI、T2WI、FLAIR序列检查)、DTI及MRS。
数据收集使用GE Signa Excite HD 1.5 T超导型磁共振扫描仪进行全脑检查,扫描序列包括T1WI(TR/TE=400 ms/15 ms)、T2WI(TR/TE=3 000 ms/100 ms)、DTI(TR/TE=10 000 ms/95 ms、Matrix=128*128、FOV=24、层厚=4 mm、层间距=0 mm)及MRS(TR/TE=10 000 ms/95 ms、Matrix=128*128、FOV=24、层厚=4 mm、层间距=0 mm、磁场强度=500 T/m、梯度切换率=150 mT/ms、TR/TE=5 000 ms/980 ms、层厚=5 mm、层间距=1.0 mm)。
通过FSL v.5.0在T1上定位并绘制4个脑区:丘脑板内核、网状核和ARAS相关脑区(桥脑、延髓),每个脑区绘制3 次感兴趣区,并将制作的感兴趣区导入ADW4.4 工作站,使用Functool 软件结合DTI 行数据后处理,测量并获得感兴趣区的FA、MD、Da、Dr,取3次感兴趣区测量值的平均值。通过MRS 测量上述4个脑区的NAA、Cr、CHO、Lac 变化。影像资料的整理及质量控制将由两个影像科医生共同完成。
1.3 随访数据收集
安排入组病人随访,伤后3个月到医院门诊复查的同时采用CRS-R和GOS-R来评估预后情况。
1.4 统计学分析
应用SPSS 20.0 进行统计学分析。TBI后不同时期所测得到的各感兴趣区DTI参数(FA、MD、Da、Dr)和MRS 参数(NAA、Cr、CHO、Lac)与正常对照组进行独立样本t检验;患者急性期和慢性期之间的比较使用配对t检验;各参数与CRS-R、mGOS 评分进行Spearman 相关分析。P<0.05为差异有统计学意义。
2 结果
2.1 DTI 分析
2.1.1 急性期与慢性期比较在急性期与慢性期比较中,FA在慢性期高于急性期,MD在慢性期升高。相比急性期,网状核和板内核的Da 在慢性期有所恢复。桥脑和延髓内未发现显著区别。4 个感兴趣区内的Dr在慢性期下降明显。表2为各感兴趣区急性期与慢性期DTI参数的配对t检验的结果。
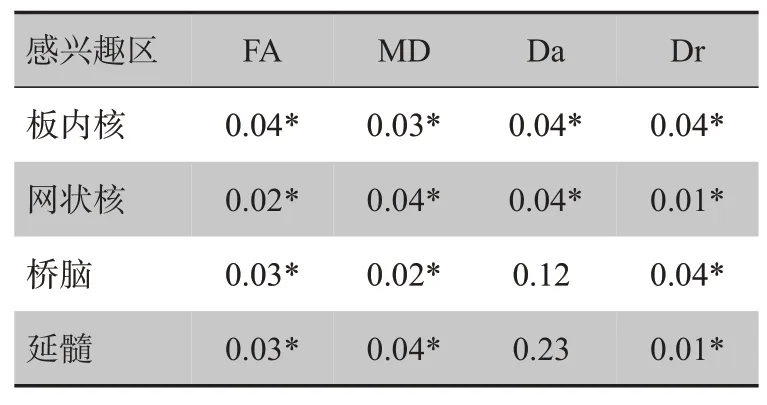
表2 急性期与慢性期DTI参数的配对t检验Tab.2 Results of paired t-test on DTI parameters between the acute stage and the chronic stage
2.1.2 急性期和慢性期与正常对照组比较急性期FA 与MD 都明显低于正常对照组,但是在慢性期的丘脑感兴趣内FA 与正常对照之间没有显著区别,MD 依然低于正常对照组。Da 在急性期显著下降。在慢性期,桥脑及延髓内依然显著低于正常对照组。急性期Dr 在4 个感兴趣区内都明显升高,而昏迷患者慢性期和正常对照者间丘脑内Dr未见明显区别。表3为各感兴趣区急性期与慢性期DTI 参数与正常对照组的独立样本t检验结果。
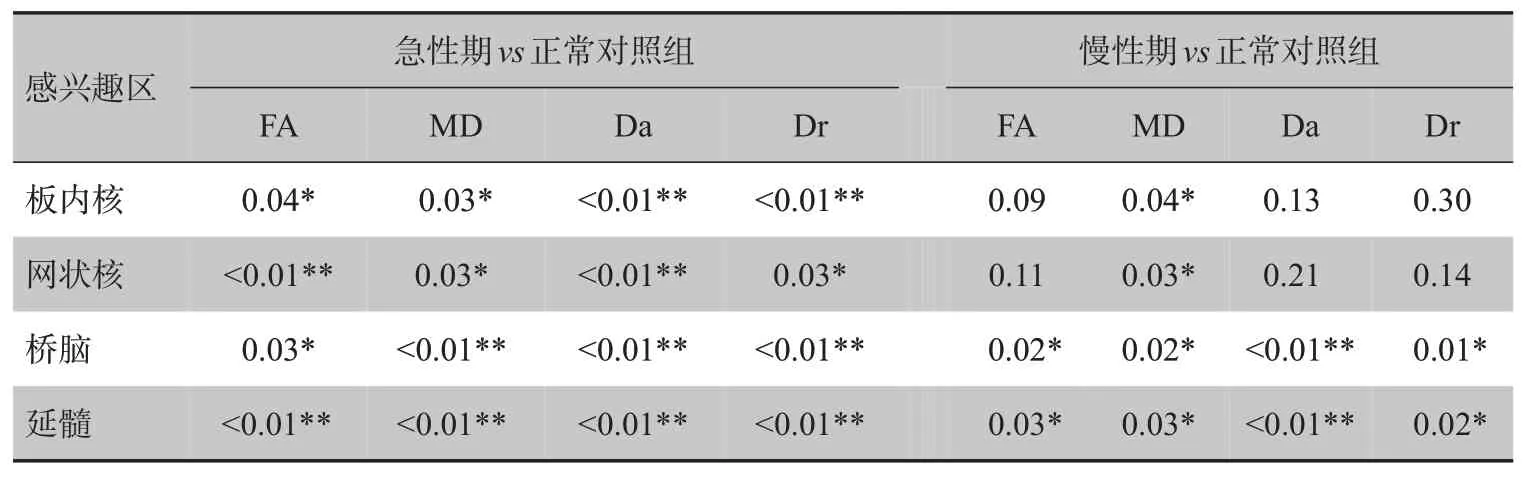
表3 TBI患者急性期与慢性期DTI参数与正常对照组的独立样本t检验Tab.3 Results of independent sample t-test on DTI parameters between patients with TBI in the acute and chronic stages and normal controls
2.1.3 DTI参数与临床数据的相关性分析通过与恢复期的临床评分的相关性分析发现急性期脑桥、延髓的FA、丘脑内的MD与恢复期CRS-R及mGOS之间未发现相关性,但在慢性期,他们与临床意识评分的相关性明显。除此以外,在急性期和慢性期中,其他的参数(Da和Dr)与CRS-R及mGOS都表现出了很好的相关性(表4)。

表4 DTI参数与恢复期CRS-R及mGOS的相关分析Tab.4 Results of correlation analysis on DTI parameters and CRS-R or mGOS
2.2 MRS分析
2.2.1 急性期与慢性期比较急性期NAA/CHO(除桥脑内的NAA/CHO以外),CHO/Cr和慢性期之间有显著区别,急性期期桥脑和延髓的NAA/Cr与慢性期之间没有区别(表5)。本研究中只有1 例出现Lac 峰,随访时为植物生存状态,因为只有1 例,在接下来的分析中并未将此参数纳入。

表5 急性期与慢性期MRS参数的配对t检验Tab.5 Results of paired t-test on MRS parameters between the acute stage and chronic stage
2.2.2 与正常对照组相比与正常对照组相比,急性期中NAA/Cr 和NAA/CHO 显著下降,而CHO/Cr 显著上升。在急性期中MRS参数与正常对照组之间存在明显区别,但在慢性期中桥脑及延髓部位的NAA/Cr 以及丘脑内的NAA/CHO、CHO/Cr 与正常对照组之间没有明显区别(表6)。
2.2.3 MRS参数与临床数据的相关性分析在与恢复期的临床参数进行相关性分析后发现CHO/Cr 仅在慢性期的脑干ARAS中表现出与预后的相关性,其余两项均在在急性期及慢性期都有与恢复期预后评分之间存在相关性。除急性期丘脑内的NAA/CHO 没有表现出明显的预后相关外,其余感兴趣区的参数都表现出与预后的良好相关性(表7)。
3 讨论
本研究通过将急性期及慢性期的DTI及MRS参数与患者伤后3 个月的临床评分结合进行分析,发现:(1)昏迷TBI患者的DTI与MRS参数与正常对照者间存在显著区别;(2)慢性期DTI 及MRS 能提示TBI 昏迷患者的预后情况;(3)ARAS 内的参数恢复慢于丘脑内的参数恢复;(4)ARAS 参数能更好地预判脑损伤昏迷病人的预后情况。
对TBI 昏迷患者的DTI 分析显示在急性期,ARAS 及丘脑内的参数都与正常对照组存在显著区别,但是ARAS 内的参数恢复比丘脑内的慢,在慢性期内各参数随着病情的稳定逐步好转。丘脑内除MD外的参数都与正常对照者基本相同,但桥脑和延髓的Da与正常对照者仍有差异,Da在慢性期内与正常对照者间存在显著区别,但在急性期内并无显著区别,这验证了ARAS 在意识发生维持中的重要作用,将该系统内多部位的Da 作为对意识判断的参数具有很重要的临床意义,Li 等[13]也发现了Da 能对脑外伤病情进行判断的作用。

表6 TBI患者急性期与慢性期MRS参数与正常对照组的独立样本t检验Tab.6 Results of independent sample t-test on MRS parameters between patients with TBI in the acute and chronic stages and normal controls
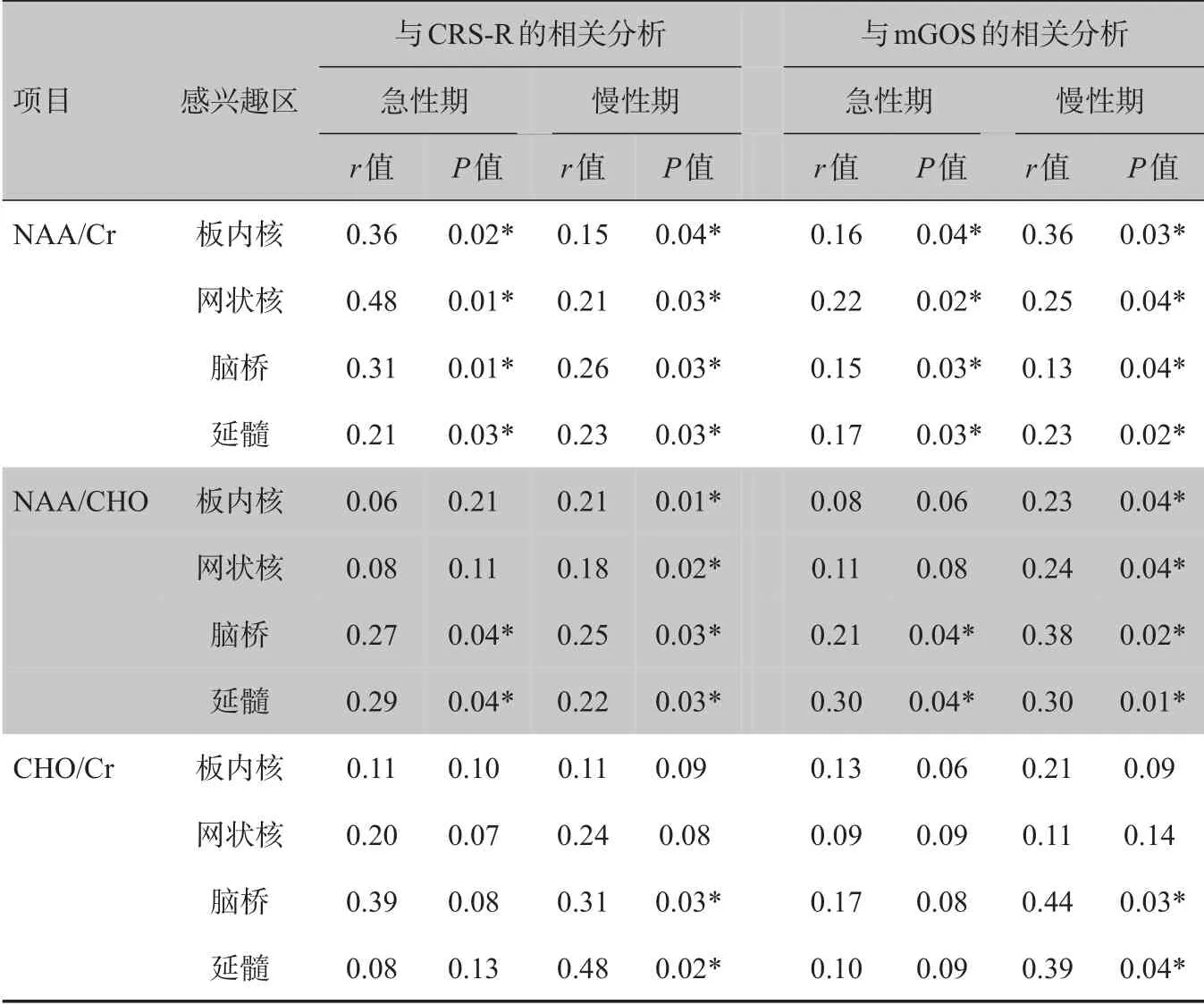
表7 MRS参数与恢复期CRS-R及mGOS的相关分析Tab.7 Results of correlation analysis on MRS parameters and CRS-R or mGOS
在DTI与预后情况的分析中,慢性期的各项DTI参数具有一定的预判作用[14]。Tollard 等[15]也提出亚急性期DTI 及MRS 能对预后有较好的预判,但并未针对脑内ARAS 进行分析。在急性期的参数与预后之间没有明显的相关性。通过分析患者损伤部分,其中额叶损伤最多,大部分患者额叶损伤后出现的脑水肿会累及深部脑区,而丘脑就在其中,丘脑部位的脑水肿可能是导致其在急性期与预后相关分析不佳的原因之一。如果能排除脑水肿的干扰,DTI能够更好地判断病情发展。脑干的位置以及生理功能支持其作为判断损伤后意识恢复状况的潜在部位[16]。
既往TBI相关研究发现MRS与重症脑损伤预后之间的关系[17],特别是NAA/Cr在病情预后分析中的作用[18]。但既往研究多为单一部位的研究,而且没有结合DTI 进行分析。本研究采用多模态结合分析能更好地呈现MRS在脑损伤预后判断中的作用。本研究发现在昏迷病人的MRS变化中,急性期的NAA/Cr 和NAA/CHO 下降但CHO/Cr 上升。在慢性期中,ARAS 内NAA/Cr以及丘脑部位的NAA/CHO 和CHO/Cr与正常对照者没有明显区别,这佐证了本研究中DTI分析的结果,即ARAS的参数恢复慢于丘脑的参数恢复,从而可以解释病人在脑损伤后出现长久昏迷状态的原因。Nakabayashi等[19]发现在创伤一周后CHO/Cr 才出现明显的改变,而在本研究中,病人影像的扫描时间在第二周及第四周,此时CHO/Cr的水平已经开始上升,与Nakabayashi 等[19]的研究并不矛盾。
Holshouser 等[11]发现急性期小儿脑损伤的预后与丘脑相关部分的NAA/CHO 和CHO/Cr 的相关性差。本研究也发现慢性期内NAA/CHO和CHO/Cr对脑损伤预后判断没有NAA/Cr的效果好,此结果支持了Choe等[20]的研究结果,NAA/Cr在急性期及慢性期都与预后相关,这也验证了Carpentier等[21]的研究,急性期对于预后的判断可以结合ARAS 中的NAA/CHO 共同分析,慢性期可以结合丘脑上的参数变化。此外,在Holshouser 等[11]发现全脑的CHO/Cr 与预后相关,本研究也发现病人慢性期ARAS 的CHO/Cr与预后之间为负相关关系。
本研究并没有进行全脑数据的综合分析,也没有将病人的创伤类型考虑在内,而且仅选择了10 例患者。在未来的研究中,我们将会补充更多的病例,并针对损伤机制进行讨论分析,从而更客观地分析昏迷TBI患者的预后。
