手指血管球瘤18例临床病理分析
2019-04-26齐文娟许俊卿刘俊霞
齐文娟,赵 华,许俊卿,刘俊霞
(1.西安兵器工业卫生研究所病理科,西安 710065;2.西北工业大学医院内科,西安 710072)
血管球瘤(glomus tumor,GT)是来源于血管球罕见的软组织良性错构瘤,具有典型的“三联征”,包括自发性间歇性剧痛、难以忍受的触痛、疼痛的冷敏感性。主要发生在指的远端,尤其是甲板下,身体的其他脏器如胃、肠、气管、肾等也有报道[1-4]。其病因尚不清楚,以青壮年女性多见。由于其发病率低,临床容易误诊[5]。本研究对手指血管球瘤临床病理进行分析,现报道如下。
1 资料与方法
1.1一般资料 收集2013年1月至2017年7月确诊的手指血管球瘤为研究对象,由两位高年资病理医师复阅切片,诊断标准参照WHO软组织肿瘤分类中血管球瘤的诊断标准。
1.2方法 记录患者临床资料、组织学形态及免疫组织化学染色情况,并复习相关文献,从组织起源、致痛机制、诊断方法、组织形态、鉴别诊断、恶性诊断标准及治疗预后对GT的特点进行分析。所有标本均经福尔马林固定,规范脱水,石蜡包埋后行HE切片染色。免疫组织化学采用SuperVision二步法,抗体CD34、CD117、SMA、Vimentin和S-100均购自福建迈新生物技术有限公司。
1.3结果判定 病理类型判断:参照WHO血管球瘤的诊断标准,按瘤细胞、血管结构和平滑肌组织的不同比例分为3种类型。疗效判断[6]:显效,血管球瘤症状完全消失,11~45个月无复发或是转移情况,常规检查等恢复正常或有很大的好转;有效,血管球瘤症状基本消除,11~45个月有复发但症状轻,常规检查等基本好转;无效,血管球瘤症状没有转变或好转现象微弱,常规检查等无变化。
2 结 果
2.1临床资料 共收治血管球瘤患者18例,男7例,女11例,年龄19~71岁,中位数43岁,病程1~10年,均无明显诱因,发病年龄多在42~48岁。左手手指6例,右手手指12例;皮下5例,甲下13例;拇指7例,手示指4例,中指6例,手环指1例。本组12例诊断为经典型,6例诊断为球血管瘤型。18例均出现不同程度的疼痛(间歇性疼痛,局限性触痛、压痛,晨起、夜间或受凉后加重),表现为针刺、烧灼样痛,保暖后可缓解。皮肤完整无破溃,甲体、甲床完整,指体末梢感觉及血运尚可。关节活动度良好4例,关节活动受限2例,三联征阳性4例,甲下呈暗红色2例,甲下见暗紫色结节1例,病变呈淡青色斑块1例。大头针试验14例指端(+),2例不明显。冷敏感试验11例阳性,热敷后可缓解6例,7例不明显。X线检查16例中1例示甲下局部骨质吸收,1例示骨质压缩,其余未见明显异常。6例超声示低回声包块,边界不清,考虑血管球瘤;2例可见血流信号;1例血流信号不明显;1例误诊为血管瘤。临床治疗:臂丛麻醉后行肿物切除术,在压痛处做纵行切口,甲下者切除指甲行开窗术,其中1例末节骨质被病变侵蚀较重,指骨背侧骨皮质已浸透。
2.2组织学形态 巨检:送检组织体积0.2~0.8 cm,部分有完整包膜,肿物大多呈暗红色、黄白色,质偏软。镜检:肿瘤由血管和围绕血管分布的成片瘤细胞组成,瘤细胞呈圆形或卵圆形,胞质淡嗜伊红色,细胞境界清晰,核圆形居中,血管为毛细血管或扩张薄壁的静脉,部分间质黏液样变,有数量不等的神经纤维及肥大细胞,见图1。
2.3免疫组织化学 18例样本中瘤细胞Vimentin、SMA (+),瘤细胞周围间质中神经纤维S-100(+);16例样本中血管CD34 (+),5例样本CD117散在(+),见图2。
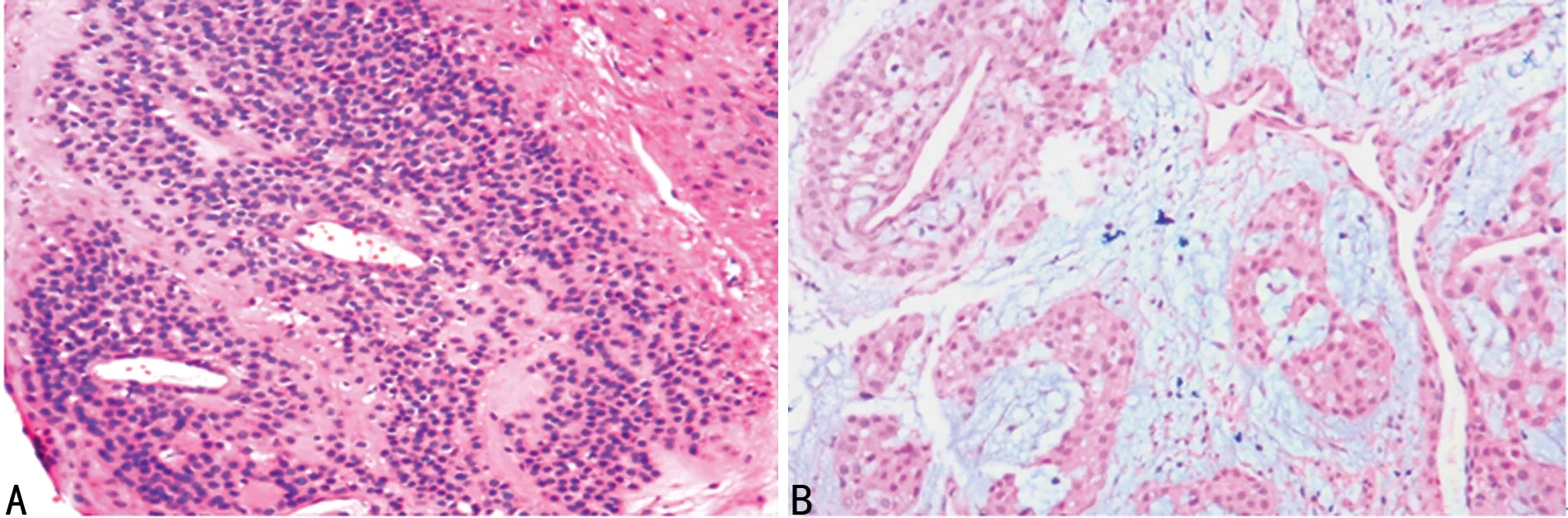
A:成片瘤细胞;B:间质黏液样变
图1 镜检结果(HE×100)
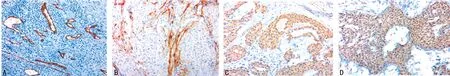
A:CD34;B:S-100;C:SMA;D:Vimentin
图2 免疫组织化学检查结果(×100)
2.4随访资料 14例患者术后进行电话随访,时间5个月至4年,查看是否出现复发或转移情况,其中2例首次术后疼痛,二次手术后疼痛消失,其余12例术后疼痛消失,无复发及转移。
3 讨 论
血管球瘤起源于神经肌动脉球,是一种正常的有丰富神经纤维支配并具有调节温度功能、控制末梢血管的舒缩、调节血流量的动静脉分流。病变可发生于任何年龄,年轻人居多,好发于四肢末端尤其甲下,其他部位也可发生但少见。本组资料患者发生于左手手指6例,右手手指12例;手拇指7例,手示指4例,手中指6例,手环指1例。是否可以大胆设想发病与左右手及不同手指的使用率有关,这种设想需要更大样本去进一步证实。曾有学者认为血管球瘤可能是长期的摩擦、挤压、温度变化等刺激导致的血管球细胞异常增生,从而形成痛性肿块[7]。这在某种程度和本组研究后的设想吻合。
本病好发于甲下,患者有不同程度的疼痛或不适,可能是在肿瘤中有较多的神经纤维,所以对痛觉较为敏感[8]。本研究显示,瘤细胞周围间质中神经纤维S-100(+),也可解释疼痛的原因。大头针试验14例指端均(+),2例不明显,而其他部位的血管球瘤常常缺乏这两个特点。
血管球瘤是一种良性肿瘤,彩超血流显像对血管球瘤有诊断价值。本组6例超声示低回声包块,边界不清,考虑血管球瘤;2例可见血流信号;1例血流信号不明显;1例误诊为血管瘤。说明超声对血管球瘤的早期诊断可提供一定的辅助依据,但不是诊断的金标准。术前超声检查可反映瘤体的大小、位置、内部血流、邻近指骨有无受压或侵蚀,为手术方案选择提供重要依据,以保证肿瘤彻底切除,定位准确、实时、价廉、简单易行,应作为血管球瘤术前定位的首选影像学检查[9]。 X线检查本组16例中1例示甲下局部骨质吸收,1例示骨质压缩,其余未见明显异常。说明X线对血管球瘤无诊断价值。血管球瘤独特的病理形态特点即可明确诊断,与超声、X线相比,病理学依然是血管球瘤最明确的诊断方法,即金标准。
恶性血管球瘤又称血管球肉瘤,十分罕见,诊断时可参考以下特点[10-11]:中-高度核异型性;部位深,体积大于2 cm;核分裂象大于或等于5个/50 HPF,可见病理性核分裂象。如果仅细胞有明显核异型性而无其他恶性指征,可诊断为伴异型细胞核的血管球瘤;如果仅体积较大、部位深在,或仅核分裂象丰富但位置表浅,则可诊断为恶性潜能未定的血管球瘤。本组无恶性病例,恶性血管球瘤十分罕见,诊断需谨慎。
目前尚无药物或者物理治疗血管球瘤,最佳治疗手段是完整手术切除[12-14]。甲下血管球瘤采用拔甲和甲板开窗两种方式,甲旁血管球瘤采用外侧入路,指腹中央血管球瘤可采用直接切口。但无论何种手术方式,术前均应对肿瘤部位进行准确标记[15]。手术需在显微镜下进行操作,将肿瘤包膜及瘤体完全剥离取下,避免术后复发[16]。 既往文献也有报道手术中未找到瘤体,只能做局部软组织清除术,达到了术后解除疼痛的目的[17]。有些病例由于被误诊,经过多次不适当的手术治疗,疼痛问题始终得不到解决,而坚决要求截指。在这种情况下,医生应该向患者提供正确的治疗方法,而不是简单地采取截指。血管球瘤是一种错构瘤, 不应采用截指术治疗[18-19]。
