右美托咪啶对结直肠癌手术麻醉后疲劳程度及恢复质量的影响
2019-04-26田泽丹
王 倩,徐 锐,夏 娟,田泽丹,胡 薇,黄 河,杜 权△
(1.成都市第一人民医院麻醉科 610041;2.重庆医科大学附属第二医院麻醉科 400010; 3.重庆医科大学附属第三医院麻醉科 401120)
结直肠癌在全球的发病率都较高,2015年中国恶性肿瘤统计数据显示,结直肠癌发病率、病死率居我国恶性肿瘤前位,其俨然已成为影响国民健康的主要肿瘤之一[1]。目前,结直肠癌治疗的方式是腹腔镜手术切除为主的综合治疗,手术和心理等因素引起神经、代谢、炎症等应激改变,这些改变的恢复过程即是术后恢复。如何促进结直肠癌患者手术后的恢复,缩短住院时间,减少医疗支出,促进医疗资源分配是当前关注的热点问题[2-3]。外科微创的手术方式大大加快了患者术后的恢复[4]。与此同时,围术期不可缺少的麻醉医生在患者快速康复中也扮演着重要的角色。合理选择麻醉方式、优化药物选择,可以加快结直肠癌患者术后恢复[5]。右美托咪啶(DEX)是高选择性α2肾上腺素受体激动剂,有镇静、镇痛、抗焦虑、交感抑制等优点,本研究观察了静脉输注DEX的结直肠癌患者术中血流动力学、术后不良反应、术后3 d的15项恢复质量量表(QoR-15量表)、疲劳严重度评分(FSS)等,为DEX在结直肠癌手术患者中的合理使用提供参考。
1 资料与方法
1.1一般资料 研究按临床试验要求,获得重庆医科大学附属第二医院伦理委员会批准,取得患者或家属的同意。选择2017年4-12月重庆医科大学附属第二医院收治的全身麻醉下行腹腔镜结直肠癌根治术患者,年龄40~75岁,美国麻醉医师协会(ASA)Ⅰ~Ⅲ级。排除标准:(1)DEX使用禁忌者;(2)术前感染、患免疫系统疾病者;(3)患内分泌系统疾病者;(4)贫血[血红蛋白(Hb)<70 g/L]、心力衰竭者;收缩压过高或过低者(>200 mm Hg或小于90 mm Hg);(5)服用干扰肾上腺功能或抗交感药物者。剔除标准:(1)术中变换手术方式;(2)术中输血;(3)术后发生并发症;(4)术后电解质紊乱;(5)病理结果为良性。计算机产生随机数字,随机分为DEX组(D组)和对照组(C组),放进密闭的信封中,手术当天由恢复室护士拆开信封,并根据分组情况配制药液,不做特殊标记,给予手术室内麻醉医师。
1.2方法
1.2.1麻醉方法 患者均开放两条静脉通道,一条为实施干预专用通道;监测心率(HR)、血压(BP)、心电图(ECG)、血氧饱和度(SpO2),局部麻醉下行桡动脉穿刺监测有创动脉压。麻醉诱导开始前15 min,D组静脉泵注DEX(0.5 μg/kg);C组静脉泵注0.5 μg/kg生理盐水。给氧去氮(100%氧气),依次静脉注射咪达唑仑(0.1 mg/kg)、丙泊酚(2 mg/kg)、舒芬太尼(0.4 μg/kg)、顺式阿曲库铵(0.2 mg/kg),3 min后气管插管,机械通气模式选择容量控制,维持呼气末二氧化碳分压(PetCO2)在35~45 mm Hg。麻醉维持期间持续静脉泵注4~6 mg·kg-1·h-1丙泊酚、0.1~0.2 μg·kg-1·min-1瑞芬太尼,间断予以顺式阿曲库铵维持肌肉松弛。D组持续静脉泵注0.2 μg·kg-1·min-1DEX,C组予以生理盐水至开始手术缝皮。若HR小于50次/分钟,静脉予以0.5 mg阿托品;若有创动脉压变化超过基础值20%,静脉予以血管活性药。麻醉苏醒:术毕患者送至恢复室,合理予以肌松拮抗剂,待肌力、意识达到标准后拔出气管导管。术后采用静脉镇痛(PCIA):舒芬太尼(50 μg)、地佐辛(15 mg)、昂丹司琼(12 mg),总容量100 mL,背景剂量2 mL/h,单次按压剂量0.5 mL,锁时15 min。
1.2.2观察指标 (1)收集患者一般资料,包括性别、年龄、体质量指数(BMI)、手术时间、出入量。(2)QoR-15量表、FFS、疼痛视觉模拟评分量表(VAS)在术前1 d(Pre)、术后第1天(D1)、术后第2天(D2)、术后第3天(D3)完成。(3)记录T0(诱导前15 min)、T1(气管插管完成即刻)、T2(手术切皮时)、T3(二氧化碳气腹建立时)、T4(气管导管拔除即刻)、 T5(出手术室时)6个主要时间点的HR和平均动脉压(MAP)。(4)记录术后2 d按压镇痛泵的次数;术后其他镇痛药物的使用和寒战、恶心呕吐的发生例数;术后住院时间。

2 结 果
2.1两组一般资料比较 研究共纳入结直肠癌手术患者69例,剔除9例不符合试验要求,最终D组和C组各30例,见图1。两组患者一般资料比较,差异均无统计学意义(P>0.05),见表1。
2.2两组术中HR与MAP比较 D组术中的HR和MAP均较C组低,同时波动较小,见图2、3。
2.3两组QoR-15量表评分比较 两组组内比较:与D1比较,D2、D3时QoR-15量表评分均升高,且D3高于D2,差异均有统计学意义(P<0.05)。组间比较:Pre时两组QoR-15量表评分无明显差异(P=0.06);D1、D2、D3时D组QoR-15量表评分均高于C组,D1、D2、 D3平均差值分别为[5.30,95%CI(7.58~3.02)]、[7.23,95%CI(9.47~5.00)]、[6.20,95%CI(8.29~4.11)],见表2。
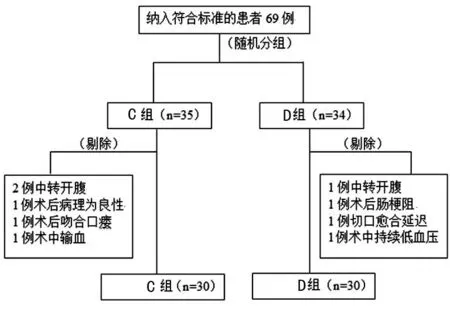
图1 研究流程图
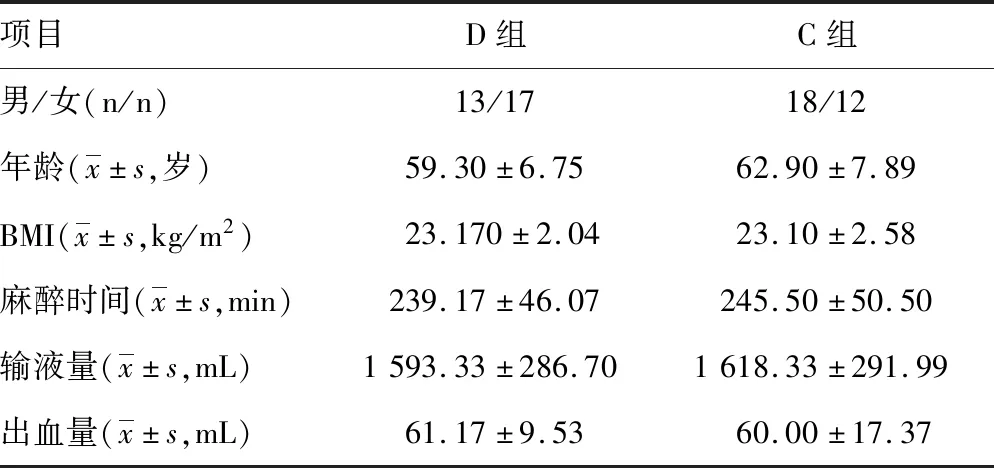
表1 两组一般资料比较(n=30)
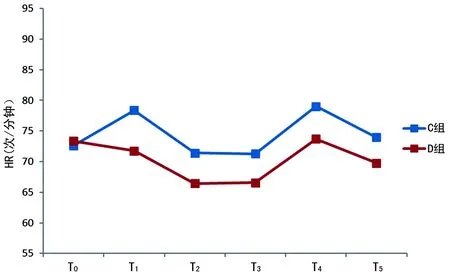
图2 两组不同时间点的HR
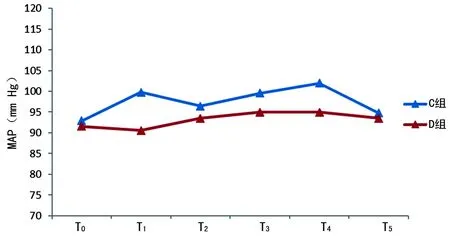
图3 两组不同时间点的MAP

表2 两组术前及术后QoR-15量表评分比较分)
a:P<0.05,与同组Pre时比较;b:P<0.05,与同组D1时比较;c:P<0.05,与同组D2时比较
2.4两组FSS及VAS评分比较 两因素重复测量方差分析结果显示,两组FSS和VAS评分情况,见表3、4。组间比较,在Pre、D1时点两组FSS和VAS评分比较,差异均无统计学意义(P>0.05)。D2、D3时D组的FSS和VAS评分均低于C组,差异有统计学意义(P<0.05)。

表3 两组术前及术后FSS比较分)
a:P<0.05,与同组Pre时比较;b:P<0.05,与同组D1时比较;c:P<0.05,与同组D2时比较

表4 两组术前及术后VAS评分比较分)
a:P<0.05,与同组Pre时比较;b:P<0.05,与同组D1时比较;c:P<0.05,与同组D2时比较
2.5两组术后镇痛、不良反应及住院时间比较 术后24、48 h镇痛泵按压次数D组较C组少;术后2 d,D组额外镇痛药物使用率低于C组;同时,D组术后寒战、恶心呕吐不良反应发生率也较C组低。D组术后平均住院时间较C组缩短,见表5。
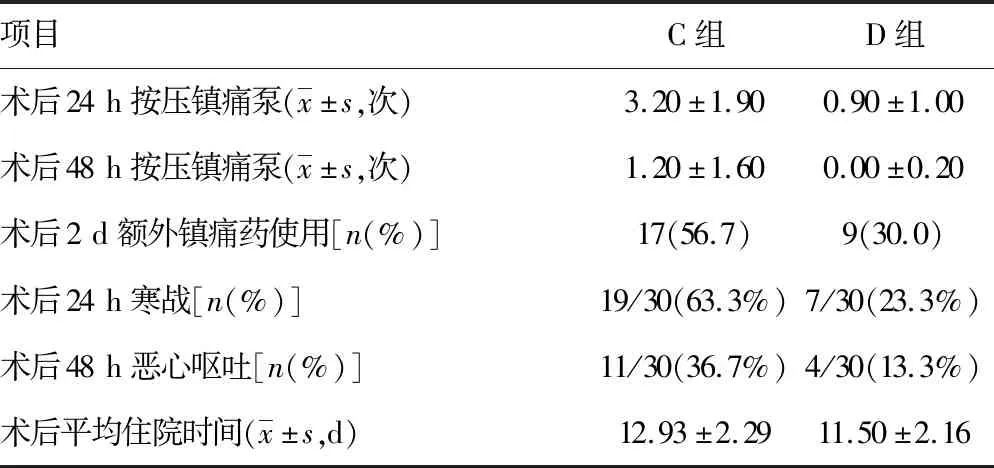
表5 两组术后镇痛、不良反应及住院时间比较(n=30)
3 讨 论
近年来结直肠癌的发病率逐渐升高,腹腔镜下手术治疗已经成为其手术治疗的主要方法。尽管外科技术和设备上的进步使得患者术后并发症、住院费用等减少。然而,手术引起的组织损伤仍会导致内分泌改变和炎性反应的激活,这些应激改变不利于术后的恢复。加速康复外科(ERAS)理念已经深入人心,麻醉医生是其中不可或缺的部分。研究表明,DEX作为全身麻醉的辅助药物,能起到抗炎、抑制应激反应的作用,具有器官保护的作用[6-7],这些优点增加了DEX在围术期麻醉管理中的应用。结合参考文献、临床经验和手术患者情况,本研究选择负荷剂量为0.5 μg/kg,维持剂量为0.2 μg·kg-1·min-1开始缝皮。
术后恢复结果不可量化,不能直接被观察到,是潜在的结果[2]。传统的术后恢复仅仅关注生理参数,而忽视了心理、精神方面。随着医疗技术和人们需求层次的提高,逐渐出现了包括生理、心理、精神等多方位的评估工具。它们的适用范围、评估时间、评估效度不尽相同,也说明术后恢复是一个多维度、复杂的概念。理想的术后评估工具包括两大特点:(1)能够用直观、简单的方式,如二分类变量来表示结果;(2)同时能在不同的时间点进行评估[8]。术后评估工具QoR-15量表包括5个方面,总分为150分,评价力度高,可重复性好,3 min可以完成量表,能够有效地反映术后康复,临床适用性强是其突出的优点[9]。此外,该量表切实关注了患者自身的感受,很好地体现了以患者为中心的医学形式。本研究显示,在麻醉期间辅用DEX能促进结直肠癌手术患者术后的早期恢复。这与DEX在围术期多个环节产生不同的作用息息相关。
稳定的血流动力学是重要脏器功能的保障,有助于手术患者的预后恢复能力。作者观察到DEX都能够明显减少伤害性刺激较大几个时间点的HR或MAP的升高,同时整个手术过程中,D组MAP波动较小。这说明术中使用DEX能够提供较好的血流动力学,与其他的研究结果相似[10-11]。
术后寒战、恶心呕吐及术后的疼痛,均是影响患者恢复的因素。DEX与α2B受体结合,钾离子内流增加引起神经细胞发生去极化,体温中枢敏感性降低及神经冲动传导减慢,降低术后寒战的发生[12]。此外DEX抑制了交感兴奋,儿茶酚胺分泌减少,这是其减少术后恶心呕吐发生的重要机制[13]。DEX镇痛机制复杂,目前认为可能在外周神经、蓝斑及脊髓3个水平通过不同的机制产生镇痛作用:(1)Aδ和C传入神经纤维被抑制,细胞超极化,阻滞外周疼痛信号的传递;(2)蓝斑抑制,突触前膜P物质释放减少,同时阻断背角伤害性信息的传导[14];(3)脊髓突触前后膜α2A受体与DEX结合,去甲肾上腺素释放的抑制和胆碱能神经的兴奋相协同减少了伤害性刺激[15]。本研究结果表明,DEX能够降低术后24 h寒战的发生率,减少术后48 h恶心呕吐的发生。
除上述因素外,围术期应激反应和炎性小体介导的炎性反应可引起免疫抑制,影响癌症患者的术后恢复。JIANG等[16]的Meta分析结果提示,使用DEX能够有效地降低神经外科手术患者血清白细胞介素(IL)-6、肿瘤坏死因子α(TNF-α)水平,同时对降低超氧化物歧化酶、皮质醇、血糖水平也有明显效果。肺癌根治术中使用DEX能明显降低促炎因子(IL-1β、IL-10、TNF-α)和丙二醛水平,同时升高髓过氧化物酶和黄嘌呤氧化酶含量[7]。这些研究指出,DEX还具有抗炎、抗氧化作用,相关机制如下:释放胆碱能递质α-7烟碱乙酰胆碱受体,兴奋迷走神经,抑制促炎因子IL-6、TNF-α等的释放[17];TLR4/MyD88/ERK1/2/NF-κB通路被抑制,促炎因子释放减少[18]。
疲劳是患者的自身感受,影响患者术后生活质量,是术后恢复不容忽视的一个指标,腹部大手术后更明显,其病因复杂[19]。本研究发现,C组术后第2、3天FSS高于D组,D组患者住院时间较C组缩短。在开腹妇科手术的临床研究中也观察到了类似的结果[20]。事实上,最近研究显示,炎性反应也是导致术后疲劳的关键机制[21],尤其是中枢神经炎性介质的活化和氧化应激反应的激活[19]。
麻醉诱导-维持-苏醒-术后并发症都影响着术后恢复质量。围麻醉期间的每个环节都该引起足够的重视,这样才能够保证患者术后的恢复质量。通过试验,观察到DEX能够提供稳定的血流动力学,能够减轻术后疲劳严重程度,减少术后并发症的发生,能够辅助术后镇痛、减少术后镇痛泵按压次数,有利于患者的术后恢复。尽管DEX有诸多优点,然而出现心动过缓、低血压的可能性不容忽略。另外,在临床使用中也发现部分患者可能出现苏醒延迟,尤其是同时使用了咪达唑仑。这也提示需要根据患者的具体情况,合理使用DEX。
