上调PTEN表达对血管紧张素Ⅱ诱导心肌成纤维化细胞增殖迁移的影响
2019-04-26封晓荣陈思宇张岁龙黄春春
封晓荣,陈思宇,张岁龙,黄春春
心血管疾病已成为继肿瘤之后威胁人们身体健康和生活质量的第二大疾病,我国每年心血管病患病率仍处于持续上升阶段,防治心血管疾病已是刻不容缓[1]。心肌纤维化是心血管疾病心肌重构的重要机制,而心肌成纤维化细胞的过度增殖和迁移是心肌纤维化形成的重要基础。因此,研究如何抑制心肌成纤维化细胞增殖和迁移对缓解心肌纤维化和治疗心血管疾病具有重要意义。PTEN是一种位于10q23.3染色体上抑癌基因,具有编码双重特异性磷酸酶产物的特性,参与细胞增殖、迁移、分化和凋亡等生物学行为,与包括心肌纤维化在内的多种疾病的发生关系密切[2]。肾素-血管紧张素系统过度激活可促进心肌纤维化和心肌重构,血管紧张素Ⅱ(Ang Ⅱ)是该系统的重要效应分子,可通过促进细胞外胶原纤维的合成和刺激心肌成纤维细胞增生等发挥促进心肌间质纤维化的作用[3]。大量研究[4-6]显示,PTEN在肺、肾和肝等纤维化形成过程中发挥着重要作用。近年来有研究[7]发现,PTEN与心肌梗死后心脏纤维化过程有关,但其对AngⅡ诱导的心肌成纤维细胞增殖迁移和胶原合成的影响并不完全清楚。因此,本研究通过转染真核表达载体获得PTEN高表达的心肌成纤维细胞,旨在探讨上调观察PTEN对AngⅡ诱导的心肌成纤维细胞增殖迁移和胶原合成的影响。
1 材料与方法
1.1 材料SPF级SD大鼠,1~3 d龄,购于西安动物实验中心。脂质体2000、pcDNA3.1-PTEN和阴性对照pcDNA3.1载体购于美国Invitrogen公司。AngⅡ和MTT试剂购于美国Sigma公司,胎牛血清购于美国Thermo公司,二甲基亚枫和DMEM培养基购于上海川翔生物公司,PTEN(1:200)特异性一抗购于美国Cell Signaling Technology公司,GAPDH抗体(1:1000)和二抗(辣根过氧化物酶标记,1:2000)购于美国Santa Cruz公司。细胞周期检测试剂盒和化学发光试剂盒购于上海碧云天公司,Ⅰ型胶原和Ⅲ型胶原ELISA试剂盒购于晶美公司,BCA蛋白定量检测试剂盒购于美国Pierce公司。Transwell小室购于美国Corning公司。
1.2 细胞培养取刚出生2 d的SD大鼠,开腔取左心室置于小烧杯中,加入胰蛋白酶制成匀浆。离心后,收集细胞沉淀,加入的DMEM培养基(含10%胎牛血清)获得细胞悬液,过150目筛网后,接种至含有培养基的培养瓶中,于饱和湿度、5%CO2和37℃的细胞培养箱中常规培养。根据细胞差速贴壁原理,培养1.5 h后,去培养液,附于瓶底的即为心肌成纤维细胞(经倒置显微镜观察和免疫组化波形蛋白染色鉴定证实)。加入含血清的培养基继续培养,每2 d换液,待细胞生长至汇合度达85%以上时,加胰蛋白酶消化传代,收集第3~5代细胞进行实验。
1.3 分组及处理实验分为空白对照组、AngⅡ组、AngⅡ+阴性对照(AngⅡ+NC组)和Ang II+PTEN组4组。各组细胞处理分别如下:空白对照组细胞不做任何处理;AngⅡ组细胞以浓度为1×106mol/L AngⅡ处理48 h;AngⅡ+NC组:以脂质体2000将pcDNA3.1转染至细胞后,给予相同浓度的AngⅡ处理48 h;AngⅡ+PTEN组细胞以脂质体2000将pcDNA3.1-PTEN转染至细胞后,给予相同浓度的AngⅡ处理48 h。取6孔细胞板,每孔接种100 μl浓度为6×106个/ml细胞悬液,于培养箱中常规培养过夜。次日,进行转染。按照上述分组,根据脂质体2000说明书将pcDNA3. 1-PTEN和pcDNA3.1转染至细胞中,转染后6 h。更换培养基,加入AngⅡ处理48 h。收集各组细胞进行后续实验。
1.4 PTEN蛋白表达的检测采用Western blot检测,加入细胞裂解液提取对照组、AngⅡ组、AngⅡ+PTEN组和AngⅡ+NC组细胞的总蛋白后,以蛋白定量试剂盒进行浓度的定量。取60 μg蛋白样品与等体积上样缓冲液混合后,上SDS-PAGE凝胶进行电泳分离,半干法转膜后,以封闭液常温封闭2 h。分别加入一抗(4℃,24 h)和二抗(37℃,1 h)孵育。以化学发光试剂盒显影曝光。凝胶成像系统拍照分析。以PTEN蛋白条带的灰度值与内参GAPDH条带的灰度值的比值表示PTEN蛋白的相对表达量。
1.5 细胞增殖能力检测采用MMT法检测。以每孔100 μl将浓度为5×106个/ml的心肌成纤维细胞悬液平铺于96孔板上,按照1.3中的分组处理细胞后,每组设6个平行孔,并重复3次。分别在处理24~72 h时间后,加入20 μl浓度5 g/l MTT溶液,反应4 h后,加入二甲基亚枫100 μl震荡至结晶体溶解。采用酶标仪检测各组细胞在450 nm处的吸光度值(OD)。
1.6 细胞周期检测采用流式细胞仪检测。收集AngⅡ处理48 h的各组细胞,加胰蛋白消化,制备单细胞悬液。每组设3个重复。严格按照细胞周期检测试剂盒说明书步骤操作,上流式细胞仪检测对照组、AngⅡ组、AngⅡ+PTEN组和AngⅡ+NC组细胞在G0/G1、S和G2/M期所占的百分比。
1.7 细胞迁移能力检测采用Transwell小室实验检测。取生长良好的对照组、AngⅡ组、AngⅡ+PTEN组和AngⅡ+NC组细胞,以胰酶消化后,制备单细胞悬液,向Transwell上室中加入100 μl浓度为1.0×104个/ml的细胞悬液,以无血清培养基饥饿培养,下室中加入含血清的500 μl培养基,培养24 h后,取出小室。轻轻擦去下室内的培养液,以PBS洗涤后,甲醇固定和结晶紫染色后。每张膜选取5个视野,显微镜观察各组的迁移细胞数,结果以五个视野细胞数的平均值表示。
1.8 胶原蛋白含量的检测ELISA检测Ⅰ和Ⅲ型胶原蛋白的含量。取24孔细胞板,调整细胞浓度后,以每孔5×105个/ml接种心肌成纤维细胞,培养至细胞融合度为80%左右时,按照1.3中的分组处理细胞。在AngⅡ作用48 h后,收集各组细胞上清液,以ELISA试剂盒检测各组细胞中Ⅰ和Ⅲ型胶原蛋白的含量。
1.9 统计学分析所有实验数据采用SPSS 21.0软件进行分析,计量资料用(±s)表示,多组差异比较采用单因素方差分析,组间两两比较采用SNK-q检验,以P<0.05为差异有统计学意义。
2 结果
2.1 各组心肌成纤维细胞中PTEN蛋白的表达Western blot检测空白对照组、AngⅡ组、AngⅡ+NC组和AngⅡ+PTEN组细胞中PTEN蛋白的相对表达量分别为1.00±0.07、0.48±0.05、0.52±0.06和0.76±0.05,4组细胞中PTEN蛋白的相对表达量整体比较差异具有统计学意义(F=51.556,P=0.000)(图1)。与空白对照组相比,AngⅡ组、AngⅡ+NC组和AngⅡ+PTEN组细胞中PTEN蛋白表达水平均降低(P<0.05),而AngⅡ+PTEN组较AngⅡ组和AngⅡ+NC组升高(P<0.05),AngⅡ组与AngⅡ+NC组间差异无统计学意义(P>0.05)。转染pcDNA3.1-PTEN表达载体成功上调了AngⅡ下调的PTEN表达。
2.2 各组心肌成纤维细胞增殖结果成功上调PTEN表达后,采用MTT法检测其对AngⅡ诱导的心肌成纤维细胞增殖的影响(表1)。AngⅡ处理24 h、48 h和72 h后,心肌成纤维细胞的增殖能力较空白对照组升高,而成功上调PTEN表达后心肌成纤维细胞的增殖受到抑制,差异具有统计学意义(P<0.05)。可见,上调PTEN表达可抑制AngⅡ诱导的心肌成纤维细胞增殖。
2.3 各组心肌成纤维细胞周期的进展流式细胞仪检测各组细胞的周期变化(表2)。与空白对照组相比,AngⅡ组、AngⅡ+NC组和AngⅡ+PTEN组中G0/G1期细胞比例均降低,而S期和G2/M期细胞比例均升高,差异具有统计学意义(P<0.05);与AngⅡ组相比,AngⅡ+PTEN组中G0/G1期细胞比例均升高,而S期和G2/M期细胞比例降低,差异具有统计学意义(P<0.05);AngⅡ+NC组与AngⅡ组比较各时相细胞比例差异无统计学意义(P>0.05)。可见,上调PTEN表达阻断了AngⅡ诱导心肌成纤维细胞周期进展。
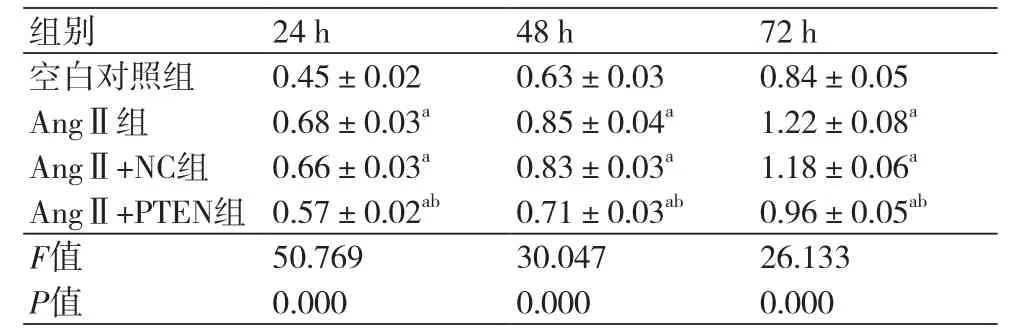
表1 不同时间下各组细胞的OD值(x ±s,n=3)
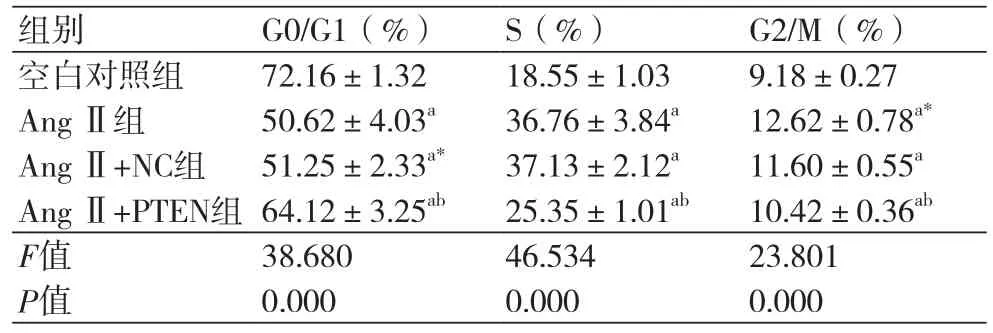
表2 各组细胞的周期变化(x ±s,n=3)
2.4 各组心肌成纤维细胞迁移结果采用Transwell小室检测上调PTEN表达后对AngⅡ诱导的心肌成纤维细胞迁移的影响(表3)。AngⅡ组、AngⅡ+NC组和AngⅡ+PTEN组细胞迁移细胞数较空白对照组均升高(P<0.05),同时,与AngⅡ组相比,AngⅡ+NC组的迁移细胞数差异无统计学意义(P>0.05),但AngⅡ+PTEN组的迁移细胞数降低(P<0.05)。上调PTEN表达可明显抑制AngⅡ诱导的心肌成纤维细胞迁移。
2.5 各组心肌成纤维细胞中Ⅰ和Ⅲ型胶原蛋白的含量进一步观察各组细胞上清液中Ⅰ和Ⅲ型胶原蛋白含量,见表4。经AngⅡ处理后,心肌成纤维细胞中Ⅰ和Ⅲ型胶原蛋白含量均升高(P<0.05)。在转染pcDNA3.1-PTEN表达载体后再给予AngⅡ处理,降低了细胞中Ⅰ和Ⅲ型胶原蛋白含量(P<0.05),但转染pcDNA3载体并未影响AngⅡ处理后细胞中Ⅰ和Ⅲ型胶原蛋白的含量(P<0.05)。
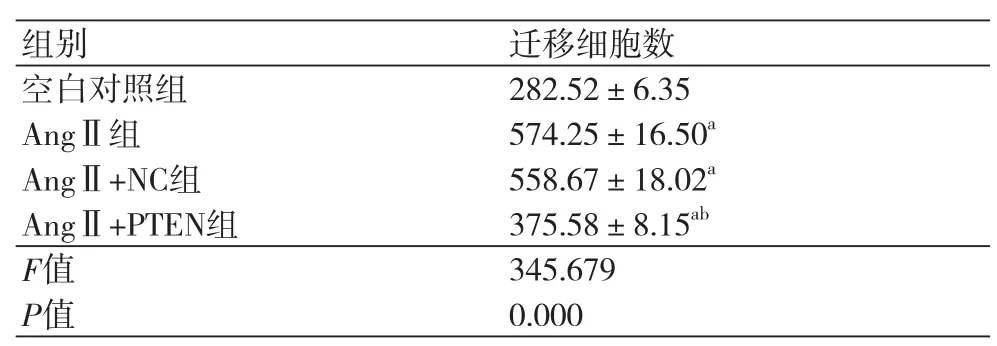
表3 各组细胞的迁移细胞数(x ±s,n=3)
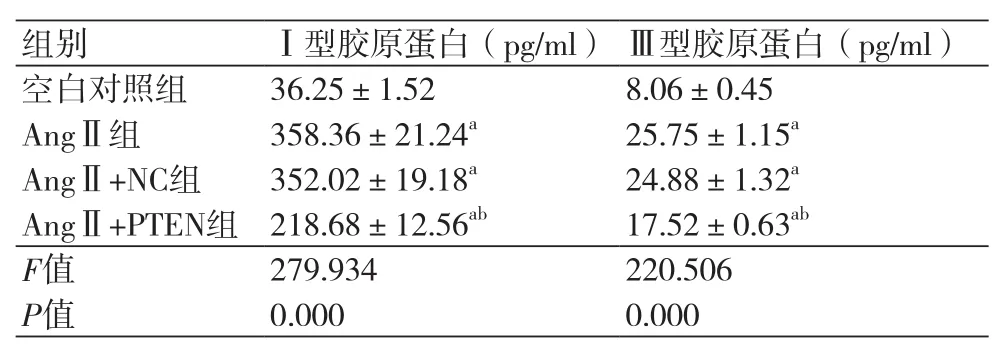
表4 各组细胞中Ⅰ和Ⅲ型胶原蛋白的含量(x ±s,n=3)
3 讨论
PTEN作为抑癌基因,在多种肿瘤组织中异常低表达或缺失,已被证实与肿瘤如结直肠癌、乳腺癌和胃癌等发生与发展关系密切[8-10]。除肿瘤领域外,学者们还发现PTEN在多种组织的纤维化过程中发挥着主要作用。如Parapuram等[11]发现,皮肤成纤维细胞中PTEN表达的缺失促进了皮肤纤维化过程;Zhou等[12]指出,抑制PTEN活性加重了缺血再灌注诱导的急性肾损伤小鼠的肾纤维化。Li等[13]发现,上调PTEN的表达可减少α-平滑肌肌动蛋白的分泌,进而阻止肝纤维化的进展。在缺氧条件下心肌成纤维细胞PTEN表达逐渐减少,与缺氧诱导的心肌成纤维细胞增殖密切相关[14]。近年来有研究[7]发现,PTEN可能参与心肌梗死后心脏纤维化过程,但其对促纤维化因子AngⅡ诱导的心肌成纤维细胞增殖迁移和胶原合成的影响并不完全清楚。
有报道[15,16]显示,AngⅡ处理后,血管平滑肌细胞在G0/G1百分比降低,在S和G2/M期百分比升高,细胞增殖和迁移能力增强;此外,AngⅡ可使肾小管上皮细胞阻滞在G2/M期,加快肾纤维化过程[17]。另外有报道称[18],上调PTEN表达后,口腔鳞癌细胞增殖和侵袭能力明显减弱,同时G0/G1期的细胞数比例明显增加,而S期和G2/M期的细胞数比例明显减少。为了探讨心机纤维化过程中,PTEN对促纤维化因子AngⅡ诱导的心肌成纤维细胞增殖迁移的影响,本研究首先通过AngⅡ处理体外培养的心肌成纤维细胞,构建心肌纤维化细胞模型。采用Western blot检测心肌成纤维细胞中PTEN蛋白的表达发现,AngⅡ能够引起心肌成纤维细胞中PTEN表达降低,以脂质体2000转染pcDNA3.1-PTEN真核表达载体后,成功上调了PTEN表达。MTT和Transwell小室检测上调PTEN表达对心肌成纤维细胞增殖和迁移的影响。结果发现,AngⅡ处理后,心肌成纤维细胞增殖和迁移能力明显增强。这一结果与ZOU等[19]研究发现的AngⅡ通过激活自噬诱导CFs增殖及迁移结果相吻合。进一步采用流式细胞仪检测细胞的周期变化发现,AngⅡ处理后,心肌成纤维细胞在G0/G1期比例降低,S期和G2/M期比例升高;成功上调PTEN后逆转了AngⅡ诱导的心肌成纤维细胞增殖,周期进展和细胞迁移。提示,上调PTEN可能通过阻断AngⅡ促使心肌成纤维细胞从G0/G1进入S期的进展进而抑制细胞增殖。除心肌成纤维细胞过度增殖外,胶原蛋白的大量合成也是心肌纤维化的重要病理特征。本研究进一步检测发现,上调PTEN表达后,可明显遏制AngⅡ引起的胶原蛋白Ⅰ和Ⅲ含量的升高。这一结果反向印证了韩景舒等发现的PTEN低表达可上调胶原蛋白Ⅰ和Ⅲ表达的结果。提示,PTEN可能通过促进胶原蛋白的降解,抑制了心肌纤维化的进程。
综上所述,PTEN在AngⅡ诱导心肌成纤维化细胞中表达下降,上调其表达可抑制Ang II诱导心肌成纤维化细胞增殖迁移和胶原蛋白的合成。这一结果丰富了心肌纤维化的分子机制,为以PTEN为靶点的心肌纤维化和心血管疾病的治疗提供了参考依据。本研究初步探讨PTEN在心肌成纤维细胞生长过程中的调控作用,但其PTEN抑制成纤维化增殖、迁移和胶原蛋白合成的具体机制还有待更深入的研究。
