艾烟可吸入物对大鼠神经细胞氧化损伤的影响
2019-04-25李丹俞云李圆君惠鑫王昊韩丽王晶赵百孝
李丹 俞云 李圆君 惠鑫 王昊 韩丽 王晶 赵百孝
摘要:目的 探讨艾烟可吸入物(PM10)对大鼠神经细胞氧化损伤的影响及PI3K/Akt信号通路在其中的作用。方法 采用24 h内新生SD大鼠乳鼠前额叶皮质及海马组织体外培养原代神经细胞,H2O2诱导建立氧化损伤细胞模型;随机分为空白组、氧化损伤组、氧化损伤+PM10组、氧化损伤+PM10+抑制剂组、PM10组。采用TUNEL和DAPI染色观察神经细胞凋亡形态;MTT法及Western blot分别检测细胞存活率及目的蛋白表达,并用PI3K/Akt通路抑制剂LY294002验证作用通路。结果 MTT检测显示,200 μmol/L H2O2能降低神经细胞50%存活率(P<0.001),0.1、0.5 ng/mL艾烟PM10能明显抑制H2O2诱导氧化损伤的神经细胞凋亡(P<0.001);TUNEL和DAPI染色显示,0.5 μg/mL艾烟PM10能拮抗H2O2诱导氧化损伤神经细胞凋亡的形态学变化(P<0.001);Western blot检测显示,H2O2及LY294002能降低p-Akt、Bcl-2的表达(P<0.05,P<0.001),上调active-Caspase-3的表达(P<0.01,P<0.001),而艾烟PM10作用相反(P<0.01,P<0.001)。结论 艾烟PM10能减少神经细胞氧化应激的凋亡,其机制可能是激活PI3K/Akt信号通路并调控下游凋亡蛋白Bcl-2、active-Caspase-3的表达,拮抗细胞凋亡。
关键词:艾烟PM10;过氧化氢;细胞凋亡;PI3K/Akt信号通路;大鼠
中图分类号:R245 文献标识码:A 文章编号:1005-5304(2019)04-0042-05
氧化应激是指活性氧簇(ROS)的生成和清除失平衡状态,这一病理过程与许多疾病发生发展密切相关。艾烟可吸入物(PM10)是传统中医灸法的燃烧产物,含有多种生物活性成分[1-2],具有抗氧化应激、抗自由基、杀菌等作用[3-8]。近年研究表明,艾烟能激活PI3K/Akt信号转导通路,从而产生作用[9]。相关研究表明,激活PI3K/Akt信号转导通路可抑制H2O2引起的氧化损伤,从而延缓疾病的发生发展[10]。本实验采用H2O2诱导建立原代神经元氧化损伤模型,予艾烟PM10预处理,观察其对H2O2介导神经元损伤的保护作用,并通过加入PI3K/Akt信号通路阻断抑制剂LY294002阐明其作用机制。
1 实验材料
1.1 动物
新生1日龄SD大鼠乳鼠3只,北京大学医学部实验动物中心提供,动物许可证号SCXK(京)2016-0006。所有乳鼠饲养于SPF级动物室,室温20~25 ℃,相对湿度60%~80%,保持通风,定时换气,每日光照12 h。
1.2 主要试剂与仪器
MTT、DAPI、多聚赖氨酸溶液(美国Sigma公司),TUNEL试剂盒(美国CST公司),MEM EARLES(美国Invitrogen公司),谷氨酰胺、B27(美国Invitrogen公司),阿糖胞苷(美国Sigma公司),胎牛血清、马血清、胰蛋白酶(美国Invitrogen公司),Bcl-2抗体、active-Caspace-3抗体(美国Invitrogen公司),p-Akt和T-Akt抗体(美国Invitrogen公司),LY294002(美国CST公司)。CKX41-倒置显微镜(日本Olympus公司),5417R高速冷冻离心机(德国Eppendodf公司),荧光/吸收光酶标仪(美国Therm公司),Tanon4200化学发光成像仪(上海天能)。
2 实验方法
2.1 艾烟可吸入物制备
实验用艾条为南阳汉医艾绒有限责任公司三年蕲艾条。将艾绒置于玻璃箱中点燃,将Mini VolTM PM10便携式采样器置于玻璃箱中采集烟雾,吸附在剑桥滤片上。采样前后剑桥滤片的质量差即为采集的艾燃烧产物的质量。用DMSO溶解PM10制成终浓度为100 mg/mL的艾燃烧生成物原溶液,除菌过滤并避光存储于-80 ℃冰箱备用。每次实验前用培养液稀释至所需浓度(DMSO浓度≤1%)。
2.2 分组和造模
实验随机分为空白对照组、氧化损伤组、氧化损伤+PM10组、氧化损伤+抑制剂+PM10组、PM10组。原代神经元培养:从新生SD大鼠分离海马及前额叶脑组织,0.25%胰蛋白酶消化、离心细胞并重新悬浮。将细胞铺覆在用多聚赖氨酸涂覆的板上,培养2~4 h,2%马血清、2%B27和1%GlutaMAX MEM EARLES继续培养,3 d后10 nmol/L阿糖胞苷处理细胞抑制胶质细胞生长。用前细胞培养7~8 d。
2.3 干预
培养7 d后,不同浓度PM10(自制)加入到原代神经细胞培养基24 h,或用200 μmol/L H2O2处理神经元24 h构建神经细胞氧化应激损伤模型。在研究药物作用通路的实验中,用Akt抑制剂LY294002(终浓度10 μmol/L)提前处理细胞30 min。再用PM10处理细胞。
2.4 指标检测
2.4.1 MTT法检测细胞存活率
给药后继续孵育细胞24 h,之后每孔加入MTT(終浓度0.5 ng/mL),于37 ℃、5%CO2培养箱中避光继续孵育24 h,吸去培养液,每孔加入150 μL DMSO液,待孔内颗粒完全溶解后,酶标仪570 nm处测定各孔吸光度,计算各组细胞存活率[细胞吸光度-空白孔吸光度)÷(对照组细胞吸光度-空白孔吸光度)×100%]。
2.4.2 TUNEL法检测细胞凋亡
4%PFA和4%蔗糖在PBS中固定细胞30 min,PBS洗涤后,加入0.1%Triton X-100和0.1%柠檬酸钠的PBS冰育2 min。用PBS洗涤2次后加适量TUNEL检测液,37 ℃避光孵育60 min,PBS洗涤后加适量DAPI,37 ℃避光孵育60 min,PBS洗涤3次。用抗荧光淬灭封片液封片后荧光显微镜下观察。TUNEL染色细胞凋亡的细胞核为绿色荧光,DAPI染色细胞核为蓝色荧光。细胞凋亡百分率通过计算比值来确定。TUNEL阳性细胞数在1个计数中共100个细胞。取5個计数的平均值为神经元细胞死亡的百分比。
2.4.3 Western blot检测蛋白表达
各组按实验设计给药后继续孵育细胞24 h,洗涤后裂解细胞,冰上反应30 min,离心,取上清液。BCA法测定各组蛋自浓度,将每个样品蛋白浓度调成一致,10%SDS-PAGE分离蛋自质,PVDF转膜后奶粉封闭30 min,一抗(1∶1000)孵育过夜(4 ℃),TBST洗3~5次,二抗(1∶1000)室温孵育1 h,TBST漂洗,化学发光成像仪检测蛋白表达量。
3 统计学方法
采用SPSS17.0统计软件进行分析。实验数据以x(—)±s表示,两组间进行独立本t检验。检验水准α=0.05。
4 结果
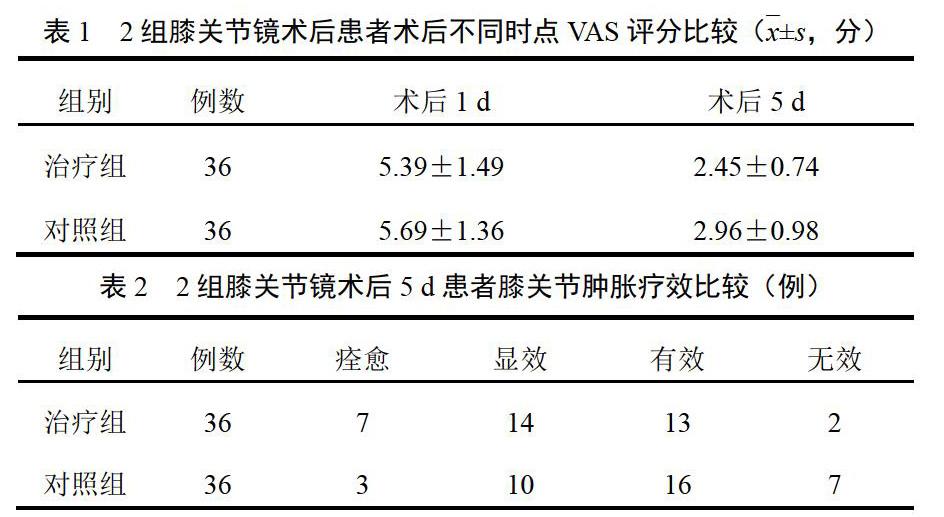
4.1 MTT检测结果
与空白对照组比较,氧化损伤组细胞存活率明显降低(P<0.001),表明造模成功。加入0.1、0.5 ng/mL PM10能提高氧化损伤细胞的存活率,与氧化损伤组比较差异有统计学意义(P<0.01,P<0.001)。另外,相同浓度PM10组较空白对照组细胞存活率略高(P<0.05),表现出一定浓度PM10对细胞凋亡的保护作用。提示PM10对H2O2诱导神经细胞的氧化应激损伤具有抑制作用。结果见图1。
4.2 TUNEL和DAPI染色结果
相近细胞数目情况下,氧化损伤组较空白对照组细胞凋亡率明显增加(P<0.01)。氧化损伤+PM10组较氧化损伤组细胞凋亡率下降(P<0.001)。提示PM10对H2O2诱导神经细胞凋亡损伤有抑制作用。结果见图2、图3。
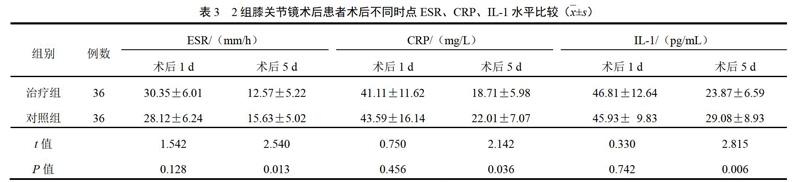
4.3 Western blot检测结果
与空白对照组比较,氧化损伤组细胞p-Akt蛋白表达量明显下降(P<0.001);与氧化损伤组比较,氧化损伤+PM10组神经细胞p-Akt蛋白表达量明显增加(P<0.01);加入PI3K/Akt通路抑制剂LY294002后,与氧化损伤+PM10组比较,PM10这种拮抗作用消失(P<0.05),提示PI3K/Akt信号通路参与了PM10拮抗H2O2诱导的神经细胞损伤的保护作用。结果见图4。
与氧化损伤组比较,氧化损伤+PM10组细胞Bcl-2表达明显增加(P<0.001),而加入PI3K/Akt通路抑制剂LY294002后,与氧化损伤+0.5 ng/mL PM10组比较,PM10拮抗作用消失(P<0.05),提示PI3K/Akt信号通路及其调控的凋亡蛋白Bcl-2参与了PM10拮抗H2O2诱导的神经细胞损伤的保护作用。结果见图5。
与氧化损伤组比较,氧化损伤+PM10组神经细胞active-Caspase-3表达量下调(P<0.01),而加入PI3K/Akt通路抑制剂LY294002后,与氧化损伤+0.5 ng/mLPM10组比较,PM10拮抗作用明显减弱(P<0.01),提示PI3K/Akt信号通路及其调控的凋亡蛋白active-Caspase-3参与了PM10拮抗H2O2诱导的神经细胞损伤的保护作用。结果见图6。
5 讨论
氧化应激是指细胞暴露于高浓度氧分子或氧的化学衍生物而引起的细胞损伤。生理条件下的ROS物质能刺激细胞生长,抗氧化系统与其抗衡,当平衡状态被破坏,自由基等大量聚集,引起人体脂质过氧化及蛋白质等变性,导致细胞膜的流动性和通透性发生改变,最终导致细胞结构和功能改变[11]。
H2O2是一种易于获得的重要ROS,性质相对稳定,极易透过细胞膜,与细胞内铁离子通过FENTON反应形成高活性的自由基,导致一系列反应,已成为研究各类细胞氧化损伤的重要工具[12]。故本实验选择H2O2处理神经细胞建立氧化应激损伤模型,并通过MTT检测细胞存活率来验证造模是否成功。
氧化应激是许多疾病的诱发因素和病理过程[12],与心脑血管疾病的发生发展息息相关,是阿尔茨海默病的病因假说。因此,缓解细胞组织的氧化应激损伤无疑成为一种有效防治这类疾病的潜在方案。目前许多在体实验已经证实艾烟能减缓阿尔茨海默病氧化应激损伤,从而防治其发生发展[13-15]。本实验采用神经元原代培养方法,采用MTT、DAPI和TUNEL方法检测细胞损伤情况,Western blot验证作用通路相关蛋白,实验结果显示终浓度为200 μmol/L H2O2处理组细胞存活率为50%左右,与正常对照组比较,差异有统计学意义(P<0.01,P<0.001)。0.5 ng/mL PM10预先干预氧化损伤细胞,可显著减少细胞凋亡,与氧化损伤组比较,差异有统计学意义(P<0.001),与Western blot结果一致。实验发现PM10作用于氧化损伤细胞,激活PI3K/Akt信号通路,增加p-Akt、Bcl-2下游蛋白表达,并抑制active-Caspase3的表达(P<0.01,P<0.001),当加入Akt通路阻断剂LY294002后,各相关蛋白结果相反,证实了其作为通路之一为PI3K/Akt信号通路的假设。
艾灸已被用于治疗各种类型的疾病,但仍无足够的证据直接证明其有效性。本实验首次证明了PM10对神经细胞氧化诱导凋亡的保护作用,特别是对阿尔茨海默病相关细胞的影响,结果可作为证明艾灸有效性的证据之一,其中艾烟也被验证成为艾灸起效的关键因素,同时为治疗阿尔茨海默病提供潜在防治方案,而PM10起效浓度、混合物的纯化及相关研究仍需进一步深入完善。
参考文献:
[1] ZHOU C L, FENG X M, WANG J H, et al. Research advance on moxa smoke[J]. Journal of Acupuncture and Tuina Science,2011,9(2):67-72.
[2] YU M, JIN R, ZHAO B, et al. SPME-GC-MS determination of phenol in the smoke of moxa[J]. Chinese Journal of Pharmaceutical Analysis,2012,32(10):1870-1873.
[3] XU H, ZHAO B, CUI Y, et al. Effects of moxa smoke on monoamine neurotransmitters in SAMP8 mice[J]. Evid Based Complement Alternat Med,2013,2013:178067.
[4] HUANG J, LIN M Y, ZHAO B, et al. PM10 mass concentration and oxidative capacity of moxa smoke.[J]. Qjm,2015,108(9):705-710.
[5] HITOSUGI N, OHNO R, HATSUKARI I, et al. Diverse biological activity of Moxa extract and smoke[J]. Vivo,2001,15(3):249-254.
[6] SAKAGAMI H, MATSUMOTO H, SATOH K, et al. Cytotoxicity and radical modulating activity of Moxa smoke[J]. Vivo,2005,19(2):391-397.
[7] MATSUMOTO H, SHIMADA J, NAGASAKA H, et al. Inhibition by Moxa smoke of NO production and iNOS expression in mouse macrophage- like cells Raw 264.7[J]. Vivo,2005,19(2):471.
[8] MENG X N, HUAN-FANG X U, CUI Y X. Effect of moxa products after burning on SOD, MDA and GSH-Px in the brain of senescence accelerated mice[J]. Global Traditional Chinese Medicine,2011, 4(6):413-415.
[9] 劉耀萌,刘钧天,黄畅,等.不同艾灸因素对阿尔茨海默小鼠PI3K/AKT通路与皮质β淀粉样蛋白沉淀的影响[J].世界中医药,2016,11(8):1395-1400.
[10] 苏倩.Akt信号通路通过激活TFEB而抑制氧化应激诱导的神经细胞凋亡[D].石家庄:河北医科大学,2017.
[11] 朱若岑,蒋维维,谭柱良,等.动物体内活性氧、氧化应激与细胞凋亡以及抗氧化剂研究进展[J].中兽医医药杂志,2015,34(3):21-25.
[12] 塔依尔·吐尔松,买吾拉尼江·依孜布拉,努尔买买提·艾买提.神经退行性疾病的抗氧化研究进展[J].新疆医科大学学报,2017,40(6):725-729.
[13] 刘钧天,黄畅,刘耀萌,等.艾灸各因素对APP/PS-1双转基因AD小鼠脑中DNA、蛋白质、脂质氧化应激的影响[J].中华中医药杂志,2015, 40(5):1375-1379.
[14] 蔡虹,邬继红,赵百孝,等.艾烟冷凝物对大鼠肺泡巨噬细胞NR8383活性和吞噬功能的影响[J].北京中医药大学学报,2013,36(7):501- 504.
[15] 黄畅,崔莹雪,刘钧天,等.艾灸及艾烟对载脂蛋白E基因敲除小鼠血清MDA、SOD水平的影响[J].世界中医药,2016,11(8):1407-1409,1413.
(收稿日期:2018-11-14)
(修回日期:2018-12-01;编辑:华强)
