大黄素在石墨烯/聚多巴胺/金复合纳米材料修饰电极上的电化学行为及测定
2019-04-25李姝梅
兰 慧, 阳 敬, 张 郴, 李姝梅
(红河卫生职业学院,云南蒙自 661199)
大黄为蓼科植物唐古特大黄、掌叶大黄或药用大黄的干燥根及根茎,它主要含有蒽醌类、鞣类、二苯乙烯类、苯丁酮类等多种化学成分。从大黄中分离出的蒽醌类化合物主要有芦荟大黄素、大黄酸、大黄素、大黄酚和大黄素甲醚等[1]。大黄中所有化学成分几乎都具有多种药理活性[2 - 3]。其中,大黄素又称朱砂莲甲素,具有抗菌、抑制免疫、解痉、止咳、抗癌等药理作用[4]。目前,大黄素的分析方法主要有分光光度法[5]、高效液相色谱法[6]、薄层色谱法[7]等。电化学方法因其仪器设备简单,操作简便,低成本和灵敏度高已被广泛应用于实际样品的检测[8]。
纳米材料具有良好的导电性及生物相容性,已经被广泛应用于生物传感器的构建中。石墨烯具有特殊的结构和优异的力学、电学、光学及催化性能,在纳米电子学、微电子学、储能材料以及复合材料等领域具有广泛的应用前景,同时由于这种碳纳米材料具有良好的导电性及生物相容性,已经被广泛应用于生物传感器的制备及电催化领域。但是石墨烯容易聚集,因此对其进行有效的功能化修饰非常重要[9]。聚多巴胺(PDA)是贝壳、蚌等生物分泌的粘性蛋白的主要成分,具有极强的粘附性,能稳定地固定在各种基质上。Lee等[10]以多巴胺(DA)为单体,通过简单的自聚合反应在各种基质表面形成了仿生PDA膜,该膜不仅具有良好的粘附性,同时保持了原有单体良好的生物相容性,被广泛地应用于对Au和Pt纳米颗粒、碳纳米管、石墨烯氧化物的表面修饰。DA特有的还原性可以作为氧化石墨烯(GO)的还原剂。PDA良好的粘附性和生物相容性又可以作为石墨烯(GNs)的保护剂。
本文利用PDA膜对基底极强的结合力及其良好的生物活性,通过一步反应法合成具有仿生功能的GNs/PDA纳米复合材料,并将其作为基底材料将HAuCl4原位还原为Au纳米粒子负载在GNs/PDA纳米复合材料表面,将其用于构建电化学传感器用于检测大黄素,实现了大黄素的快速检测。
1 实验部分
1.1 仪器与试剂
CHI660D电化学工作站(上海辰华仪器有限公司);DZF-6050真空干燥箱(上海-恒科仪器有限公司);CP213电子天平(奥豪斯仪器(上海)有限公司);SK5200HP超声波清洗器(上海科特超声仪器有限公司);AMI202-H数显电动搅拌机(上海昂尼仪器);TG18-WS离心机(上海岛析实业有限公司)。
大黄素对照品(批号:20131121)购自国药集团上海化学试剂有限公司,大黄对照药材(批号:20130909)购自国药集团上海化学试剂有限公司;石墨烯(GNs),阿拉丁试剂有限公司;HCl、柠檬酸三钠、NaBH4、HAuCl4、三羟甲基氨基甲烷(Tris)、甲醇为分析纯,其它所用试剂均为分析纯。水为二次蒸馏水。
1.2 实验部分
1.2.1GNs/PDA复合材料的制备采用Hummers’方法[8]制备氧化石墨烯(GO)。称取60 mg GO,溶于80 mL 水中,超声分散2 h后加入40 mg DA,冰浴超声30 min,搅拌下加入40 mL 12.5 mmol·L-1Tris-HCl缓冲溶液(pH=8.5),于80 ℃水溶反应48 h,用水离心清洗数次直到除去多余的DA,产物溶于水中[11]。为了对比,本文还参考文献方法制备了还原石墨烯纳米材料[12 - 13]。
1.2.2GNs/PDA/Au复合纳米材料的制备参考文献报道的方法[14]制备GNs/PDA/Au复合纳米材料。具体方法如下:取1 mL 10 mg·mL-1GNs/PDA纳米复合物,加入10 mg(0.5 mL 20 mg·mL-1)HAuCl4和14.705 mg柠檬三酸钠,整个溶剂的体积为40 mL,冰浴超声30 min,加入0.6 mol·L-1NaBH4,搅拌30 h后,用水离心清洗后,备用。
1.2.3传感器构建先将玻碳电极(GCE,直径为3 mm)依次用1.0、0.3和0.05 μL的Al2O3粉末在麂皮上抛光成镜面,然后分别在1.0 mol·L-1HNO3、无水乙醇和水中各超声清洗1 min,室温晾干。移取7 μL 制备好的GNs/PDA/Au复合纳米材料滴涂在GCE表面,室温晾干保存,备用。
1.2.4电化学测试采用三电极体系,修饰电极为工作电极,Ag/AgCl(饱和KCl)电极为参比电极,铂丝电极为对电极,整个实验在B-R缓冲溶液中进行,循环伏安实验的电位区间为-0.8~0.2 V,扫描速率为50 mV·s-1。
1.2.5样品的提取称取大黄粉末0.5 g,加甲醇100 mL,浸泡1 h,滤过,取滤液25 mL,蒸干,残渣加水50 mL 使溶解,再加HCl 5 mL,加热回流30 min,立即冷却,用乙醚分两次振摇提取,每次20 mL,合并乙醚液,蒸干,三氯甲烷溶解,置于50 mL容量瓶中,并用三氯甲烷溶解并稀释至刻度,摇匀,置于4 ℃下保存,备用。
2 结果与讨论
2.1 紫外-可见光谱表征
如图1所示。GO在波长230 nm处有最大吸收峰(图1曲线b),GNs的吸收峰较GO红移了33 nm(图1曲线c),表明GO已被成功的还原为GNs。从图1中曲线a可以看出,DA在280 nm处有最大吸收峰,GNs/PDA在267 nm处有一个强的紫外的吸收峰(图1曲线d),这是由于GNs与PDA之间的相互作用力所致。GNs/PDA/Au复合纳米材料在562 nm处出现了一个新的吸收峰(图1曲线e),这个峰是Au纳米的紫外吸收峰。结果表明成功制备了GNs/PDA/Au复合纳米材料。
2.2 X射线衍射分析(XRD)
采用pert3 powder型X射线衍射仪对GNs、GNs/PDA和GNs/PDA/Au复合纳米材料进行XRD表征。从图2a可以看出GNs在2θ=22.19° 附近出现一个新的宽衍射峰,这是由于化学还原后,移除了GO表面大量的含氧功能基团,使得层与层之间的晶面间距减小。同时GNs的衍射峰变宽,峰强大大减弱,这是由于还原后,石墨片层尺寸更加缩小,晶体结构完整性进一步被破坏,无序度增加。图2b是GNs/PDA的XRD图,可以看到在2θ为24.9°出现一个宽的衍射峰,与单纯GNs的衍射峰形类似,表明GNs表面已成功的被聚多巴胺膜包裹。图2c为GNs/PDA/Au的XRD图,其晶格衍射峰位置(2θ)分别为38.20°、44.46°、64.56°、77.52°和81.70°,分别对应Au纳米粒子的(111)、(200)、(220)、(311)和(222)晶面,这个结果与文献报道[9]的Au纳米粒子的XRD特征峰吻合。GNs/PDA/Au的XRD峰中GNs/PDA的XRD特征峰很不明显,可能是因为Au纳米粒子在GNs/PDA的表面负载密度太高,而掩盖了GNs/PDA的峰。
2.3 GNs/PDA/Au的扫描电镜(SEM)和透射电镜(TEM)表征
采用SEM和TEM对制备的GNs/PDA/Au复合纳米材料进行形貌表征。从图3A中可以看出许多的Au纳米粒子均匀的分散在GNs/PDA表面,只有少量的Au纳米粒子有团聚现象,这可能是由于PDA作为一个良好的保护剂和连接剂有利于Au纳米粒子的均匀负载。从图3B中可以看出Au纳米粒子的平均粒径约为40 nm,从图中还明显的看出了GNs/PDA的膜状结构,结果表明本文成功制备了GNs/PDA/Au复合纳米材料。

图1 DA(a)、GO(b)、GN(c)、GN/PDA(d)和GN/PDA/Au(e)的紫外-可见(UV-Vis)光谱图Fig.1 UV-Vis spectra of DA(a),GO(b),GN(c),GN/PDA(d) and GN/PDA/Au(e)
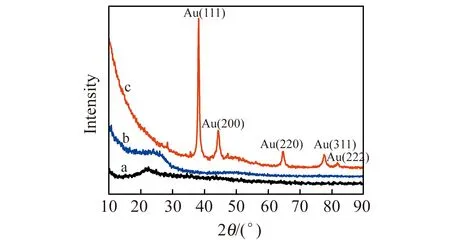
图2 GNs(a)、GNs/PDA(b)和GNs/PDA/Au(c)的X射线衍射(XRD)图Fig.2 XRD of GNs(a),GNs/PDA(b) and GNs/PDA/Au(c)

图3 GNs/PDA/Au的扫描电镜(SEM)图(A)和透射电镜(TEM)图(B)Fig.3 SEM image(A)and TEM (B)of GNs/PDA/Au
2.4 大黄素的电化学行为
考察不同材料修饰的GCE在含有22.2 μmol·L-1的大黄素的pH=5.33的B-R溶液中的循环伏安行为(图4)。从图中可以看出,GNs修饰的电极(曲线a)和GNs/PDA修饰电极(曲线b)在含大黄素的B-R 缓冲溶液中无电化学响应,GNs/PDA/Au修饰的电极(曲线c)在-0.7~0.1 V之间有一对较好的可逆氧化还原峰,其中还原峰电位为-0.154 mV,氧化峰电位为:-0.576 mV,其电位差ΔEp为421 mV,这对氧化还原峰可能来源于大黄素中两个羰基的氧化[15]。实验结果说明GNs/PDA/Au复合纳米材料对大黄素的检测具有良好的电化学活性。
22.2 μmol·L-1大黄素标准溶液在pH=5.33的B-R 缓冲溶液中,于-0.8~0.2 V电位范围,富集180 s的条件下进行连续循环伏安扫描(图5)。第一次扫描氧化峰电位为-0.56 V,第二次扫描后氧化峰电位负移到-0.569 V,第四次扫描后氧化峰电位负移到-0.572 V,且峰电流随扫描次数的增加而增大,说明大黄素在电极表面的反应过程是一个聚合过程[16]。

图4 大黄素在不同修饰电极上的循环伏安图Fig.4 Cyclic voltammograms of emodin at the different modified electrodesa:GNs/GCE;b:GNs/PDA/GCE;c:GNs/PDA/Au/GCE.t=140 s.
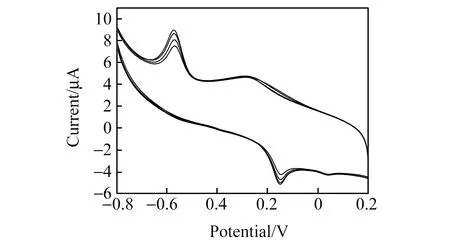
图5 大黄素在GNs/PDA/Au/GCE上的连续循环伏安扫描曲线Fig.5 Continuous cyclic voltammograms of 22.2 μmol·L-1 emodin at GNs/PDA/Au/GCE in B-R bufter
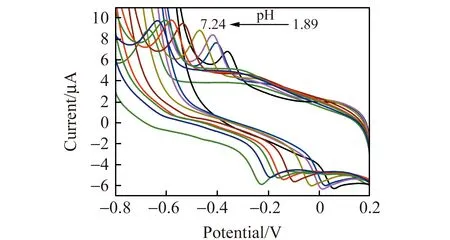
图6 大黄素在GNs/PDA/Au/GCE上于不同pH B-R缓冲溶液的循环伏安曲线图Fig.6 Cyclic voltammograms of emodin at GNs/PDA/Au/GCE in different pHpH:1.89,2.36,2.56,3.29,4.56,5.33,5.72,6.37,7.24,t=180 s.
2.5 pH的选择
考察了B-R缓冲溶液pH对大黄素检测的影响。从图6中可以看出随着pH从1.89增大到5.33时,大黄素的峰电流逐渐增加,继续增加溶液的pH时,峰电流反而下降,所以选择pH=5.33的B-R缓冲溶液为最佳检测溶液。
2.6 富集时间的选择
采用GNs/PDA/Au/GCE,在B-R缓冲溶液中,用差分脉冲伏安法对大黄素富集时间进行优化。结果表明,在20~140 s范围内,随着富集时间的增加,峰电流依次增加,富集时间继续增大到160 s时,峰电流反而减小。这可能是由于大黄素在GNs/PDA/Au/GCE表面达到了饱和状态,继续增加富集时间,会有部分大黄素非特异性吸附在电极表面,这样不但不能提高电化学信号,反而会阻碍电子的传递,导致峰电流降低。所以选择140 s作为大黄素的最佳富集时间。
2.7 线性范围及检测限
在上述最佳条件下,采用差分脉冲伏安法对大黄素进行检测。从图7A可以看出,随着大黄素浓度的增加,峰电流逐渐增加;从图7B可以看出,大黄素在GNs/PDA/Au/GCE上的峰电流与浓度在1.48~119.63 μmol·L-1范围内呈现良好的线性关系,线性回归方程为:Ip(μA)=0.08c+5.78,线性相关系数是0.9911,检测限为5.0 μmol·L-1。
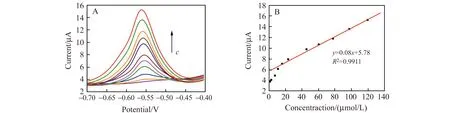
图7 (A)不同浓度大黄素的差分脉冲伏安图;(B)峰电流与大黄素的浓度之间的线性响应曲线Fig.7 (A)Differential pulse voltammograms of different concentrations of emodin at GNs/PDA/Au/GCE,(B)Linear response curve between peak current and emodin concentrationcEmodin:1.48,2.96,7.4,11.1,16.03,23.43,45.63,60.43,77.7,97.43 and 119.63 μmol·L-1.pH=5.33,t:140 s,scan rate:50 mV·s-1.
2.8 样品分析及回收率
在pH=5.33的B-R缓冲溶液中,采用差分脉冲循环伏安法测定了大黄药材中大黄素的含量,结果见表1。大黄药材中大黄素的含量平均为1.2 mg·g-1,加标回收率在98.4%~102.6%范围,表明方法准确度较高,完全满足实际样品测定需求。
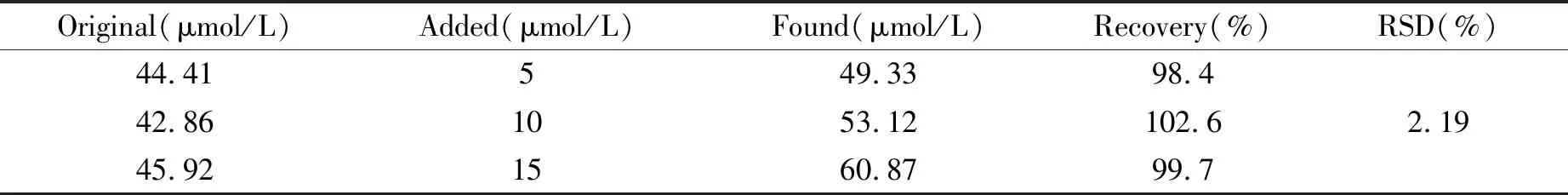
表1 大黄素样品的加标回收测定
3 结论
本文成功制备了石墨烯/聚多巴胺复合纳米材料,将其作为金纳米粒子的载体,制备GNs/PDA/Au复合纳米材料,对合成的材料进行表征。将制备的GNs/PDA/Au用于构建电化学传感器对大黄素进行检测。在最佳实验条件下检测大黄素,线性范围为16.03~119.63 μmol·L-1,检测限为5.0 μmol·L-1。该电化学检测方法适用于对实际样品的检测,可应用到药物分析中。
