超高效液相色谱-高分辨质谱分析大鼠肝微粒体中厚朴酚与和厚朴酚的体外代谢
2019-04-25刘春明王乐奇侯万超李赛男
黄 彧, 刘春明*, 吴 桐, 王乐奇, 侯万超, 李赛男
(长春师范大学中心实验室,吉林长春 130032)
肝脏是机体中参与代谢药物的重要器官,它含有大量与药物代谢密切相关的重要酶系。其中,最重要的Ⅰ相反应酶是细胞色素P450酶(CYP450),人体内几乎70%的药物由其代谢[1]。大量研究表明,CYP450亚型酶对药物的代谢显示出特异性,这使得我们可以根据CYP450亚型酶的特异性抑制剂来确定药物的代谢途径。由于许多药物的相互作用是通过提供药物诱导或抑制CYP450酶的活性,使其它药物的代谢增强或减弱所导致的,所以了解药物在CYP450酶中的代谢情况,并确定对应的代谢酶亚型显得非常重要[2]。
厚朴对食积气滞、腹胀便秘等疾病有治疗作用[3]。在2015年版《中国药典》中有近100种中药制剂配方是将其作为主要成分的,例如小儿泻痢片、小儿豉翘清热颗粒、木香顺气丸等[4]。厚朴树皮中含木脂体类化合物厚朴酚(Magnolol)、和厚朴酚(Honokiol)等,还有单萜木脂体类化合物、生物碱、挥发油等,而它的主要药理活性成分是厚朴酚、和厚朴酚[5]。有研究表明厚朴酚可能是预防骨质紊乱如骨质疏松症的候选药物[6]。厚朴及厚朴中的两种药效成分厚朴酚与和厚朴酚对羟自由基和过氧化氢有清除作用,并且相对于厚朴酚、和厚朴的抗氧化能力更强[7]。王俊俊通过和厚朴酚能够降低大鼠Ⅱ型糖尿病模型的血糖血脂、增强肝脏抗氧化酶、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-Px)活力等指标发现了和厚朴酚具有抗糖尿病的效果[8]。和厚朴酚还可以通过阻止丙型肝炎病毒(HCV)细胞的侵入和复制而抑制HCV的传播,是治疗丙型肝炎的潜在药物[9]。在抗菌方面,有报道证明厚朴酚与和厚朴酚的联用对体外耐甲氧西林金黄色葡萄球菌(MRSA)有效[10]。关于厚朴酚与和厚朴酚药效作用的研究比较丰富,但在CYP450亚型酶(CYP1A2,2C9,2C19,2D6,2E1和3A4)中代谢机理的研究还没见相关的报道。本文系统地研究了厚朴酚与和厚朴酚在大鼠肝微粒体(RLMs)中的体外代谢[11],并应用超高效液相色谱-高分辨质谱(UPLC-HRMS)分析鉴定了主要代谢物。通过使用特异性抑制剂鉴定了指导厚朴酚与和厚朴酚在大鼠肝微粒体中代谢的CYP450亚型酶。本研究旨在为厚朴酚与和厚朴酚体外代谢的进一步研究及临床合理化用药提供新的实验依据。
1 实验部分
1.1 仪器与试剂
Thermo fisher U3000超高效液相色谱仪(德国,Thermo Fisher Scientific),配置在线脱气机、四元梯度泵、柱温箱、自动进样器;Thermo Scientific Q Extractive 质谱仪(德国,Thermo Scientific);Xcalibur 3.2软件;Sanorius BSl10S 分析天平(德国,Sanorius);Sigma 1-14离心机(德国,Sigma);DW-86L486型超低温冰箱(中国Haier公司)。
厚朴酚、和厚朴酚(上海源叶生物科技有限公司,批号分别为:KS0912CB14,T28O6B5149)。槲皮素、α-萘黄酮、奎尼定、氯美噻唑、花椒毒素、噻氯匹定、酮康唑(梯希爱(上海)化成工业发展有限公司,批号分别为:83N2O-AR,UEESA-IH,WEODL-RE,WBHWE-F8,7OMXF-TL,RH58M-OI,ZJUZI-PM)。NADPH再生系统和磷酸盐缓冲溶液(PBS)(Solarbio公司,批号分别为:721L023,20161212)。色谱纯甲醇、乙腈以及甲酸(美国Fisher Scientific公司)。实验用水由Milli-Q纯水系统制备。
1.2 动物
雄性SD大鼠(混合)肝微粒体购自瑞德肝脏疾病研究所(上海)有限公司,蛋白质量浓度为20 mg/mL(批号:JPXY)。
1.3 实验方法
1.3.1厚朴酚与和厚朴酚的体外代谢150 μL酶反应系统[12],含有0.5 mg/mL肝微粒体蛋白,100 mmol/L PBS(pH=7.4),NADPH再生系统(终浓度为3.3 mmol/L葡萄糖-6-磷酸,1.3 mmol/L NADP+,0.4 U/mL葡萄糖-6-磷酸脱氢酶和3.3 mmol/L MgCl2)以及10 μL厚朴酚、和厚朴酚(终浓度为50 mmol/L)。RLMs与厚朴酚、和厚朴酚在37 ℃下预温育5 min后,通过加入NADPH再生系统启动反应。37 ℃孵育90 min。
1.3.2厚朴酚与和厚朴酚代谢酶亚型的特异性抑制剂探针法利用CYP450亚型酶的特异性抑制剂来确定厚朴酚与和厚朴酚的CYP450代谢酶亚型[13]。抑制剂浓度及其靶点具体如下:0.01 mmol/L槲皮素(CYP2C),0.02 mmol/L花椒毒素(CYP2A6),0.02 mmol/L奎尼定(CYP2D6),0.02 mmol/L氯美噻唑(CYP2E1),0.01 mmol/L酮康唑(CYP3A),0.025 mmol/Lα-萘黄酮(CYP1A2),0.02 mmol/L噻氯匹定(CYP2B6)[8 - 11]。这些化合物用于分析厚朴酚与和厚朴酚在RLMs中的代谢途径。
将用于溶解厚朴酚、和厚朴酚的溶剂的孵育溶液(甲醇)用作阴性对照[14],将上述特定抑制剂用作阳性对照。其他孵育条件与“1.3.1”部分中描述相同。比较代谢物含量的变化。
1.3.3样品处理加入150 μL冰乙腈溶液终止反应。涡旋样品,4 ℃、13 000 r/min离心10 min。上清液供UPLC-HRMS分析。
1.3.4色谱和质谱条件使用Thermo Hypersil Gold C18色谱柱(100×2.1 mm,1.7 μm)分离厚朴酚、和厚朴酚以及代谢产物。流动相由0.1%甲酸(A)和乙腈(B)组成。线性梯度洗脱程序:0~5 min,5%B;5~8 min,5%~30%B;8~15 min,30%~52%B;15~20 min,52%~72%B。柱温:20 ℃。采用全扫描和选择反应监测(SRM)方式鉴定:喷雾电压设定为-4.5 kV,毛细管温度为350 ℃,鞘气压为35 psi,辅助气压为10 psi。使用以下参数进行一级质谱(MS)和二级串联质谱(MS/MS)数据采集:分辨率17 500,碎裂电压NCE为30,扫描范围m/z100~1 200。
2 结果与讨论
2.1 厚朴酚代谢产物及代谢途径的确定
使用UPLC-HRMS分析CYP450反应体系中厚朴酚的代谢产物,与空白灭活的CYP450反应体系相比,在总离子流图中发现了5个明显的新增质谱峰。原型化合物厚朴酚及其代谢产物的MS2数据见表1。其中,厚朴酚的保留时间tR为18.27 min,分子离子峰[M-H]-(m/z=265.1235)。MS2中产生了m/z=247.1127的碎片离子和一个水分子碎片离子,这与Li等[15]的报道一致。

表1 厚朴酚及其主要代谢物的UPLC-MS/MS数据
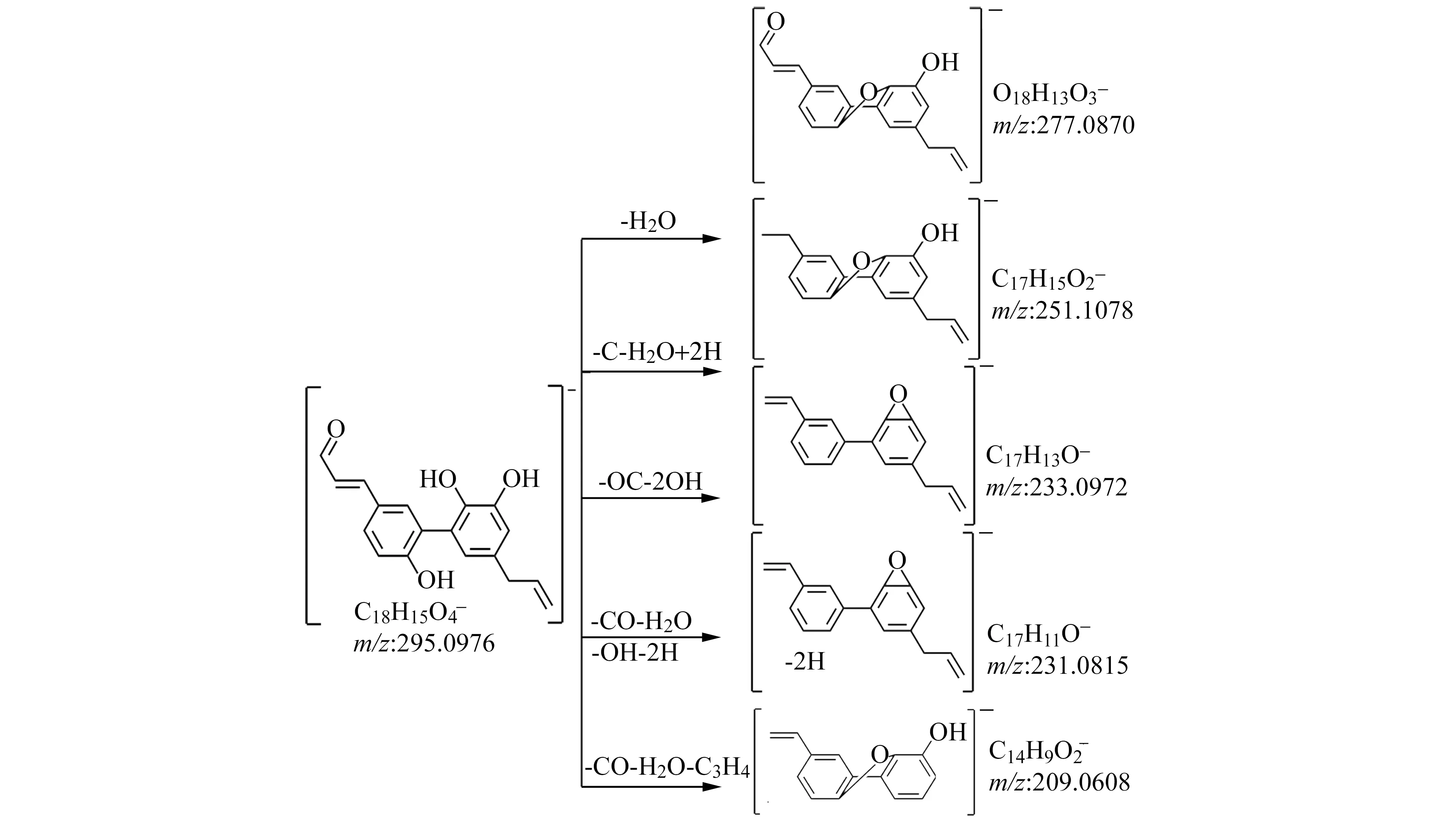
图1 厚朴酚代谢产物M1的质谱碎裂机理Fig.1 Mechanism of mass spectrometry fragmentation of Magnolol metabolite M1
代谢产物M1准分子离子[M-H]-为m/z295.0977,保留时间tR为11.22 min,结合厚朴酚结构,推测其为厚朴酚端位烯烃氧化产物。它在MS2中产生m/z277.0871、251.1078、233.0972、231.0812、209.0608等碎片离子,它们分别为代谢产物M1脱去一分子水;脱去一分子水、一个羰基以及发生了加氢还原;脱去两个羟基和一个羰基;脱去两分子水和一个羰基;脱去一个丙烯基、一个羰基以及一分子水。MS碎裂过程如图1所示,MS2如图2(a)所示。代谢产物M2准分子离子[M-H]-为m/z299.1291,保留时间tR为11.78 min。结合厚朴酚结构,推测是厚朴酚的末端双键单氧化和单羟基化产物。这在MS2中产生了m/z239.1075、221.0968、133.0646和93.0331碎片离子,分别是代谢产物M2损失了两个羟基;丢掉了两个羰基和一个水分子;去掉了两个羰基,一个水分子和环断裂;去掉了两个羰基,一个水分子,一个丙烯基团,并发生了环断裂。MS2如图2(b)所示。代谢产物M3分子离子[M-H]-(m/z=281.1184)的保留时间tR为13.55 min,推测可能是厚朴酚苯环单羟基化产物。在MS2中产生m/z263.1079、245.0970、133.0646等碎片离子,分别为代谢产物M3丢失一分子水;丢失两分子水;丢掉一分子水并发生环中裂。MS2如图2(c)所示。代谢产物M4准分子离子[M-H]-为m/z279.103,保留时间tR为14.91 min,结合厚朴酚结构,推测是厚朴酚端位烯烃发生了氧化反应。它在MS2中产生m/z261.092、233.0968、209.0601等碎片离子,它们为代谢产物M4分别脱去一分子水;脱去一分子水及羰基;脱去一分子水以及发生环中裂。其MS2图见图2(d)。代谢产物M5准分子离子[M-H]-为m/z285.1502,保留时间tR为17.89 min,结合厚朴酚结构,推测其为厚朴酚末端双键单羟基化和苯环单羟基化产物。它在MS2中产生m/z267.1967、223.2063等碎片离子,它们分别为代谢产物M5脱去一分子水;脱去一分子水和羰基。其MS2图见图2(e)。

图2 厚朴酚代谢产物二级质谱图 Fig.2 Secondary cascade mass spectrometry of Magnolol metabolites (a)M1;(b)M2;(c)M3;(d)M4;(e)M5.
2.2 和厚朴酚代谢产物及代谢途径的确定
使用UPLC-HRMS分析了和厚朴酚在CYP450反应体系中的代谢产物,与空白灭活的CYP450反应体系比较,在总离子流图中主要发现四个新增质谱峰(图略)。原型化合物和厚朴酚以及各代谢产物对应的二级串联质谱数据列于表2中。其中和厚朴酚,保留时间tR为31.62 min,化合物准分子离子[M-H]-(m/z=265.1235)。它在MS2中产生m/z237.1285和224.0838碎片离子,它们分别代表和厚朴酚的去羰基化以及和厚朴酚的丙烯基碎片离子去质子化,这与Li等[15]报道一致。
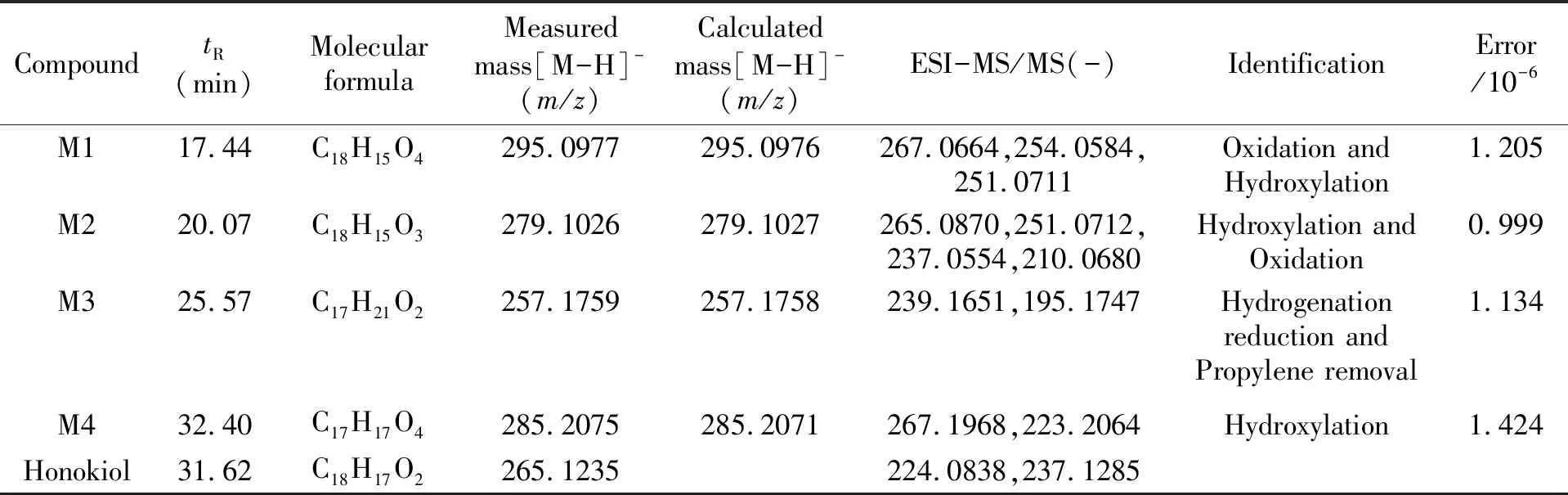
表2 和厚朴酚及其主要代谢物的UPLC-MS/MS数据
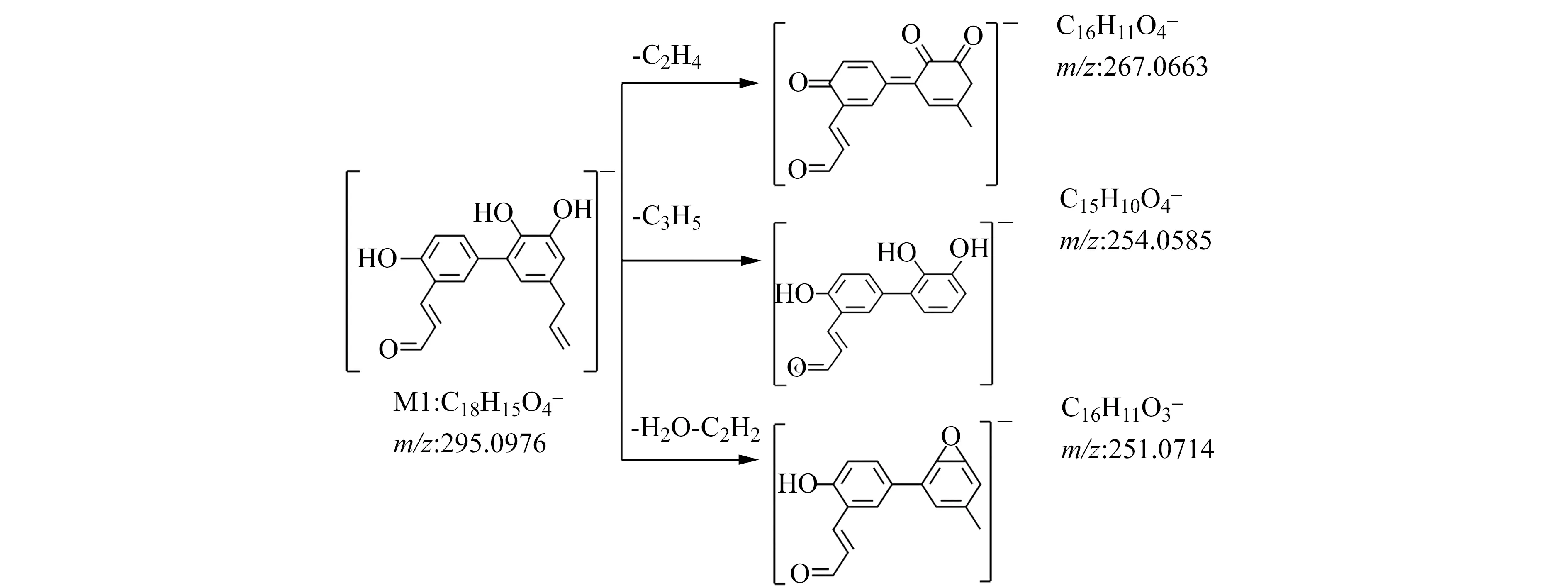
图3 和厚朴酚代谢物M1的质谱碎裂机理Fig.3 Mass spectrometry fragmentation mechanism of Honokiol metabolite M1
代谢产物M1准分子离子[M-H]-为m/z295.0977,保留时间tR为17.44 min,结合和厚朴酚结构,推测其为和厚朴酚端位单羟基化产物。它在MS2中产生m/z267.0664、254.0584、251.0711等碎片离子,它们是代谢产物M1分别脱去一个乙烯基;脱去一个乙烯基及一分子水;脱去丙烯基。质谱碎裂过程如图3所示。代谢产物M2准分子离子[M-H]-为m/z279.1026,保留时间tR为20.07 min,结合和厚朴酚结构,推测其为和厚朴酚端位烯烃氧化产物。它在MS2中产生m/z265.0870、251.0712、237.0554、210.0680碎片离子,它们是代谢产物M2分别脱去一个亚甲基;脱去一个乙烯基;脱去一个丙烯基;脱去一个丙烯基以及一个羰基。代谢产物M3准分子离子[M-H]-为m/z257.1759,保留时间tR为25.57 min,结合和厚朴酚结构,推测其为和厚朴酚发生单羟基化以及加氢还原反应。它在MS2中产生m/z239.1651、195.1747等碎片离子,它们分别为代谢产物M3脱去一分子水;脱去一个羰基及两个羟基。代谢产物M4准分子离子[M-H]-为m/z285.2075,保留时间tR为32.40 min,结合和厚朴酚结构,推测其为和厚朴酚发生羟基化和加氢还原反应的代谢产物。它在MS2中产生m/z267.1968、223.2064等碎片离子,它们分别为代谢产物M4脱去一分子水;脱去一个羰基及两个羟基。
2.3 参与厚朴酚与和厚朴酚I期代谢的CYP450亚型酶
确定药物的代谢途径对了解药-药相互作用是至关重要的。大量结果表明抑制CYP450亚型酶的活性会减少代谢物的形成,CYP450的特异性抑制剂被确定为检测CYP450代谢途径的有力工具。因此,在RLMs反应系统中分别进行CYP2C,2A6,2D6,2E1,3A4,1A2和2B6亚型酶介导的化学抑制测定。在存在或不存在CYP450亚型酶特异性抑制剂的情况下,将底物加入RLMs中预孵育30 min。将对照组(无抑制剂)产物的峰面积定义为100%活性,并与用抑制剂处理的样品进行比较。在CYP450特异性抑制剂的作用下,观察代谢物的产量降低,表明该CYP450亚型酶催化该产物的产生。

图4 CYP450亚型酶的特异性抑制剂对CYP450中厚朴酚代谢物产生率的影响Fig.4 Effects of specific inhibitors of CYP450 subtypes enzymes on the metabolite production rates of Magnolol in CYP450 Blank control without inhibitor.All values are the mean±SEM of three determinations(n=3).Bar graph from left to right:
厚朴酚在大鼠肝微粒体中有5种主要代谢物,对其进行代谢途径的探究。通过特异性抑制剂对CYP450代谢物产率的影响(图4)可以看出,CYP2C抑制剂仅抑制M1产物的形成;CYP2A6抑制剂仅抑制M2产物的形成;CYP2E1抑制剂抑制M1、M2和M3产物的形成;CYP3A4抑制剂仅抑制M1、M2和M5产物的形成;CYP1A2抑制剂抑制M1、M4和M5产物的形成;CYP2B6抑制剂仅抑制M1、M2、M4和M5产物的形成。而CYP1A2和CYP2E1抑制剂显著抑制M1和M3的产物形成。并且,CYP2D6抑制剂对厚朴酚的5种产物均无抑制作用,这说明CYP2D6亚型酶可能对厚朴酚的代谢没有指导作用。由CYP450亚型酶指导的厚朴酚代谢产物的结构及其代谢途径显示于图5中。CYP1A2和2C是厚朴酚氧化的主要代谢酶,CYP2E1是厚朴酚末端羟基化的主要代谢酶。
同理,对和厚朴酚的四种主要代谢产物进行探究,图6表明:CYP2C抑制剂抑制M1、M2和M3产物的形成;CYP2A6和2D6抑制剂仅抑制M2的形成;CYP2E1抑制剂抑制所有产物的形成;CYP3A4抑制剂仅抑制M2、M3和M4产物的形成;CYP1A2抑制剂抑制M2、M3和M4产物的形成;CYP2B6抑制剂抑制所有产物的形成。结果说明:CYP2C可能是主导和厚朴酚氧化代谢的主要亚型酶,CYP1A2和2E1可能是负责将和厚朴酚转化为羟基化和氢化代谢产物的主要亚型酶,CYP2B6亚型酶可能是指导和厚朴酚苯环羟基化代谢的主要亚型酶。由CYP450亚型酶指导的和厚朴酚代谢产物的结构及其代谢途径如图7所示。

图6 CYP450亚型酶的特异性抑制剂对CYP450中和厚朴酚产率的影响Fig.6 Effect of specific inhibitors of CYP450 subtypes enzymes on the production rates of Honokiol in CYP450 Blank control without inhibitor.All values are the mean±SEM of three determinations(n=3).Bar graph from left to right:

图7 和厚朴酚在大鼠肝微粒体中可能的代谢途径Fig.7 Possible pathways of Honokiol in rat liver microsomes
2.4 统计分析
CYP450亚型酶的特异性抑制剂对厚朴酚、和厚朴酚在大鼠肝微粒体中产物产率的影响,用统计学软件Origin 8.0进行统计,显著的统计学差异(P<0.05)用*标记,所有值均为3次测定的平均值±SEM(n=3)。
3 结论
本文基于大鼠肝微粒体(RLMs)的体外代谢研究,将细胞色素P450(CYP450)特异性抑制剂与超高效液相色谱-高分辨质谱技术结合,开发了一种高分辨率、快速准确的检测方法,系统地对厚朴酚、和厚朴酚在RLMs中的体外代谢情况及代谢产物进行探究。虽然对于CYP450亚型酶针对不同羟基化和氧化位点的通用指导性还未能确定,这或许在以后的研究中可以进一步深入探究,但该实验仍然为进一步研究药物相互作用提供了重要的参考。
