促红细胞生成素对大鼠肝缺血再灌注后肠损伤的保护作用及其作用机制研究*
2019-04-25吴鹏俐石清明阳德飞刘富春陈晓琴
吴鹏俐,石清明,阳德飞,刘富春,陈晓琴,王 静,肖 莉
(1.成都医学院麻醉学,成都 610500;2.西部战区疾病预防控制中心,成都 610021;3.成都医学院临床医学,成都 610500;4.解放军第324医院药剂科,重庆 400020;5.成都医学院医学影像学,成都 610500;6.成都医学院人体解剖学教研室,成都 610500)
肝脏移植、肝部分切除等肝脏外科手术都需要暂时性阻断肝血流,而重新恢复血液供应后可能造成肝缺血再灌注损伤(HIRI)[1]。这种损伤不仅仅局限于肝脏本身,也涉及小肠。门静脉回流受阻,可导致肠黏膜屏障功能损害,引起肠内毒素及细菌移位,加重HIRI。基质金属蛋白酶9(MMP-9)是Zn2+依赖的参与细胞外基质(ECM)降解的蛋白水解酶,活化的MMP-9通过降解肝细胞外基质,诱导中性粒细胞的趋化迁移[2]。半胱氨酸水解酶-1(caspase-1)是与炎性反应密切相关的蛋白酶,可促进白细胞介素(IL)-1β、IL-18等细胞因子成熟,而IL-1β、IL-18在HIRI中起重要作用[3]。促红细胞生成素(EPO)是一种含唾液酸的酸性糖蛋白激素,不仅可促进机体生成红细胞,还具有抗凋亡、抗氧化、促进血管生成、抑制炎性反应等功能。多项研究表明EPO对大鼠HIRI具有保护作用[4],但是否对肝缺血再灌注后小肠上皮细胞损伤具有保护作用,以及是否通过抑制MMP-9、caspase-1介导炎性反应仍未明确。本研究通过构建肝缺血再灌注模型,探讨EPO对肠损伤的保护作用及其作用机制,为肝脏缺血再灌注后肠损伤的治疗提供实验依据。
1 材料与方法
1.1材料
1.1.1实验动物 健康成年雄性SD大鼠30只,SPF级,购自四川省人民医院实验动物研究所[合格证号:SCXK(川)2013-15],体质量180~250 g。
1.1.2主要试剂 EPO购自沈阳三生制药有限责任公司;MMP-9抗体、caspase-1抗体、SABC免疫组织化学试剂盒购自武汉博士得生物工程有限公司;丙二醛测量试剂盒购自南京建成生物工程研究所;甘油醛-3-磷酸脱氢酶(GAPDH)抗体、山羊抗兔免疫球蛋白G(IgG)购自上海碧云天生物技术有限公司。
1.2方法
1.2.1实验动物分组及模型制备 将实验动物分为假手术组(Sham组)、缺血再灌注组(I/R组)和EPO低剂量组(L组)、中剂量组(M组)和高剂量组(H组),每组6只。在制备I/R模型前1 h,L、M、H组分别给予腹腔注射EPO 1 000、3 000、5 000 U/kg,I/R组及Sham组腹腔注射生理盐水。实验动物术前禁食12 h,自由饮水。10%水合氯醛 4 mL/kg腹腔注射麻醉,上腹正中切口,游离肝门血管,无创动脉夹夹闭肝左叶及中叶的门静脉和肝动脉,1 h后松开动脉夹恢复阻断区血供,建立肝脏缺血再灌注模型。Sham组仅暴露肝门,但不阻断血管。
1.2.2取材 3 h后取小肠中段组织,生理盐水冲洗小肠内容物,置于4%的多聚甲醛固定12 h。
1.2.3HE染色 常规石蜡包埋切片,HE染色。光镜下观察及比较各组小肠绒毛和上皮细胞组织形态改变。
1.2.4免疫组织化学染色和Western blot法测定MMP-9、caspase-1蛋白的表达 采用SABC法进行MMP-9(1∶100)、caspase-1(1∶100)免疫组织化学染色,以PBS代替一抗做阴性对照。利用 Image-Pro Plus 6.0 测定积分光密度(IOD)值。Western blot法测定各组MMP-9(1∶1 000)、caspase-1(1∶1 000)蛋白表达的变化。

2 结 果
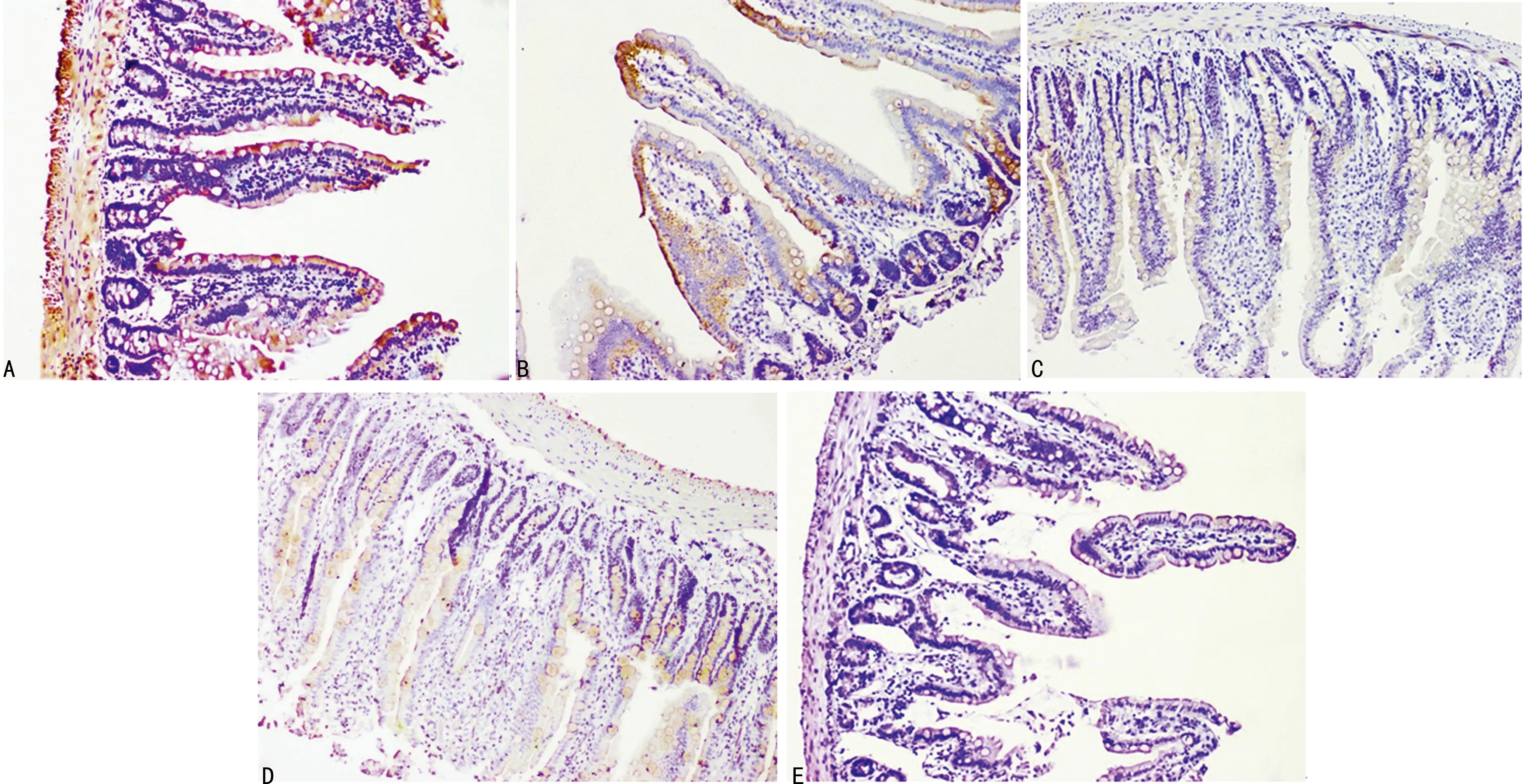
2.1小肠光镜下的组织学改变 HE染色光镜下显示,Sham组肠绒毛形态规则,排列整齐,隐窝结构完整。I/R组肠绒毛破坏明显,大量绒毛断裂脱落,黏膜固有层暴露,上皮细胞变性坏死,较多炎性细胞浸润,隐窝结构破坏。L、M、H组损伤程度较I/R组明显减轻,小肠绒毛结构基本完整,绒毛顶端可见少量上皮细胞脱落,伴有部分上皮层和固有层分离,少量炎症细胞浸润。L、M、H组各组比较,M组绒毛基本完整,排列规则,损伤程度较L和H组明显减轻,见图1。
2.2免疫组织化学MMP-9的表达及IOD值 免疫组织化学染色显示,MMP-9主要表达于小肠黏膜上皮细胞胞质中,呈棕黄色,部分表达于上皮细胞膜和基底膜。I/R组MMP-9阳性细胞数量均明显增多。与I/R组比较,L、M、H组MMP-9的表达减弱。L、M、H组中,M组MMP-9的表达量较其余两组明显减少。I/R组大鼠的MMP-9IOD值最高(65.74±6.83),Sham组最低(13.73±2.15);L组(34.87±3.89)、M组(15.89±1.91)、H组(28.13±4.64)组均明显低于I/R组(P<0.05);其中M组的MMP-9IOD值最低,与L、H组相比差异有统计学意义(P<0.05),见图2。
2.3免疫组织化学caspase-1的表达 免疫组织化学染色显示,caspase-1蛋白主要表达于绒毛上皮细胞,呈棕黄色。此外,黏膜下层,肌层和浆膜也有不同程度的阳性表达。I/R组caspase-1阳性表达明显增多。L、M、H组caspase-1的表达较I/R组明显减弱,其中M组caspase-1的阳性细胞的表达量最低。I/R组大鼠的caspase-1的IOD值最高(65.94±7.20),Sham组最低(15.13±2.40);L组(38.40±5.87)、M组(20.59±4.46)、H组(30.30±6.89)均低于I/R组(P<0.05);其中M组的caspase-1的IOD值最低,与L、H组相比差异有统计学意义(P<0.05),见图3。

A:I/R组;B:L组;C:M组;D:H组;E:Sham组
图1 各组小肠上皮的组织学变化(HE,×100)
A:I/R组;B:L组;C:M组;D:H组;E:Sham组
图2 MMP-9免疫组织化学结果(×100)
2.4Western blot Western blot对应的条带位置出现目的蛋白,MMP-9在92 kD处,caspase-1在45 kD处,GAPDH在36 kD处。MMP-9检测结果显示,与Sham组(0.18±0.06)相比,I/R组MMP-9(1.26±0.18)明显升高,差异有统计学意义(P<0.05);EPO预处理后,L、M、H组MMP-9的表达均得到了不同程度的抑制(H组:0.42±0.06;M组:0.40±0.07;L组:0.74±0.12),其中M组对MMP-9的表达抑制作用最明显,与I/R组比较差异有统计学意义(P<0.05)。caspase-1检测结果显示,经缺血再灌注损伤后,与Sham组(0.26±0.05)相比,I/R组caspase-1的表达明显升高(1.13±0.09),差异有统计学意义(P<0.05);EPO预处理后,L、M、H组caspase-1的表达得到了不同程度的抑制(H组:0.51±0.04;M组:0.37±0.03;L组:0.66±0.05),其中M组对caspase-1表达抑制作用最明显,与I/R组比较差异有统计学意义(P<0.05),见图4。

A:I/R组;B:L组;C:M组;D:H组;E:Sham组
图3 caspase-1免疫组织化学结果(×100)

A:Western blot蛋白条带;B:各组MMP-9、caspase-1灰度值与GAPDH灰度值的比值柱形图
图4 各组小肠组织MMP-9、caspase-1的表达
3 讨 论
肝脏缺血再灌注不仅造成肝脏损伤,也可引起多器官功能障碍综合征(MODS)[5]。肝门阻断后,易造成肠道血流严重淤滞,肠道组织缺血缺氧,导致组织细胞受损。当重新恢复血流后,血液中大量活性氧自由基造成组织细胞过氧化及氧化应激损伤,使肠黏膜通透性增加,引起细菌移位及内毒素血症[6-8]。肝恢复血流时,内毒素等毒性物质作用于肝脏的枯否细胞(KC),产生大量的肿瘤坏死因子-α(TNF-α)、IL-1等多种炎症介质,导致全身炎症反应综合征(SIRS)。
MMP-9是一类由中性粒细胞和巨噬细胞分泌的具有降解ECM效应Zn2+依赖的蛋白酶,基本存在于机体所有脏器中。在正常机体状态下,MMP-9主要是作用于细胞外基质,维持基质的动态平衡,当出现不同因素导致的机体损伤时,MMP-9水平升高,进而导致器官、组织的损伤及破坏。研究表明,MMP-9介导中性粒细胞的浸润在HIRI过程中起着关键作用。缺血再灌注后中性粒细胞激活内皮细胞,上调并活化MMP-9,参与肝缺血再灌注损伤[9-11]。此外,PALLADINI等[12]已经证实发生肝脏缺血再灌注损伤后,不仅肝脏组织本身MMP-9水平升高,同时在肺、肾脏等其他器官中MMP-9水平也升高。HANIFEH等[13]研究表明MMP-9可调控肠黏膜组织细胞外基质(ECM)的降解及合成代谢。代谢失衡会使肠黏膜屏障破坏,导致炎症细胞浸润,ECM成分降解,MMP-9水平与肠黏膜屏障损伤密切相关。caspase-l可表达于Kupffer细胞,经炎性体活化的caspase-1能够切割IL-1β前体,形成具有活性的IL-1β和IL-18,产生成熟的IL-lβ、IL-18,从而诱导级联炎性反应介导缺血再灌注损伤[14-15]。
EPO是一种由肾脏产生的具有多种生物学效应的糖蛋白,具有抗炎、抗凋亡、抗肿瘤等广泛的生物学活性。EPO不仅仅能促进红细胞的成熟,它对心、脑、肾等多种器官缺血再灌注也有一定的保护作用[16-18]。本研究通过建立大鼠肝缺血再灌注模型,探讨EPO对肝缺血再灌注引起肠损伤的保护作用。研究结果显示,EPO预处理可明显减轻肝缺血再灌注引起的小肠黏膜损伤和炎性反应,如小肠绒毛断裂脱落,上皮细胞变性坏死,炎性细胞浸润,毛细血管出血、坏死、溃疡等损伤程度较I/R组明显降低。EPO预处理各组比较,M组绒毛基本完整,排列规则,损伤程度较L和H组明显减轻。本研究检测了各组大鼠的小肠组织MMP-9及caspase-1的表达,免疫组织化学及Western blot结果显示I/R组小肠黏膜上皮细胞MMP-9水平明显增高,EPO预处理MMP-9水平明显下降,这表明EPO可能通过下调MMP-9水平,减少中性粒细胞的迁移浸润,同时抑制肠黏膜组织细胞外基质的降解,从而减轻肠黏膜屏障损伤。缺血再灌注后,caspase-1的表达也明显升高,EPO预处理可以明显抑制caspase-1的表达,这说明EPO可抑制caspase-1的活化,以及下游炎性因子IL-1β和IL-18的表达。
综上所述,EPO对于肝缺血再灌注后的肠损伤具有保护作用。EPO的这种保护机制可能与EPO能抑制caspase-1活化,下调下游的炎性因子,从而降低MMP-9水平,抑制炎性反应有关。3 000 U/kg的EPO预处理的治疗效果最佳。
