小儿肾脏恶性肿瘤的诊断和治疗
2019-04-25李民驹顾伟忠王金湖茅君卿舒强
李民驹 顾伟忠 王金湖 茅君卿 舒强
肾脏恶性肿瘤约占儿童恶性肿瘤的7%[1],包括一系列病理类型的肾肿瘤,其中最常见的是肾母细胞瘤,其他有肾透明细胞肉瘤、肾恶性横纹肌样瘤、肾细胞癌、先天性中胚层肾瘤等。这对于临床医生选择最佳治疗方案是一个挑战。近几十年来,随着国际合作临床研究的进展,肾脏恶性肿瘤的治愈率有了明显提高。本文对小儿肾脏恶性肿瘤作一全面概述,并指出诊断与治疗方面的新进展。
1 肾母细胞瘤
肾母细胞瘤,又称为威尔姆斯瘤(Wilms瘤)或肾胚细胞瘤,是儿童第二常见的腹部恶性肿瘤,约占儿童肾脏肿瘤的95%。15岁以下儿童的肾母细胞瘤发生率为7.1/100万[2]。约75%的患儿在2~5岁确诊,中位年龄3.5岁。双侧肾母细胞瘤在所有患儿中占4%~7%[3]。肾母细胞瘤的临床表现通常为腹部肿块。约1/4的患儿有肉眼血尿、腹痛或高血压。约10%的患儿可发生血行性转移,最常见的转移部位是肺(约占85%),少数转移至肝脏(约占10%),极少患儿发生骨转移和脑转移[4]。
在显微镜下,可见肾母细胞瘤由胚芽、间叶、上皮等3种组织构成,见图1。美国国家肾母细胞瘤研究组(NWTSG)根据组织学改变与预后的关系,将肾母细胞瘤分为2个组织学类型,预后良好型(包括上皮型、间叶型、胚芽型和混合型)和预后不良型(即间变型,包括局灶间变型与弥漫间变型)[5]。间变型肾母细胞瘤的特征是肿瘤细胞核明显增大(直径大于同类细胞的3倍),核染色质明显增多,出现不典型或明显多倍体的核分裂象。间变型肾母细胞瘤常在免疫组化染色中表达p53基因突变。弥漫间变型肾母细胞瘤患儿的预后较差[6]。

图1 显微镜下肾母细胞瘤的组织构成(HE染色,×100)
肾源性残留是指异常残留的胚胎肾前体细胞排列成簇。单侧肾母细胞瘤的肾脏中约有35%可见肾源性残留,而双侧肾母细胞瘤的肾脏中约100%存在肾源性残留。肾母细胞瘤病是指存在弥漫性或多灶性肾源性残留。肾母细胞瘤切除后,若有肾源性残留,则以后在残留肾中形成肿瘤的风险明显增加[7]。
约5%的肾母细胞瘤患儿有潜在的11p13(WT1基因)突变或11p15染色体(WT2基因)表观遗传缺陷。WT1基因突变常见于伴有以下综合征之一的肾母细胞瘤患儿:WAGR综合征(包括肾母细胞瘤、无虹膜症、泌尿生殖系统异常、精神发育迟缓)[8],Denys-Drash综合征(包括生殖泌尿系异常)[9],弗雷泽综合征[10]。与WT2基因相关综合征包括Beckwith-Wiedemann综合征。这是一种过度生长综合征,其特征是身体的一个或多个部位不对称生长,出现巨舌、脐膨出或出生时的脐疝、耳朵附近皮肤皱褶或凹陷、肾脏异常和(新生儿)低血糖等[11]。
一些临床和生物学因素与肾母细胞瘤的危险度分层有关[1]。最重要的预后标志是肿瘤组织学,高危组织学包括间变型肾母细胞瘤。第2个重要决定因素是肿瘤分期。其他风险分层因素还包括患儿年龄、肿瘤大小和肿瘤分子特征(如1q扩增、1p和16q杂合性缺失)等。1q扩增是最有力的预后预测因子,与不良预后相关[12-13]。
肾母细胞瘤的治疗包括外科手术、化疗,部分患者加用放疗。国际上对儿童肾母细胞瘤的初期处理有2种不同方法,北美洲根据NWTSG/儿童肿瘤组(COG)协议,欧洲主要根据以欧洲为主的国际儿科肿瘤学会(SIOP)协议。NWTSG成立于1969年,在2001年并入COG。NWTSG/COG分期系统是根据初期手术的病灶范围而定,而SIOP分期是根据初期化疗后手术时的病灶范围而定。NWTSG/COG的肾母细胞瘤分期标准见表1,SIOP分期标准见表2。
NWTSG/COG的肾母细胞瘤标准治疗方法包括初期肾切除(如果可行手术)、然后化疗,部分患儿加放射治疗。这种方法能早期准确地进行组织学诊断,收集未经治疗改变的生物材料,并提供分期信息(如是否存在肿瘤溢出或淋巴结转移),再进行化疗[14]。SIOP主张在肾切除术前进行化疗。对所有确诊为局限性肾母细胞瘤、年龄>6个月的患儿,术前予长春新碱、放线菌素D联合化疗4周。对有远处转移的Ⅳ期患儿,术前予长春新碱、放线菌素D、阿霉素等3种药物治疗6周。对于双侧肾母细胞瘤的Ⅴ期患儿,初期化疗有望达到至少一侧肾的肾单位保留手术,留下足够的功能性肾组织[15]。对于组织学良好的Ⅰ期和Ⅱ期患儿,这2种方案的术后化疗均以长春新碱、放线菌素D为基础。但是,对于2岁以下、组织学类型良好、瘤重<550g的Ⅰ期患儿,术后不用化疗。按照COG方案,组织学类型良好的Ⅲ~Ⅳ期患儿,可予长春新碱、放线菌素D和阿霉素。但SIOP不推荐对Ⅲ期预后良好型(中危或低危组)肾母细胞瘤患儿添加阿霉素。对于组织学有间变的进展期(Ⅱ、Ⅲ、Ⅳ期)肾母细胞瘤或高危组患儿,应加强治疗,引入其他药物(如环磷酰胺、异环磷酰胺、卡铂、依托泊苷)和放射治疗。对于Ⅴ期患儿(双侧肾母细胞瘤),术前需用长春新碱、放线菌素D和阿霉素化疗6~12周,再进行肾单位保留手术。根据COG方案,Ⅲ期患儿或有间变组织学的患儿应接受术后局部放射治疗,但SIOP推荐对Ⅱ~Ⅲ期间变型肾母细胞瘤患儿进行局部放疗。大的肿瘤破裂需行全腹放疗[16-18]。

表1 NWTSG/COG肾母细胞瘤分期系统
尽管在肾母细胞瘤的治疗方法上存在明显的差异,但NWTSG/COG和SIOP的治疗结果相似,总生存率均超过90%[19]。
2 肾透明细胞肉瘤
肾透明细胞肉瘤是儿童第二常见的肾脏肿瘤,占儿童所有恶性肿瘤的3%~5%。它通常发生在4岁以下的儿童。肾透明细胞肉瘤是一种侵袭性肿瘤,具有骨转移、脑转移的倾向,也可以扩散到肺和腹腔。临床症状包括腹痛、高血压、血尿。典型的临床表现主要为一个大的、单侧的、边界清楚的肾肿块压迫周围的正常肾实质和集合系统[20]。典型的肾透明细胞肉瘤,在显微镜下可见圆形或梭形细胞束,胞质清晰、透明,有卵圆形至圆形的泡状核,核仁不明显。有树枝状的纤维血管间隔将瘤细胞分隔呈巢状或条索状,见图2[20]。细胞遗传学异常包括t(10;17)(q22;p13/p12)53重复易位和14q24q31缺失[21]。年龄较小、Ⅳ期病变是预后不良的危险因素[22]。

表2 SIOP WT2001儿童肾肿瘤分期标准

图2 显微镜下典型的肾透明细胞肉瘤形态(HE染色,×100)
目前采取多模式治疗,包括对可切除肿瘤进行根治性肾切除术,再进行强化疗和放射治疗。在NWTS-5(COG-Q9401/NCT00002611)试验中,对Ⅰ~Ⅳ期肾透明细胞肉瘤患儿予长春新碱、阿霉素、环磷酰胺、依托泊苷联合化疗15个月,所有患儿接受瘤床放疗。治疗后,5年无事件生存率为79%,总生存率为89%[23]。SIOP方案对局部病变者术前予长春新碱和放线菌素D治疗4周;对Ⅳ期患儿术前予长春新碱、放线菌素D和表柔比星或阿霉素治疗6周。对<6个月或>18岁的患者,立即行瘤肾切除术;对于6个月~18岁的患儿,在术前最后1次化疗后1周行瘤肾切除术。术后治疗方案与高危肾母细胞瘤所用的3~4种药物化疗方案相同。术前治疗6周后有可证实的转移灶者,行转移灶切除术或转移部位放射治疗。5年无事件生存率为79%,总生存率为86%。
3 肾恶性横纹肌样瘤
肾恶性横纹肌样瘤是一种罕见的、高度侵袭性的恶性肿瘤,占所有儿童肾脏肿瘤的2%,以就诊时年幼(平均年龄11个月)和肿瘤进展期为特征。约2/3的患儿就诊时为较晚期病变。临床上也有少数双侧肾脏发病的报道[24]。肾恶性横纹肌样瘤易转移到肺和脑,10%~15%的肾恶性横纹肌样瘤患儿有中枢神经系统病变[25]。
肾恶性横纹肌样瘤的分期系统与肾母细胞瘤的分期系统相同。组织学特征是细胞较大,呈多边形、圆形或卵圆形,呈巢状、索状或腺泡状排列,有大的空泡状胞核,核仁明显,核分裂多见,部分细胞中存在嗜酸性包涵体,见图3。
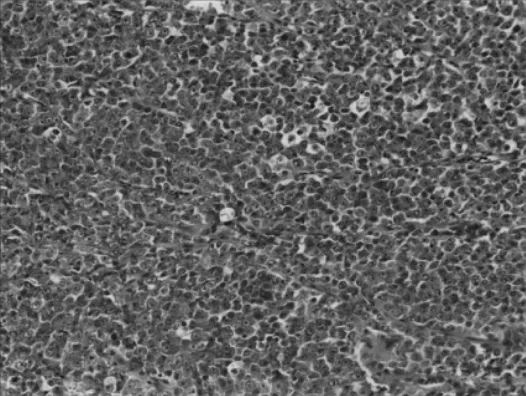
图3 显微镜下典型的肾恶性横纹肌样瘤形态(HE染色,×100)
95%以上的肾横纹肌样瘤有SMARCB1的双等位基因失活突变。35%的患儿在SMARCB1的一个等位基因中也有种系突变,是另一个不良预后的指标[26]。SMARCA4突变也在一小部分脑的不典型畸胎瘤/横纹肌样瘤患儿中被发现[27]。
由于肾恶性横纹肌样瘤的罕见性,目前国际上尚无统一的标准化疗方案。既往通常遵循肾母细胞瘤治疗指南,根据较高/最高危险度分级来治疗。NWTS对142例患儿进行回顾性分析中 [NWTS-1、NWTS-2、NWTS-3、NWTS-4、NWTS-5(COG-Q9401/NCT00002611)],年龄、分期被确定为重要的预后因素。NWTS-5推荐使用依托泊苷、环磷酰胺和卡铂的化疗方案[25]。4年总生存率在诊断时年龄6个月以下的婴儿为9%,而2岁以上的患儿为41%,差异有统计学意义。Ⅰ~Ⅱ期患儿总生存率为42%,较晚期者总生存率为16%。研究表明,32例伴有中枢神经系统病灶的患儿仅1例存活[25]。在SIOP 93-01/2001方案中,多数患儿术前接受放线菌素D和长春新碱化疗再行手术,术后联合化疗(包括依托泊苷、卡铂、异环磷酰胺、阿霉素等)并行放射治疗,但总生存率仍较低(25%~30%)[28]。目前有报道证实了异环磷酰胺、卡铂、依托泊苷与长春新碱、阿霉素、环磷酰胺交替的联合化疗治疗晚期肾横纹肌样瘤的有效性,一些医疗中心建议对少数患儿进行大剂量化疗后的干细胞移植治疗[29]。在一项国际性的前瞻性研究中,100例颅外恶性横纹肌样瘤患儿(其中肾恶性横纹肌样瘤17例)接受多模式治疗,包括手术、放射治疗和化疗(长春新碱、环磷酰胺、阿霉素与环磷酰胺、卡铂、依托泊苷交替)。3年无事件生存率为32.3%,3年总生存率为38.4%[30]。
4 肾细胞癌
肾细胞癌通常发生在成年期,很少发生在儿童期。肾细胞癌占儿童恶性肿瘤的0.3%。平均发病年龄为10~11岁[31]。肾细胞癌的组织学亚型包括肾透明细胞癌、乳头状肾细胞癌、嫌色细胞肾癌、多房囊性肾癌、肾小管状囊性肾癌和Xp11.2易位性肾癌[32]。儿童最常见的肾细胞癌亚型是Xp11.2/转录因子E3(TFE3)相关性肾细胞癌,其特征是Xp11.2染色体上的TFE3基因易位。组织学特征是由透明细胞组成的乳头状结构,细胞核大,可见核仁,间质可见玻璃样变性,见图4a。TFE3为该病的免疫标志物,免疫组化可见细胞核TFE3染色阳性,见图4b。

图4 显微镜下典型的Xp11.2/TFE3相关性肾细胞癌形态(a:组织学形态,HE染色,×100;b:细胞核TFE3染色阳性,免疫组化染色,×100)
肾细胞癌可表现为血尿、腰痛和可触及的肿块。最常见的转移部位是肺(40%~65%)、骨(10% ~42%),而肝脏、膀胱、脑或胸膜也可能发生转移[33]。腹部超声与CT检查可发现肿瘤。在CT片上,肾细胞癌通常表现为一个大的、不均匀的实性肿块,但鉴别肾细胞癌与其他肾肿瘤需要组织学检查。肿瘤分期是影响生存的最重要因素。
肾细胞癌的主要治疗方法是根治性肾切除术和局部淋巴结切除术[34]。对于肿瘤体积小的局限性疾病患儿,可考虑行肾单位保留手术[35]。肾细胞癌一般对传统的细胞毒性药物治疗具有耐药性,对放射治疗的反应较差[34]。研究发现,肾细胞癌对任何方案的细胞毒性药物化疗应答率一般不超过10%[35]。Ⅰ期患儿5年生存率为90%或更高,Ⅱ、Ⅲ期患儿5年生存率为50%~80%,Ⅳ期患儿5年生存率为9%[34]。免疫疗法,如INF、IL-2可能对肾细胞癌控制有一定的作用。一些靶向制剂如索拉非尼、舒尼替尼、贝伐单抗、坦西罗莫司、帕唑帕尼和艾弗莫司已被批准用于成人肾细胞癌。但这些药物在儿童患儿中只进行了有限的试验[36]。
5 先天性中胚层肾瘤
先天性中胚层肾瘤是一种低度恶性的成纤维细胞肉瘤,约占儿童肾肿瘤的5%。它是3个月以下婴儿最常见的肾脏肿瘤,90%的患儿在1岁以下。男性发病率是女性的2倍。约15%的患儿可在产前检测到[37]。产前超声可能有助于诊断,因为本病可能导致羊水过多[38]。出生后CT检查通常显示一个大的、不均质的肾内实质性肿块,边缘清楚;静脉注射对比剂后,其强化程度低于邻近的正常肾实质[39]。
大体上,中胚层肾瘤表现为孤立的单侧肾肿块,与肾母细胞瘤难以区分。显微镜下可见由一致的梭形间充质细胞构成,见图5。根据组织病理学表现,先天性中胚层肾瘤分为经典型(24%)、细胞型(66%)和混合型(10%)[40]。该细胞变体携带一种特异性的 t(12;15)(p13;q25)易位,涉及 ETV6、NTRK3 基因,类似于婴儿纤维肉瘤中的易位[41]。
多数患儿只需要行根治性肾切除术。Ⅲ期患儿(不完全切除和/或切缘组织学检查阳性)以及确诊时年龄>3个月者,局部复发和转移性复发的风险明显增加。对这组患儿推荐行辅助化疗(主要是放线菌素D和长春新碱,有时加用阿霉素)。但是对于年龄2个月以下的未完全切除Ⅲ期患儿,可能不需要化疗[40,42-43]。本病患儿5年无事件生存率为94%,总生存率为96%[41]。
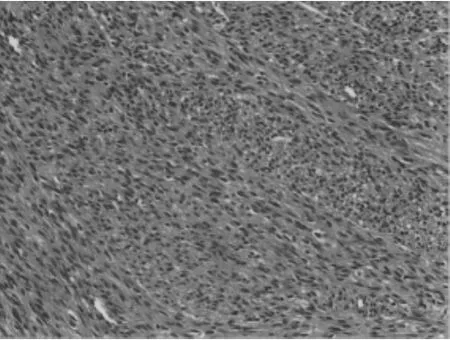
图5 显微镜下中胚层肾瘤形态(HE染色,×100)
综上所述,由于多中心合作小组的前瞻性随机试验,肾脏恶性肿瘤患儿生存率已显著提高。未来的研究可能会使用遗传标记对高危患儿进行分层,超越传统的分期系统和已知的组织学因素。
