啤酒污染菌酒花抗性基因型的多样性分析
2019-04-24郑飞云钮成拓朱林江唐栋健李永仙刘春凤王金晶
郑飞云 , 钮成拓 , 朱林江 , 唐栋健 ,李永仙 , 刘春凤 , 王金晶 , 李 崎 *
(1.江南大学 生物工程学院,江苏 无锡 214122;2.江南大学 工业生物技术教育部重点实验室,江苏 无锡214122;3.江南大学 食品安全与营养协同创新中心,江苏 无锡 214122;4.浙江工业大学 生物工程学院,浙江杭州 310014)
近些年,啤酒企业通过生产设备的更新换代,能有效地减少微生物污染事件,但是,微生物污染事件仍难以避免,而且对发酵过程以及终端产品的污染菌进行有效监控依旧是必不可少的[1]。然而,对这些污染菌的监控一直是啤酒工业的瓶颈问题,目前主要沿用传统的培养基检测方法。然而,传统培养基检测方法存在以下2方面不足[2]:第一,常用的微生物监控方法是富集培养基的方法,一般需要1周的时间,所以污染菌的检测结果具有严重的滞后性;第二,污染菌种类多样,菌株之间的腐败性能差异很大,啤酒腐败菌是从啤酒生产过程和环境中筛选而来,部分菌株具有较强啤酒腐败能力,而部分菌株能够存活但并不能腐败啤酒,其具有转变为强啤酒腐败能力菌株的潜力。因此,用培养基方法难以快速鉴定菌株的腐败性能,若采用传统的植菌实验方法,则需要花费1个月的时间。为了能够更加有效地监控污染菌,针对啤酒腐败菌的分子生物学的特征已有大量的研究,比如特征的酒花抗性基因[3-4]、具有较强腐败能力的菌株的表面抗原[5-6]、乳酸脱氢酶的特征电泳特性[7]、菌株质谱指纹特征[8]等。
酒花抗性是被研究最多的啤酒污染菌的典型特征。酒花中的苦味物质,是一种弱酸,在酸性的啤酒环境中,其未解离形式能够自由穿梭许多细菌的细胞壁和细胞膜,消除了胞内外的pH梯度,从而抑制或杀死细菌[9-10]。然后,少量细菌,通过适应性进化,能够克服酒花苦味物质毒性,在啤酒环境中繁殖,腐败啤酒的风味口感,影响啤酒生产。就现代啤酒酿造工厂而言,这类具有腐败能力的污染菌主要是乳杆菌属(Lactobacillus spp.),如典型的短乳杆菌(L.brevis)、植物乳杆菌(L.plantarum)、干酪乳杆菌(L.casei)、布式乳杆菌(L.buchneri)以及林氏乳杆菌(L.lindneri)等。此外在这些菌种中,不同的菌株,其腐败能力差异显著。所以,为了更有效地监测腐败啤酒的菌株,有必要对各个菌株的基因型多样性进行比较分析。
目前的研究表明,有些啤酒腐败菌的酒花抗性与ABC(ATP-bindingcassette)家族的多药物转运蛋白 HorA[3]和 RND(resistance-nodulation-cell division)家族的多药物抗性转运蛋白HorC[11]。HorA是第1个被证明与酒花抗性相关的蛋白,位于L.brevis ABBC45的内源质粒上[3],用二维电泳图谱分析确定为酒花苦味物质诱导型表达[12]。另一个与酒花抗性相关的基因是horC,也是在内源质粒上,若缺失该基因,则显著降低宿主菌株的酒花抗性,而过量表达该基因,可提高菌株的酒花抗性[11,13]。但是,仍缺乏这些基因与酒花抗性相关的直接证据。若将horA/horC作为跨种基因标记检测啤酒污染菌,结果表明在被研究的大部分腐败菌株中,其PCR扩增结果为阳性,不过,也有一些非腐败菌株,其扩增结果为阳性,即horA/horC的检测具有较高的假阳性率[14-15]。此外,以上实验菌株的基因型未被研究[13],其菌株的基因型多样性未知,菌株之间的差异难以判断。所以,horA/horC与多样性的啤酒污染菌菌株的相关性需要进一步研究。本次研究,针对来自5家啤酒厂分离的53株啤酒污染菌,研究菌株的PCR指纹多样性、表型多样性与酒花抗性基因型多样性之间关系,从而为啤酒污染菌有效监控提供基础。
1 材料与方法
1.1 菌株及培养条件
本次研究所使用的啤酒污染菌,为实验室保藏,来自国内长三角地区的多个不同啤酒厂的生产车间、酿造过程以及终端污染的产品。这些菌株经过16SrDNA测序鉴定,主要属于乳杆菌属。菌株的培养条件:采用MRS培养基或添加了四氢异-α-酸的MRS培养基,在28℃,进行厌氧培养。厌氧环境:培养皿的培养在厌氧罐中;液体培养在厌氧管或厌氧瓶中。
1.2 PCR指纹扩增及聚类分析
DNA提取:将各个菌株活化并接种到MRS液体培养基中厌氧培养;3 000 g离心5 min收集细胞;将收集的细胞用于DNA提取,采用之前报道的CTAB法;提取的DNA作为PCR扩增的模板。
PCR指纹扩增:采用指纹扩增的M13引物,其序列为:5’-GAG GGT GGC GGT TCT-3’。其扩增的反应体系如下 (25 μL):2.5 μL 的 10×PCR buffer,2 μL的 mmol/L dNTP,5 U 的 μL Taq聚合酶,4 μL 的25 mmol/L M13 引物,2 μL 的 DNA 模板,13.9 μL的双蒸水。PCR扩增程序如下:94℃变性3 min,42℃退火2 min,72℃延伸3 min,然后30个循环,94℃,45 s;42 ℃,40 s;72 ℃,120 s。 然后 72 ℃延伸 10 min后12℃保温。15 μL的PCR产物用1.5 g/dL的琼脂糖凝胶电泳进行分离,以GoldView为染料,通过凝胶成像仪获得PCR扩增指纹图谱。
PCR指纹的聚类分析:PCR指纹图谱采用Applied Maths公司的GelComparⅡ软件处理,选用Pearson系数计算指纹的相似性,并用UPGMA(Unweighted Pair-Group Method Using Arithmetic averages)方法构建距离树。
1.3 酒花苦味物质抗性分析
首先采用MRS培养基活性菌株:将保藏管中的啤酒污染菌接入装有20 mL MRS液体培养基的厌氧管中进行活化,接种量为5 g/dL,30℃下厌氧培养24~48 h;转接活化细胞到新鲜的20 mL MRS中,相同条件下厌氧培养12~24 h,使细胞生长至对数期;通过培养皿背面标记均分涂布区域:将方形梯度平板分为6块平行区域;每一块区分平均分为6个小格,从低浓度端开始依次将每个小格标记为格子1#-格子6#;取10 μL的培养液,均匀滴加到酒花梯度平板的相应位置;用涂布棒在平板的固定区域涂布均匀,并使培养液被吸干;在28℃,厌氧罐中,培养3-5 d;观察细胞生长情况。各个四氢异-α-酸最小抑制浓度(MIC)的计算如以下公式(1)所示。

其中MIC为菌株的四氢异-α-酸的最小抑制浓度;C高为高质量浓度一端的四氢异-α-酸的质量浓度;C低为低质量浓度一端的四氢异-α-酸的质量浓度;6为每个菌株生长的培养基平板上平均分为6格;n为实验菌株生长的格子数。
1.4 酒花抗性基因horA和horC的扩增
以PCR指纹扩增中提取的DNA为模板,对各个菌株的horA和horC进行扩增。horA基因扩增引物为:horA-F(5′-ATCCGGCGGTGGCAAATC-3′)和horA-R(5′-AATCGCCAATCGTTGGCG-3′),扩增片段的长度为324 bp。horC基因的扩增引物为:horCF (5′-GTCAACGAAGACAAAGGAGCTCTC-3′)和horC-R(5′-GGGCGAACCGTGAACAAATAG-3′),扩增片段的长度为1 116 bp。
基因horA和horC的扩增反应体系均如下(50 μL):5 μL 的 10×PCR buffer,1 μL 的 10 mmol/L 的dNTP,5 μL 的 25 mmol/L 的 MgCl2,5 U 的 Taq 聚合酶, 上下游的 10 mmol/L 的引物各 0.5 μL,2 μL 的DNA模板,36.5 μL双蒸水。PCR扩增程序如下:94℃变性 3 min,然后 30个循环,94 ℃,45 s;61 ℃,40 s;72℃,30 s。然后 72℃延伸5 min后 12℃保温。PCR产物采用1 g/dL的琼脂糖凝胶分离,并用GoldView染料,在凝胶成像仪中显色。
1.5 腐败啤酒能力分析
啤酒污染菌的腐败啤酒能力采用传统植菌实验,即将活化细胞直接接种到12°P脱气啤酒,其步骤如下:
1)菌株活化:将保藏管中的啤酒污染菌接入装有20 mL MRS液体培养基的厌氧管中进行活化,接种量为体积分数5%,30℃下厌氧培养24~48 h;转接活化细胞到新鲜的20 mL MRS中,相同条件下厌氧培养3 d,使细胞生长至稳定期。
2)啤酒培养基制备:对成品啤酒进行巴氏消毒,开盖用灭菌纱布包好静置2 d除气;将啤酒分装入已灭菌的厌氧管中,每管20 mL。
3)接种活化细胞:将已活化的菌液接入啤酒中,接种量为体积分数1%,初始细胞浓度约为106CFU/mL,25℃下培养1个月。能使啤酒变浑浊的即为啤酒腐败菌,并取200 μL通过96孔板测定最终OD600值。
2 结果与讨论
2.1 啤酒污染菌M13-PCR指纹的扩增
从实验室保藏的啤酒污染菌资源库中,挑选来自5个啤酒工厂环境或酿造样品中分离的53株污染菌。为了分析不同菌株之间的基因型差异,对其进行M-13指纹的扩增。M-13引物是根据细菌基因组中保守的微卫星核心序列,通过PCR扩增,得到多种不同长度的PCR产物,形成特征性指纹图谱[16]。M13-PCR指纹较为复杂,不同类型的指纹,代表不同的菌株,具有菌株专一性的特征;此外该指纹具有良好的重复性,可用于菌种的鉴定[17-18]。
对53株菌株的M13-PCR进行聚类分析,结果如图3和图4所示。这些菌种包括L.plarntarum(lpl)、L.brevis(lbr)、L.casei(lca)、L.rossiae(lro)、L.lactis(lbla)、L.paracasei(lpa) 和 L.manihotivorans(lma)。除了lpa 2-9-5和lpl 6-12-4,不同菌种之间,其指纹相似性均小于70%(图1和图2)。然而同属一种菌,但不同菌株之间指纹相似性差异较大,如来自不同啤酒厂的lpl 2-5-1和lpl 3-13-1,其指纹的相似性达到了90%;而来自同一家工厂的lpl 2-5-1和lpl 2-13-1的相似性只有28%(图1)。若是来自同一家工厂,同时具有非常相似的M13指纹,则可初步认为同一株菌株。所以,根据指纹菌类分析,53株菌的M13-PCR指纹相差较大,表明其基因型各不相同,具备一定的多样性。
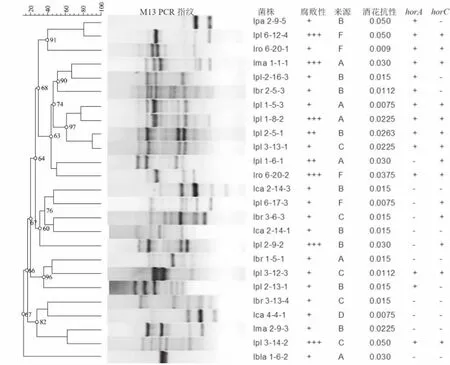
图1 啤酒腐败菌M13-PCR聚类分析及其生理特征Fig.1 Clustering analysis of M13-PCR results and biochemical properties of spoilage microbes which can grow in beer

图2 非啤酒腐败菌的M13-PCR聚类分析及其生理特征Fig.2 Clustering analysis of M13-PCR results and biochemical properties of spoilage microbes which cannot grow in beer
2.2 酒花苦味物质抗性的分析
为了快速分析各个菌株的酒花抗性能力,采用四氢异-α-酸梯度质量浓度的MRS平板,其质量浓度为0~0.5 g/L之间变化,如图3所示。将新鲜培养的细胞涂布于新鲜制作的梯度平板,经过厌氧培养后,根据生长菌膜的长度,计算各个菌株的四氢异-α-酸最小抑制浓度(MIC)。质量浓度梯度是依赖四氢异-α-酸的扩散形成,其制作过程要求2种高低质量浓度的培养基体积均等,同时下层培养基保持固定倾斜角度,平板的干燥和保存时间保持一致性。所有53株菌通过梯度平板法分析的四氢异-α-酸MIC如图1和图2所示,各个菌株的MIC在0.05~0.5 g/L之间不等,能够有效区分不同菌株之间的酒花抗性强弱,即可分为弱 (0.05~0.1 g/L)、中(0.11~0.29 g/L)、强(0.3~0.5 g/L)3 种。

图3 四氢异-α-酸梯度平板分析菌株的酒花抗性Fig.3 Analysis of the hop resistant ability of strains through gradient hop agar plates
2.3 啤酒腐败能力的比较分析
啤酒污染菌的腐败性,是指在啤酒环境中能够生长繁殖,从而对啤酒的生物安全性和啤酒风味口感构成威胁,是污染菌的一个重要生理表型。其腐败啤酒能力采用传统的植菌实验进行分析,即将新鲜活化的菌株接种到啤酒中,厌氧培养1个月,分析细胞生长情况。由于啤酒环境存在多种胁迫,包括含有酒花苦味物质、低pH的酸性环境、含量较少的营养物质、一定浓度的酒精等,所以细菌在啤酒中生长速率缓慢,且大部分细菌难以生长。针对53株啤酒环境分离的菌株,分析其在12°P啤酒中的生长情况,结果如表1所示。根据96微孔板测定的OD600值,将各个菌株的腐败啤酒性能分为无(-)、弱(+)、中(++)和强(+++)4 种。 其中,无腐败性的菌株为28株,弱的腐败性的菌株17株,而中和强的腐败性菌株各为2株和6株,所以各个菌株的腐败性存在显著差异。

表1 啤酒污染菌的腐败能力统计表Table 1 Summary of beer spoilage ability of spoilage microbes
2.4 酒花抗性基因的扩增
horA和horC也已被作为跨种基因标记,检测啤酒腐败菌。对53株啤酒污染菌的PCR扩增检测,如图4所示。其中图2(a)为horA检测结果,扩增片段长度为324 bp,图2(b)为horC的检测结果,片段长度为1 116 bp。结果表明L.plantarum 1-5-2和L.zymae 2-1-4的horA和horC检测均为阴性,L.plantarum 1-8-2的horA扩增较弱,但是扩增片段的大小一致。所有53株菌的检测结果总结在图1和图2中。
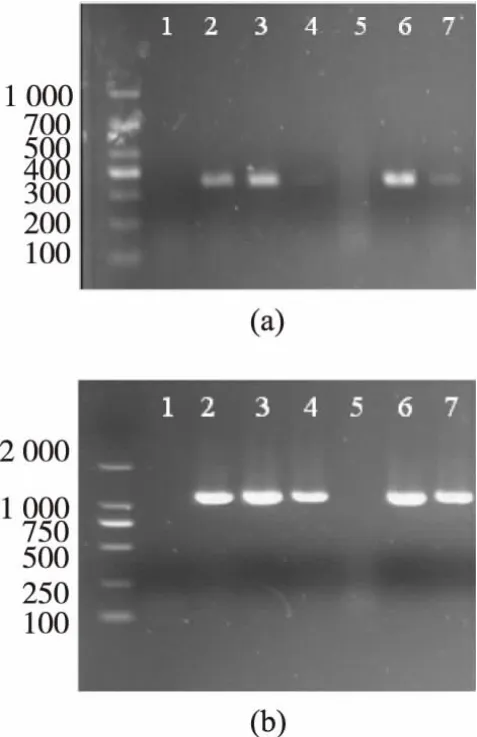
图 4 horA(A)与 horC(C)基因扩增Fig.4 PCR results of horA and horC
2.5 啤酒污染菌基因型和表型多样性分析
为了分析啤酒污染菌基因型与表型的相关性,总结并比较分析53株菌的基因型和表型,如图1和图2所示。首先根据腐败啤酒的能力,将菌株分为腐败菌与非腐败菌;其次将菌株的M13-PCR指纹通过GelCompar II软件进行聚类分析;再者,将菌株的来源工厂、腐败啤酒能力、酒花抗性能力、horA和horC扩增结果等信息进行总结和比较分析。
酒花抗性相关基因与酒花抗性能力、腐败啤酒能力之间关系如表2所示。其中,horA/horC扩增阳性,表示horA或horC扩增为阳性,该PCR检测结果被认为与啤酒腐败菌有密切关系,同时存在一定的假阳性率。本次研究结果表明,在28株腐败菌中,有22株菌的horA/horC扩增结果为阳性,其假阳性率高达78.6%,而25株非腐败菌中,有7腐败能力较弱的菌株,其horA/horC扩增结果为阴性,即假阴性率28%。不过,在腐败能力较强的8株菌株中,horA/horC扩增均为阳性,即腐败能力较强菌株含有horA或horC。horA/horC与菌株的酒花抗性能力相关分析表明,14株酒花抗性较强的菌株中有13株含有horA/horC,表明酒花抗性较强的菌株一般含有horA或horC。不过,12株酒花抗性较弱的菌株中,有7株菌含有horA或horC;而酒花抗性为中等强度的27株中,有7株菌不含horA和horC。所以,horA/horC的PCR扩增检测,具有较高的假阳性率和一定的假阴性率,不能充分鉴定菌株的腐败啤酒能力和酒花抗性能力,然而菌株的horA/horC基因在胞内的实际表达水平有待进一步研究。此外,有些菌株具有较强酒花抗性,但horA和horC的扩增均为阴性,如具有腐败能力的L.lactis 1-6-2和不具有腐败能力的L.casei 2-12-1,这些菌株中可能存在新的酒花抗性机制。
horA/horC扩增与菌种的关系进行比较分析,其中菌种选择含有4株及以上数量的菌种,结果如表3所示。本次选择的53株菌,主要是L.plantarum,共 27 株;其次是 L.casei/paracasei(9 株)、L.brevis(8 株)、L.lactis(4 株)。 在这些菌种中,L.plantarum的horA/horC扩增阳性率最高,达到了96.3%,显著高于其它3种菌,即horA/horC在L.plantarum具有较高的保守性。
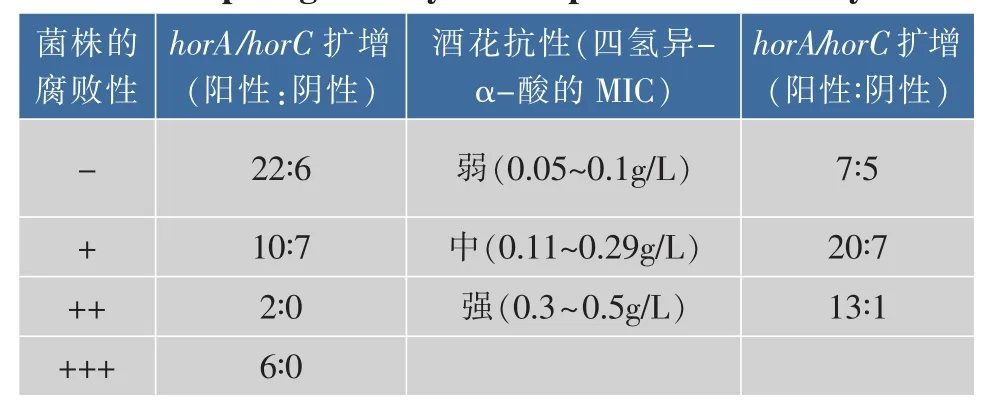
表2 horA/horC扩增与污染菌的啤酒腐败能力和酒花抗性能力之间的关系Table 2 Relationship among horA/horC genes,beer spoilage ability and hop resistance ability

表3 horA/horC扩增与污染菌菌种的关系Table 3 Relationship between horA/horC and spoilage bacteria strains
3 结语
啤酒污染菌对啤酒的生产安全性和质量稳定性构成威胁,对其有效监控是必不可少的环节。为了能够快速有效地监测啤酒腐败菌,horA/horC已被作为跨种基因标记,通过PCR扩增监测啤酒污染菌。为了分析horA/horC检测的准确性,本次研究针对来自5家啤酒厂的53株啤酒污染菌进行基因型和表型的比较分析。通过M13-PCR指纹的聚类分析表明,不同菌种的指纹相似性一般小于70%,同一菌种的不同菌株,其指纹也存在较大差异,表明53株啤酒污染菌具有丰富的基因型,个体差异显著。通过植菌实验分析了各个菌株的腐败啤酒能力和通过四氢异-α-酸梯度平板快速分析菌株的酒花抗性,并对horA/horC进行PCR扩增检测。比较各个菌株的基因型和表型表明,腐败能力较强和酒花抗性较强的菌株,horA/horC的检测结果一般为阳性;但很多没有腐败啤酒能力的菌株,也是horA/horC检测阳性,假阳性率高达78.%;少量具备弱腐败能力的菌株,其检测为阴性,即假阴性率为28%;部分较弱酒花抗性菌株的horA/horC扩增为阳性,不过这些基因的胞内表达水平有待进一步研究;2株较高酒花抗性菌株的horA/horC扩增为阴性,可能存在新的酒花抗性机制。此外,通过菌种间的比较分析表明,尽管horA/horC在L.bevis中被发现,但却在L.plantarum中具有较高的保守性。在后续研究中,拟通过进一步PCR扩增得到所有菌株horA和horC基因全长序列,分析其序列突变及蛋白质构象变化与其酒花苦味物质抗性之间的关系。
