对基于CA125、ADA及IL-27的C-P-O结核性胸腔积液评分系统的探讨
2019-04-23梁烙琪李玺肖强张倩罗方鸣荣福
梁烙琪 李玺 肖强 张倩 罗方鸣 荣福

【摘要】 目的:從胸腔积液的性质、具体病理情况、内科胸腔镜的可操作性探讨CA125联合ADA、IL-27在结核性胸腔积液的诊断价值,并构建基于这三者的C-P-O结核性胸腔积液评分系统。方法:回顾性分析2017年3月-2018年11月南方医科大学顺德医院确诊为胸腔积液并已行内科胸腔镜检查患者的胸腔积液的CA125、ADA、IL-27水平及胸腔镜活检的病理类型。以结核性与非结核性胸腔积液、渗出性与非渗出性病理为主的结核性胸膜炎、凝血功能延长性异常与正常、合并与不合并胸肺粘连、合并与不合并双侧胸腔积液进行两两分组,比较各分组下CA125、ADA、IL-27三指标水平的差异并明确主要涉及指标。以结核性与非结核性胸腔积液两组间水平比较筛选出来的影响指标构建C评分,分析各评分下胸腔积液性质、病理类型、凝血功能延长性异常、胸肺粘连占比的差异。结果:IL-27、ADA及CA125在结核性与非结核性胸腔积液水平存在差异(U=41.00、49.50、68.00,P=0.001、0.003、0.033),ADA的水平在结核性胸膜炎中的渗出性与非渗出性病理类型之间、APTT延长性异常为主的凝血功能异常与正常的凝血功能之间存在差异(U=19.00、42.50,P=0.035、0.038),CA125在胸肺粘连发生与否的水平存在差异(U=63.00,P=0.02)。双侧胸腔积液与上述三指标无明显相关(P>0.05)。筛选出ADA及IL-27参与C评分,3~4分下结核性胸腔积液占比较0~1高(P<0.05);4分下以渗出型为主要病理类型的占比较3分高(P=0.030);3分下APTT延长性异常占比较4分高(P=0.005);3~4分区较0~1分区更容易出现胸肺粘连异常(P=0.025)。结论:C评分下3~4分偏向结核性胸腔积液,0~1分偏向非结核性胸腔积液;4分相对3分更偏向于渗出性病理类型为主的结核性胸膜炎;3分较4分更容易出现以APTT延长性异常为主的凝血异常;3~4分相对0~1分更容易出现胸肺粘连。
【关键词】 CA125 ADA IL-27 结核性胸腔积液
[Abstract] Objective: To explore the value of carbohydrate antigen 125 (CA125), adenosine deaminase (ADA) and interleukin 27 (IL-27) in diagnosing tuberculous pleural effusion (TPE) by means of analysing type of pleural effusion, nature of pathology as well as the practicability for the operation of medical thoracoscopy and to establish the C-P-O tuberculous pleural effusion scoring system based on above three indexes. Method: To make a retrospective anlysis of concentration of CA125, ADA and IL-27 as well as the nature of pathology received from medical thoracoscopy of patients in Shunde Hospital of Southern Medical University from March 2017 to November 2018. To divide patients into several couple groups depending on TPE or non-TPE, exudative or non-exudative pathology, prolonged coagulation dysfunction or normal, combined or incompatible with pleural and pulmonary adhesion and bilateral or non-bilateral pleural effusion. The concentration of difference of CA125, ADA and IL-27 in each group will be anlysed in order to identify the main related indicator. The C score was constructed by the main related indicator that originated from the comparison of concentration of above indexes between TPE and non-TPE groups. The differences of the type of pleural effusion, pathological types, prolonged coagulation dysfunction and the rate of pleural and pulmonary adhesions under each score were analyzed. Result: The concentration of IL-27, ADA and CA125 in TPE and non-TPE were different (U=41.00, 49.50, 68.00, P=0.001, 0.003, 0.033). There are differences in the concentration of ADA between exudative and non exudative pathological types in tuberculous pleurisy, and between APTT prolonged abnormal coagulation and normal coagulation (U=19.00, 42.50, P=0.035, 0.038). There was difference in the concentration of CA125 between combined or incompatible with pleural and pulmonary adhesion. There was no significant correlation between the above three indexes and bilateral pleural effusion (P>0.05). ADA and IL-27 were screened for constructing the C score. The percentage of TPE was higher in 3-4 score than 0-1 score (P<0.05). The percentage of exudative type was higher in group scored as 4 than that as 3 (P=0.030). The percentage of prolonged abnormality of APTT was higher in group scored as 3 than that as 4 (P=0.005). The percentage of pleural and pulmonary adhesion was higher in group scored as 3-4 than that as 0-1 (P=0.025). Conclusion: Under the C score, 3-4 points inclined to TPE while 0-1 points inclined to non-TPE. 4 points were more inclined to tuberculous pleurisy with exudative pathological type than 3 points, 3 points were more prone to coagulation abnormality with prolonged APTT abnormality than 4 points, 3-4 points were more prone to pleural and pulmonary adhesion than 0-1points.
[Key words] CA125 ADA IL-27 Tuberculous pleural effusionFirst-authors address: Guangdong Medical University, Zhanjiang 524000, China
结核性胸腔积液(tuberculous pleural effusion,TPE)是胸腔积液成因中重要的一环[1]。虽然胸腔积液标志物如腺苷酸脱氨酶(adenosine deaminase,ADA)及白介素-27(interleukin-27,IL-27)等在TPE中的诊断价值已在众多研究中获得了认可[2],但其仅局限于积液的定性,未对具体病理类型行进一步的探讨,其最终确诊亦只能依靠行内科胸腔镜等有效手段,而后者的可操作性仍需要在临床上做评估。近年内,有不少学者透过研究发现了糖类抗原125(carbohydrate antigen-125,CA125)在TPE等非肿瘤性疾病的应用价值,其中不乏对行内科胸腔镜可行性构成影响的疾病或风险因素[3-5]。因此,本文旨在通过胸腔积液的性质、具体病理情况、内科胸腔镜的可操作性探讨CA125联合ADA、IL-27在结核性胸腔积液的诊断价值,并构建基于这三者的性质-病理-内科胸腔镜可操作性结核性胸腔积液评分系统(character-pathologica histology-operation tuberculous pleural effusion scoring system,C-P-O TPE scoring system),进一步优化结核性胸腔积液的诊断过程。
1 资料与方法
1.1 一般资料
将2017年3月-2018年11月南方医科大学顺德医院确诊为结核性胸膜炎伴胸腔积液的19例患者作为观察组(结核组),其中男14例,女5例,年龄45(28,55)岁,另将非结核性胸部疾患伴胸腔积液的13例患者作为对照组,其中男6例,女7例,年龄53(32,66)岁,其中肺癌伴胸腔积液4例,肺脓肿伴胸腔积液2例,弥漫大B细胞瘤伴胸腔积液1例,肺炎旁胸腔积液6例。(1)入选标准:结核性胸腔积液,影像学提示存在胸腔积液并尚没进行抗结核诊断性治疗且符合以下条件之一:①胸腔镜活检组织病理学提示典型结核性改变或肉芽肿改变或其他拟诊为结核的病理类型;②痰培养为结核分枝杆菌。非结核性胸腔积液诊断标准,影像学提示存在胸腔积液且符合以下条件之一:①细菌性肺脓肿:胸腔积液中找到致病菌;②肺癌:胸腔积液中找到癌细胞或胸腔镜活检可明确病理提示为癌性异形细胞;③系统性红斑狼疮性胸腔积液:有系统性红斑狼疮活动期表现且合并胸腔积液;④淋巴瘤伴胸腔积液:胸膜活检镜下病理可及异型增生的大圆形细胞且合并胸腔积液。(2)排除标准:①同时合并结核性及非结核性胸腔积液;②已行诊断性抗结核治疗。两组患者一般资料比较差异均无统计学意义(年龄比较采用秩和检验,U=94.50,P=0.270;性别比较采用Fisher确切概率法,P=0.150)
1.2 方法
标本处理及检测方法:胸腔积液标本均通过胸腔镜活检取得,获取标本将送至笔者所在医院支气管镜实验室使用CENCE湘仪H2050R离心机以5 000 r/min的转速离心10 min后,取上清液10 ml于胸腔积液管并置-80 ℃冰箱冷藏至检测前。CA125使用直接化学发光法测定,采用ADVIA Centaur XP仪器进行操作,试剂由SIMENS公司提供。IL-27使用ELISA法测定,采用科华ST360酶标仪进行操作,试剂由江莱生物公司提供。ADA使用生化法测定,采用迈瑞BS-800M仪器进行操作,试剂由广州科方公司提供,所有指标的阳性阈值参照对应试剂盒。
1.3 统计学处理
采用SPSS 21.0及Microsoft Excel 2010统计学软件进行分析,对各组计量资料进行正态性检验,符合正态分布者用t检验,不符合正态分布者用秩和检验;组间率的比较采用卡方检验,P<0.05为差异有统计学意义。CA125、ADA、IL-27的测定水平以中位数四分位数[M(P25,P75)]或中位数(最小值,最大值)表示,采用Mann-Whitney U检验方法分别比较三个指标在结核性/非结核性胸腔积液、渗出性/非渗出性病理为主的结核性胸膜炎、凝血功能延长性异常/正常、合并/不合并胸肺粘连、合并/不合并双侧胸腔积液组间的差异性,筛选出有统计学意义的指标。对在结核性/非结核性胸腔积液组筛选出来的有统计学意义的指标进行包括受试者工作特征曲线(receiver operating characteristic curve,ROC)、曲线下面积(area under curve,AUC)、灵敏度、特异度、约登指数在内的诊断效能评价,从中筛选出最优指标或组合,通过Logistics回归计算获得回归系数,根据权重构建每个对象下的C评分(character score)。以Fisher确切概率法比较各分值下渗出性病理类型结核性胸膜炎、凝血功能延长性异常、合并胸肺粘连的占有率,分别构建P评分(pathologica histology score)及O评分(operation score)。
2 结果
2.1 性质指向
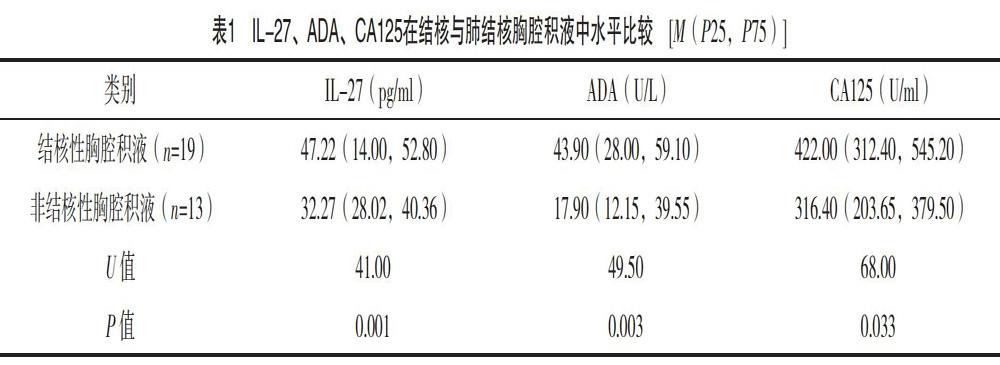
CA125、ADA、IL-27在结核及非结核胸腔积液中的水平差异有统计学意义(P<0.05),且在结核性胸腔积液患者中的水平较高,见表1。灵敏度、约登指数、AUC最高的指标或组合为IL-27+ADA与CA125+ADA+IL-27;特异度最高的指标组合为CA125+ADA与CA125。虽然CA125在单一指标下特异度较理想,可达92.3%,但其灵敏度、约登指数及AUC均在众多指标或指标组合中最不理想。在联合ADA或IL-27后,虽然其灵敏度获得较明显的改善,但特异度的改善不明显,整体灵敏度亦未高于ADA及IL-27單指标下的水平。在组合IL-27+ADA联合CA125后,其AUC不升反降,提示该组合下诊断效能优于三者的组合。因此,在积液定性层面上组合IL-27+ADA优势更明显,其灵敏度、特异度、约登指数、AUC分别为100%、76.9%、0.769、0.919,见表2。图1为IL-27、ADA、CA125单独及联合检测下的ROC曲线。
2.2 病理指向
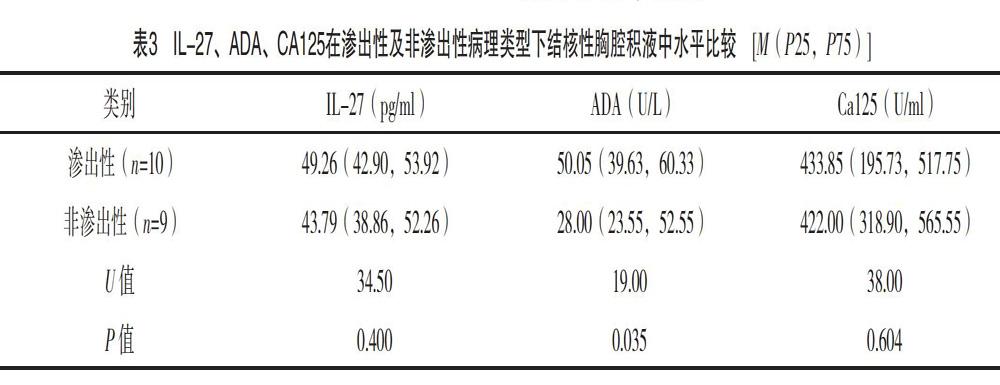
在19例结核性胸腔积液患者中,以渗出性为主的病理类型共10例,以非渗出性为主的共9例(增殖型2例、干酪型1例、混合型6例)。CA125、ADA、IL-27在不同病理类型下水平比较,提示ADA水平在渗出性及非渗出性病理类型间比较差异有统计学意(P<0.05),且以渗出性为主的病理类型下水平较非渗出性高。IL-27、CA125在不同病理类型间比较差异无统计学意义(P>0.05),见表3。
2.3 操作指向
2.3.1 凝血功能异常 ADA水平在凝血酶时间及活化部分凝血活酶时间延长性异常时的水平较正常要低,差异有统计学意义(U=8.00,P=0.017;U=42.50,P=0.038),见表4。
2.3.2 胸肺粘连 合并胸肺粘连患者胸腔积液CA125水平较不合并者高,差异有统计学意义(U=63.00,P=0.020),见表5。
2.3.3 双侧胸腔积液 是否存在双侧胸腔积液与CA125、IL-27及ADA水平无明显相关(U=56.00、60.00、65.00,P=0.579、0.725、0.920),见表6。
2.4 评分
根据初步统计学结果,积液性质指向评分(C评分)将纳入IL-27、ADA两大指标,病理指向评分(P评分)将纳入ADA指标,操作指向评分(O评分)将纳入CA125及ADA两个指标。
2.4.1 性质指向评分 以纳入指标IL-27、ADA在诊断结核性胸腔积液下约登指数最大值对应数值为截断值,透过Logistics回归方法计算对应的回归系数及分值(表7),以获得分值计算结核性及非结核性胸腔积液下具体评分。由表8可见,结核性评分较非结核性胸腔积液评分高,差异有统计学意义(U=11.50,P<0.05)。各分段下结核性胸腔积液占有比情况见表9。由表9可见,3~4分区段下结核性胸腔积液占有比较0~1分区段高,差异有统计学意义(P<0.05)。
2.4.2 病理指向评分 由表10可见,4分下以渗出型为主要病理类型的占比较3分高,差异有统计学意义(P=0.030);4分下ADA水平较3分高,差异有统计学意义(U=14.00,P=0.040)。
2.4.3 操作指向评分
2.4.3.1 凝血异常 由表11可见,3分及4分下APTT延长性异常占比差异有统计学意义(P=0.005),3分较4分更容易出现以APTT延长性异常为主要表现的凝血功能异常。
2.4.3.2 胸肺粘连 由表12可见,3~4分区较0~1分区更容易出现胸肺粘连异常,差异有统计学意义(P=0.025);而在3~4分区下CA125水平较0~1分区下高,差异有统计学意义(U=68.00,P=0.043)。
3 讨论
3.1 IL-27、ADA、CA125联合诊断价值分析
糖类抗原125(carbohydrate antigen 125,CA125)主要在上皮细胞合成并储存在细胞内[6-7],在健康人群和大多数良性疾病患者中,由于上皮细胞之间能较好地连接,CA125往往不能大量释放参与血液循环,在血清及胸腔积液中所测得的水平很低。而在结核感染的过程中,结核分枝杆菌及其代谢分解产物释放到胸膜腔,引起CD4+T淋巴细胞介导调控的超敏反应的发生,过程中触发的炎症反应将使胸膜毛细血管渗透性增加、壁胸膜淋巴间隙受损,在血液或淋巴液滤过增加的同时为CA125提供了渗透的路径[8],使CA125在胸腔积液的水平升高。AOKI等[9-10]透过比较结核性及非结核性(包括肿瘤性、脓胸、肺炎旁、自身免疫性等)胸腔积液患者的血清CA125水平就发现前者水平高于后者,而且在接受抗结核治疗后,患者的血清CA125水平亦较前有明显下降的趋势。而在另外一项研究中,有学者透过抗CA125标记的特异性抗体的方法,发现了结核患者的胸膜上皮细胞广泛分布对应的抗体,提示存在较高浓度的CA125分泌的情况[11],为TPE患者CA125水平的提高提供进一步的证据。虽然CA125在TPE的在诊断中具有一定的意义,但其诊断效能却不如人意。国内有学者的Meta分析结果提示CA125在诊断结核性胸腔积液的诊断效果灵敏度仅为0.48,特异度为0.85[12]。而在本研究中,其灵敏度为57.9%,特异度为92.3%,不及ADA及IL-27,即使在组合上将其联立,其对定性诊断的贡献亦不大(三者联合后AUC较单联合ADA及IL-27低,前者为91.1%,后者为91.9%)。再者,对于女性患者,在测定CA125在其胸腔积液的水平前,亦有必要排除其他可能导致水平升高的非结核性因素,如卵巢肿瘤等[13]。因此,在胸腔积液定性诊断上虽然CA125具有一定的作用,但其局限性亦較明显,联合运用CA125在胸腔积液的水平界定积液性质作用有限。但对于胸肺粘连,CA125具有一定的诊断意义。在本研究中,镜下合并胸肺粘连的胸腔积液患者的CA125水平较不合并者高,前者为409.40(317.80,547.50)U/ml,后者为312.40(220.85,385.30)U/ml,差异有统计学意义(U=63.00,P=0.02)。Huang等[14-16]透过研究亦发现,机械冲击压力或者炎症损伤可透过直接作用于上皮细胞致其完整性破坏间接引起CA125释放增多。而在炎症或损伤的情况下,纤维蛋白溶解受阻,同时亦可促进胸膜粘连的发生,其程度越重,胸腔积液中的LDH水平就越高[17-18]。而CA125水平可与LDH水平呈正相关[5],因此CA125水平对胸肺粘连具有重要的参考意义,其水平越高,提示胸肺粘连的可能性越大。
腺苷酸脱氨酶(adenosine deaminase,ADA)是嘌呤核苷代谢中多种酶的重要一员,在嘌呤补救合成途径中,ADA充当着促进腺苷酸不可逆脱氨基一环的重要角色[19]。早在1978年,Piras等[20]学者透过对联合免疫缺陷病的研究,就发现了ADA在TPE诊断中的价值。而Goto等[21-23]透过Meta分析更进一步明确了ADA在TPE的诊断效能(联合灵敏度及特异度最高可达92%),而本研究的研究结果亦与其相近。然而,该指标仍具有一定的局限性。Abrao等[24-25]透过一项基于年龄层分组的ADA水平的研究发现,ADA水平可随着年龄增长有下降的趋势,这就增加了一部分患者结核性胸腔积液漏诊的概率。因此,虽然该指标在结核性胸腔积液的定性诊断具有一定的作用,但单指标下使用仍具有一定的不足,为联立诊断提供了可能。另一方面,在本研究里面,以TT及APTT延长性异常为主的凝血功能异常患者,其胸腔积液的ADA水平较凝血功能正常时低,差异有统计学意义(U=8.00,P=0.017;U=42.50,P=0.038),提示ADA在判断凝血异常,尤其是以凝血酶时间(TT)及活化部分凝血活酶时间(APTT)延长性异常为主的凝血功能异常亦具有一定的作用。早在1985年,Valentine等[26]透过研究就发现溶血患者的血清ADA水平与正常人存在着差异。而有研究亦发现,当红细胞被破坏时(如发生溶血等),ADA会从红细胞当中释放出来,导致其浓度发生变化[27],揭示了ADA与凝血功能的密切关系,为以ADA水平判断凝血异常提供了可能。同时,本研究亦发现ADA与结核性胸膜炎中的渗出性病理类型存在一定的关系。由表3可见,以渗出性病理类型为主的结核性胸腔积液患者的ADA水平较非渗出性高,前者为39.80(28.00,54.10)U/L,后者为17.00(7.80,43.70)U/L(U=19.00,P=0.035)。在结核感染的情况下,树突状细胞及巨噬细胞均分泌IL-12[28-29],在IL-12的刺激下,被感染细胞的IL-6水平的表达将会增加,后者可直接或间接促进TF(组织因子)的释放,在启动外源性凝血机制下使纤维蛋白溶解,进而使纤维素释放增多[30-31]。另一方面,在机体合并结核性胸腔积液的时候,淋巴细胞的增殖及分化程度将增加以启动T淋巴细胞免疫应答过程,与此同时ADA水平将负反馈升高以务求解除高浓度腺苷对T淋巴细胞增殖的抑制作用,而IL-6则具有能够促进淋巴细胞增殖的作用,从而能间接促进ADA水平的提升[20,32,33]。因此纤维素渗出水平与ADA水平存在着同向上升的趋势,印证了ADA与以纤维素渗出为主的结核性胸膜炎的渗出型病理类型的关系。
白介素-27(interleukin 27,IL-27)属于细胞因子的一种,是一种主要由EB病毒诱导基因3(epstein-Barr virus-induced gene 3,EBi3)和IL-27p28构成的异聚体[34]。早在2012年,Wei-Bing等[35]透过研究就明确了肺结核患者中胸腔积液患者的IL-27水平显著高于恶性肿瘤、感染及以漏出液为主的胸腔积液中的水平,这与文献[36]进行的大型对比研究相近。而在本研究中,亦有类似的结果。而Yan-Bin等[37]在一项比较IL-27、ADA、INF-γ诊断效能的研究中亦指出,IL-27在胸腔积液的诊断效能可媲美甚至超越剩余两者,其敏感度、特异度可分别达95.0%以及97.6%,进一步突出了IL-27的诊断优势。然而,迄今为止,IL-27在进行结核性胸腔积液的诊断过程中尚缺乏一个相对理想的阈值。Porcel[38]曾分析比较过现存关于IL-27在胸腔积液定性层面研究中的阈值,发现其范围可从391 ng/L到1 007 ng/L,跨度之大提示着单一指标以作区分的工具存在着一定的盲目性。因此对于结核性胸腔积液的诊断,更推荐IL-27联立如ADA等其他指标参与其中。
3.2 C-P-O结核性胸腔积液评分系统构建及应用
在本研究中,透过分析明确了CA125联合ADA、IL-27的诊断组合在TPE诊断过程中的重要意义的前提下,拟构建基于三者的C-P-O结核性胸腔积液评分系统(C-P-O tuberculous pleural effusion scoring system)。C指性质(character),指代积液性质指向结核性或非结核性;P指病理组织学(pathologica histology),指代结核性胸腔积液对应胸腔具体镜下病理类型指向;O指操作(operation),指代是否需要进行内科胸腔镜的操作指向。
3.2.1 C评分(性质指向评分,character score) 综合表1、表2及图1筛选出参与C评分的适用指标组合IL-27及ADA,以各指标在诊断TPE评分时约登指数最大值下具体数值为截断值,透过Logisitc回归,构建C评分模型(表7),按照评分模型对所有病例进行评分,结核组平均4(4,4)分,非结核组平均1(0,2)分,两组差异有统计学意义(U=11.50,P<0.05,表8),而3~4分区段下结核性胸腔积液占有比较0~1分区段高(表9),即在0~1分区段诊断更偏向于非结核性胸腔积液,而3~4分区段的诊断指向于结核性胸腔积液。
3.2.2 P评分(病理指向评分,pathologica histology score) TPE主要来源于结核性胸膜炎,而结核性胸膜炎主要有以纤维素渗出为主的渗出性炎、以结核结节增生为主的增殖型及以凝固性坏死表现为主的干酪样坏死的3个镜下类型 [39]。综合表3、表10可见,ADA水平在渗出性及非渗出性病理类型间具有统计学差异,且以渗出性为主的病理类型下水平较非渗出性高。结合C评分可获知,4分下以渗出型为主要病理类型的占有率较3分高(P=0.030)。因此,对于C评分在4分区的结核性胸腔积液患者,其镜下病理类型考虑渗出型可能性较大,而3分区则为非渗出型可能性较大。
3.2.3 O评分(操作指向评分,operation score) 内科胸腔镜活检较传统的开胸活检更安全,但亦存在着不可忽视的并发症,如气胸、损伤、感染、皮下气肿等[40]。因此,在操作前的风险评估仍具有重要的意义,在本研究中,所记录到的风险因素主要集中在凝血功能异常、双侧胸腔积液以及胸肺粘连三个方面。在凝血功能异常分析当中可获知APTT及TT延长性异常与ADA水平密切相关,ADA水平在两者延长性异常时较低(表4)。结合C评分,可见在3分区下出现APTT延长性异常的占有率较4分区下高(前者为4/5,后者为1/15,P=0.005),而TT延长性异常在各分区占有率间无明显统计学差异,提示在3分区下更容易出现APTT延长性异常为主的凝血功能异常。在胸肺粘连异常分析当中可获知,胸肺粘连与CA125水平密切相關,其水平越高,越容易发生胸肺粘连(表5、表12),而3~4分区下CA125水平亦较0~1分区高,前者为415.70(270.65,546.93)U/ml,后者为314.40(220.48,369.95)U/ml(U=68.00,P=0.043)。结合C评分,可见在3~4分区下出现粘连占有率较0~1分区下高(P=0.025),提示在3~4分区下更容易出现胸肺粘连异常。而双侧胸腔积液在三个指标当中的水平未有明显统计学上的差异(表6)。因此,对于C评分下0~1分区患者,其行内科胸腔镜的风险较少。对于3~4分区患者,其更容易具有APTT延长性延长为主的凝血异常或胸肺粘连的风险因素。
3.2.4 评分系统的应用流程 患者首先进行C评分,若C评分与临床症状、体征、病史等评分外因素指向吻合,且指向结核性胸腔积液,则对其行P评分,对于处于4分区下,考虑病理类型为渗出性可能性较大;对于处于3分区下患者,考虑为非渗出性可能性较大。若肯定P评分,则生成初步病因病理诊断,若要进一步肯定明确,或C评分与评分外因素不吻合,则可行O评分。对于处于0~1分区患者,其行内科胸腔镜风险较少,可积极行内科胸腔镜。而对于处于3~4分患者,其容易出现APTT延长性异常及胸肺粘连等风险因素,这类患者暂不建议行内科胸腔镜活检,可酌情行诊断性治疗。
C-P-O结核性胸腔积液评分系统实质属于性质-病理-操作评价系统。国内外既往亦有针对结核及非结核性胸腔积液鉴别诊断的模型。如孙勤等[41]构建的10分法的评分系统、Sales等[42]基于胸水外观与各指标联合的模型等。上述系统或模型主要集中在胸腔积液的定性层面上,并没对具体胸膜病理类型及内科胸腔镜可操作性提供评价。而本研究率先联合应用CA125、ADA、IL-27三大指标实行对结核性胸腔性积液的诊断,从性质指向、病理指向、操作指向三个方面进行评价,在明确积液性质的基础上进一步提供具体的病理类型及诊疗方向,具有一定的创新性。但本研究仍存在一定的不足:(1)本研究拟定的性质指向模块(即C评分)下的诊断效能与既往研究亦接近,但略低于个别研究,考虑主要与标本数量不足相关,既往研究标本数量均集中在数百以上,但本研究标本数量控制在100以内。(2)在结核性胸腔积液的病理指向方面,本研究只能区分渗出性及非渗出性类型,未能更好地对增殖型、干酪型及混合型做出定性判断,具有一定的局限性;在鉴别具体病理类型时其判断效果很大程度上基于操作时选取的视野,容易导致病理定性上资料的偏倚。(3)在操作指向方面,本研究入选人员的风险因素主要集中为凝血异常、胸肺粘连及双侧胸腔积液,对其他风险因素的纳入缺乏,容易低估或忽略了部分风险。对于胸肺粘连,并没有具体根据粘连程度进行细化划分,只单纯从性质上判断粘连存在与否,在操作指导上具有一定的不足。另一方面,在双侧胸腔积液的明确情况下,亦无法明确其与上述三大指标的关系。因此,C-P-O结核性胸腔积液评分系统在临床上的推广应用仍有待进行进一步更为严谨、标本数量更多的研究分析去完善。
[16] Feifei H,Jie C,Yimin L,et al.New mechanism of elevated CA125 in heart failure:The mechanical stress and inflammatory stimuli initiate CA125 synthesis[J].Med Hypotheses,2012,79(3):381-383.
[17] Akerberg D,Posaric-Bauden M,Isaksson K,et al.Prevention of Pleural Adhesions by Bioactive Polypeptides-A Pilot Study[J].Int J Med Sci,2013,10(12):1720-1726.
[18] Silvia B,Martín-Juan,Porcel,et al.Diagnostic and Prognostic Implications of Pleural Adhesions in Malignant Effusions[J].J Thorac Oncol,2008,3(11):1251-1256.
[19] Segura R,Pascual C,Oca?a I,et al.Adenosine Deaminase in Body Fluids:A Useful Diagnostic Tool in Tuberculosis[J].Clin Biochem,1989,22(2):141-148.
[20] Piras M,Gakis C,Budroni M,et al.Adenosine deaminase activity in pleural effusions:an aid to differential diagnosis[J].Br Med J,1978,2(6154):1751-1752.
[21] Goto M,Noguchi Y,Koyama H,et al.Diagnostic value of adenosine deaminase in tuberculous pleural effusion:a meta-analysis[J].Ann Clin Biochem,2003(40):374-381.
[22] Greco S,Girardi E,Masciangelo R,et al.Adenosine deaminase and interferon gamma measurements for the diagnosis of tuberculous pleurisy:a meta-analysis[J].Int J Tuberc Lung Dis,2003,7(8):777-786.
[23] Xuwei G,Heping X.Diagnosis of tuberculosis pleurisy with adenosine deaminase (ADA):a systematic review and meta-analysis[J].Int J Clin Exp Med,2014,7(10):3126-3135.
[24] Abrao F C,de Abreu I R L B,Miyaki D H,et al.Role of adenosine deaminase and the influence of age on the diagnosis of pleural tuberculosis[J].Int J Tuberc Lung Dis,2014,18(11):1363-1369.
[25] Seung Jun L,Hyun Sik K,Seung Hun L,et al.Factors Influencing Pleural Adenosine Deaminase Level in Patients With Tuberculous Pleurisy[J].Am J Med Sci,2014,348(5):362-365.
[26] Valentine W,Tanaka K,Paglia D.Hemolytic Anemias and Erythrocyte Enzymopathies[J].Ann Intern Med,1985,103(2):245-247.
[27] Bilan V,Schneider F,Novelli E,et al.Experimental Intravascular Hemolysis Induces Hemodynamic and Pathological[J].Pulm Circ,2018,8(3):1-37.
[28] Nau G,Richmond J,Schlesinger A,et al.Human macrophage activation programs induced by bacterial pathogens[J].Proc Natl Acad Sci,2002,99(3):1503-1508.
[29] Hickman S,Chan J,Salgame P.Mycobacterium tuberculosis induces differential cytokine production from dendritic cells and macrophages with divergent effects on naive T cell polarization[J].J Immunol,2002,168(9):4636-4642.
[30] Grzanka R,Damasiewicz-Bodzek A,Kasperska-Zajac A.Interplay between acute phase response and coagulation/fibrinolysis in chronic spontaneous urticaria[J].Allergy Asthma Clin Immunol,2018,14(27):1-8.
[31] Nau G,Schlesinger A,Richmond J,et al.Cumulative Toll-like receptor activation in human macrophages treated with whole bacteria[J].J Immunol,2003,170(10):5203-5209.
[32] Jayne C H,Fiona C,Stephen J H.Deficiency of IL-2 or IL-6 reduces lymphocyte proliferation,but only IL-6 deficiency decreases the contact hypersensitivity response[J].Eur J Immunol,2000,30:197-203.
[33] Hope J C,Dearman R J,Debickih R J,et al.lnterleukin-6 Production by Draining Lymph Node Cells following Primary Contact Sensitisation of Mice:Relationship to the Proliferative Response[J].Int Arch Allergy Immunol,1994,103:378-383.
[34] Pflanz S,Timans J,Cheung J,et al.IL-27,a Heterodimeric Cytokine Composed of EBI3 and p28 Protein, Induces Proliferation of Naive CD4 T Cells[J].Immunity,2002,16(6):779-790.
[35] Wei-Bing Y,Qiu-Li L,Zhi-Jian Y,et al.Cell Origins and Diagnostic Accuracy of Interleukin 27 in Pleural Effusions[J].PLoS ONE,2012,7(7):1-7.
[36] Liu Y,Ou Q,Zheng J,et al.A combination of the QuantiFERON-TB Gold In-Tube assay and the detection of adenosine deaminase improves the diagnosis of tuberculous pleural effusion[J].Emerging Microbes & Infections,2019,5(1):1-6.
[37] Yan-Bin W,Zhi-Jian Y,Sou-Ming Q,et al.Combined detections of interleukin 27,interferon-γ,and adenosine deaminase in pleural effusion for diagnosis of tuberculous pleurisy[J].Chinese Medical Journal,2013,126(17):3215-3221.
[38] Porcel J M.Advances in the diagnosis of tuberculous pleuritis[J].Ann Transl Med,2016,4(15):1-7.
[39] Pilheu J.Tuberculosis 2000:problems and solutions[J].Int J Tuberc Lung Dis,1998,2(9):696-703.
[40] Michaud G,Berkowitz D,Ernst A.Pleuroscopy for Diagnosis and Therapy for Pleural Effusions[J].Chest,2010,138(5):1242-1246.
[41]孫勤,肖和平,沙巍.结核性胸膜炎临床诊断评分模型的建立及其意义[A]//中华医学会结核病学分会学术会议[C]:2011:188-192.
[42] Sales R,Vargas F,Capelozzi V,et al.Predictive models for diagnosis of pleural effusions secondary to tuberculosis or cancer[J].Respirology,2009,14(8):1128-1133.
(收稿日期:2019-07-24) (本文编辑:张亮亮)
