箭筈豌豆品种间遗传差异的SSR分析及指纹图谱构建
2019-04-23闵学阳韦兴燚刘文献张正社金小煜NDAYAMBAZABoniface吴洪林李昱王彦荣
闵学阳,韦兴燚,刘文献,张正社,金小煜,NDAYAMBAZA Boniface,吴洪林,李昱,王彦荣
(兰州大学草地农业生态系统国家重点实验室,兰州大学农业农村部草牧业创新重点实验室,兰州大学草地农业科技学院,甘肃 兰州 730020)
遗传育种材料来源的选择,对农业生产、遗传改良具有重要意义,另外,遗传多样性很大程度上决定了种质资源的丰富度,是物种适应外界环境和进化的前提;同时,遗传多样性研究能够反映栽培物种的育种水平、发现新的基因资源和改良现有的育种材料[1-3]。近年来,随着分子生物学的兴起,DNA分子标记技术已被应用于植物分类、品种鉴定、指纹图谱构建和遗传多样性分析等研究中[4-6]。其中,简单重复序列(simple sequence repeats,SSR)分子标记具有共显性、单碱基高分辨率、操作简单、重复性好、可检测等位基因和随机均匀分布在扩增基因组内等优点,已成为植物杂交育种和种群遗传多样性等研究领域中最常用的分子标记之一[7-8]。因此,利用SSR分子标记技术分析物种遗传差异,将为物种遗传多样性和分子标记辅助育种的研究奠定基础。
箭筈豌豆(Viciasativa)作为一种重要的一年生、自花授粉、二倍体豆科牧草,具有生育周期短、较高的营养价值和经济效益,同时具有固氮、改善土壤结构、广泛的适应性和良好的抗寒能力,是一种优良的饲草和绿肥兼用牧草,在土耳其、中国、中亚、南美等地区普遍种植[9-11]。但目前对箭筈豌豆遗传结构及群体多样性的研究相对较少,分子标记数量十分有限,远不能满足箭筈豌豆遗传多样性研究与分子育种工作的需要。随着测序技术的快速发展和成本的降低,基于转录组数据挖掘有价值的SSR位点已在多种植物中得到了成功验证。
转录因子(transcription factors,TFs)是一类能够直接或间接与基因启动子区域中顺式作用元件发生特异性作用,能够激活或抑制下游被调控基因的转录[12-13]。随着测序技术的发展和基因组学工具的开发使用,许多物种的转录因子已被鉴定和注释。截至目前,已从高等植物中分离鉴定出100多个转录因子家族[14]。由于转录因子的可用性、连续富集和明确的功能域,可作为优异的候选基因用于开发基于基因功能的微卫星标记[6]。迄今为止,转录因子分子标记只在鹰嘴豆(Cicerarietinum)和蒺藜苜蓿(Medicagotruncatula)中被研究报道,并且这些标记已被证明在标记辅助遗传改良和品种鉴定中具有很大的潜力[6,15]。
新《种子法》的实施明确规定,申请审定的农作物品种应具备特异性(distinctness)、一致性(uniformity)、稳定性(stability)简称DUS,DUS测试结果已成为农作物品种审定登记的必要条件。在农业农村部农业技术试验示范(国家草品种区域试验)项目的资助下,本团队开展了箭筈豌豆品种的评价和测试分析试验。为了从分子水平研究箭筈豌豆品种间基因型的差异,本研究采用基于箭筈豌豆转录组数据挖掘的转录因子SSR引物,利用30份箭筈豌豆品种构建品种指纹图谱,并在此基础上对品种间的遗传相似性进行分析,从分子水平上为箭筈豌豆品种的鉴定和保护提供更加准确、公正和客观的判定依据。同时印证基于箭筈豌豆转录组数据鉴定其转录因子,进而开发SSR标记的可行性,以期为箭筈豌豆遗传多样性分析、品种鉴定和指纹图谱构建提供有价值的候选标记。
1 材料与方法
1.1 试验材料
本研究所用的30个箭筈豌豆品种由国内和国外两部分构成。其中,20份国外品种来源于美国农业部,10份国内品种来源于中国农业农村部全国畜牧总站和国家草种质资源库(表 1),上述箭筈豌豆品种均种植于兰州大学榆中校区试验站,实验材料在2017年5月采集于榆中校区试验田。
1.2 基因组DNA的提取
每个箭筈豌豆品种采集10个单株的新鲜叶片分别提取基因组DNA[6,16]。提取后的DNA经1% 琼脂糖凝胶电泳检测质量,并用Nanodrop分光光度计测定DNA浓度和质量(OD260/OD280≈1.8)。将检测合格的DNA样品稀释至50 μg·L-1,最后把同一品种的10份DNA稀释液等体积混合,于-20 ℃保存备用。
1.3 转录因子和SSR位点鉴定及引物设计
用于鉴定箭筈豌豆转录因子和开发SSR分子标记的44582条箭筈豌豆 Unigene序列下载于NCBI Gene Expression Omnibus数据库,登录号为:No.GSE35437。豆科植物转录因子蛋白序列下载于豆科转录因子数据库(legume transcription factor database, Legume TFDB)。利用本地BLAST程序(E-value=10-10)与箭筈豌豆Unigene进行比对,鉴定箭筈豌豆中潜在的转录因子基因。分别通过MicroSAtellite(MISA, http://pgrc.ipkgatersleben.de/misa/)工具和Primer 3软件进行SSR位点识别和引物设计[17]。

表1 箭筈豌豆品种鉴定试验材料Table 1 V. sativa cultivars in the experiment
注:品种类型均为育成品种。
Note: Variety types are cultivar.
1.4 功能注释
将所获得的箭筈豌豆转录因子中含SSR位点并且能够成功设计引物的Unigene序列,通过Blast2GO[18]和WEGO软件进行功能注释[19]。
1.5 PCR扩增与检测
引物由上海生工生物工程技术服务有限公司合成。SSR-PCR扩增体系为10 μL,在Eppendorf Mastercycler nexus PCR仪(德国)上进行:2×Taq PCR MasterMix 5 μL,正反向引物各1 μL (10 μmol·L-1),模板DNA 1 μL (50 ng·μL-1),ddH2O 2 μL。PCR反应条件为:94 ℃变性30 s后,62~54 ℃ 退火30 s,72 ℃延伸30 s,共8个循环;94 ℃变性30 s后,56 ℃退火30 s,72 ℃延伸30 s,共25个循环;72 ℃延伸7 min;于4 ℃保存。PCR扩增产物用6%变性聚丙烯酰胺凝胶电泳检测。
1.6 数据分析
通过人工比对和软件校正,对SSR 标记扩增产物进行统计。按照扩增条带的分子量从大到小编号读取,相同迁移位置有带的记为1,无带的记为0,建立“0,1”矩阵,并统计SSR标记扩增产物的总条带数(total bands, TB)、预计杂合度(expected heterozygosity, He)和多态信息量(polymorphic information content, PIC)[20]。用Quantity One软件根据marker分子量计算特异扩增条带的分子量,通过Originpro 8软件把“0,1”数据转换为标准模式图。
2 结果与分析
2.1 箭筈豌豆转录因子SSR分子标记开发
将箭筈豌豆Unigene序列与大豆(Glycinemax)、百脉根(Lotuscorniculatus)和蒺藜苜蓿的转录因子蛋白序列进行本地BLAST比对,得到34个潜在的箭筈豌豆转录因子家族,共1816个基因(表 2)。通过MISA软件对Unigene进行SSR位点检测,其中SSR位点对应重复的一、二、三、四、五和六核苷酸的最少重复次数分别为10、6、5、5、5、5;同时,两个微卫星之间的距离小于100 bp时,组成一个复合微卫星。在282个Unigene中共检测到306个SSR位点,采用Primer 3软件进行引物设计,最终208对SSR引物在188个Unigene序列中成功设计。对检测到的SSR位点的类型和分布进行统计分析(表 2),SSR位点具有三碱基重复类型的数量最多,共121个,占SSR位点重复类型的58.17%;其次分别为单碱基重复类型(45,21.63%)、二碱基重复类型(24,11.54%),无四、五和六碱基重复类型。

表2 箭筈豌豆SSR标记开发汇总Table 2 Summary of SSR search results for V. sativa
2.2 含有SSR位点的转录因子功能分类
使用Blast2GO和WEGO软件对188个箭筈豌豆Unigene序列进行了功能注释(图1)。在本研究中,共有156(82.98%)条Unigenes得到了GO注释,包括细胞组分(cellular component,110个),分子功能(molecular function,147个)和生物学过程(biological process,117个),所有的匹配序列被进一步富集为28个功能类别,细胞组分分类中,细胞和细胞成分功能类别中(cell and cell part)均注释到109个转录因子序列,其次为细胞器(organelle,102个)。基于分子功能的分类将转录因子基因分为5组:蛋白结合(binding,133个),转录调节活性(transcription regulator activity,54个),催化活性(catalytic activity,13个),转运活性(transporter activity,2个)和结构分子活性(structural molecule activity,1个)。在生物过程分类中,两个代表性最高的GO术语是细胞过程(cellular process,109个)和代谢过程(metabolic process,108个),其次是生物调节和生物过程调节(biological regulation and regulation of biological process,均为101个)。
2.3 SSR产物多态性分析
用208对成功设计的SSR引物对30份箭筈豌豆品种进行遗传多样性分析(表3),共鉴定得到35对可扩增出多态性高、稳定性好和谱带清晰的引物(图2)。每对引物的扩增带数从3(VsTFSSR-10、-14、-16和-26)到18(VsTFSSR-24)不等,平均值为8.23。35对引物的多态性位点百分比均达到了100%;多态信息含量(PIC)范围为 0.42(VsTFSSR-26)~1.00(VsTFSSR-01、-05和-08),平均值为0.80;预计杂合度(He)范围为0.53(VsTFSSR-26)~1.00(VsTFSSR-01、-05和-08)。
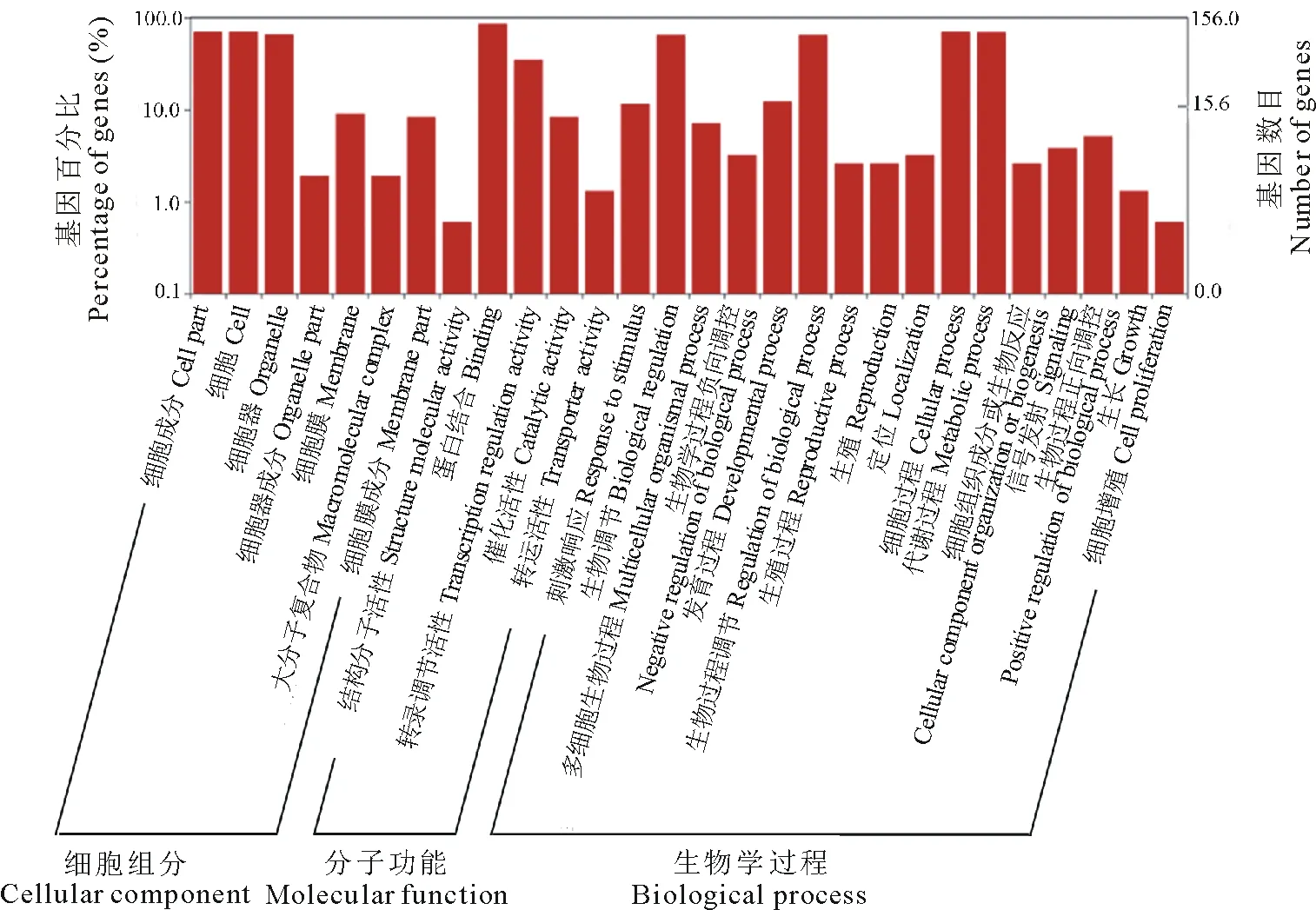
图1 含有SSR位点的转录因子GO分类Fig.1 GO classifications of TFs genes containing SSR
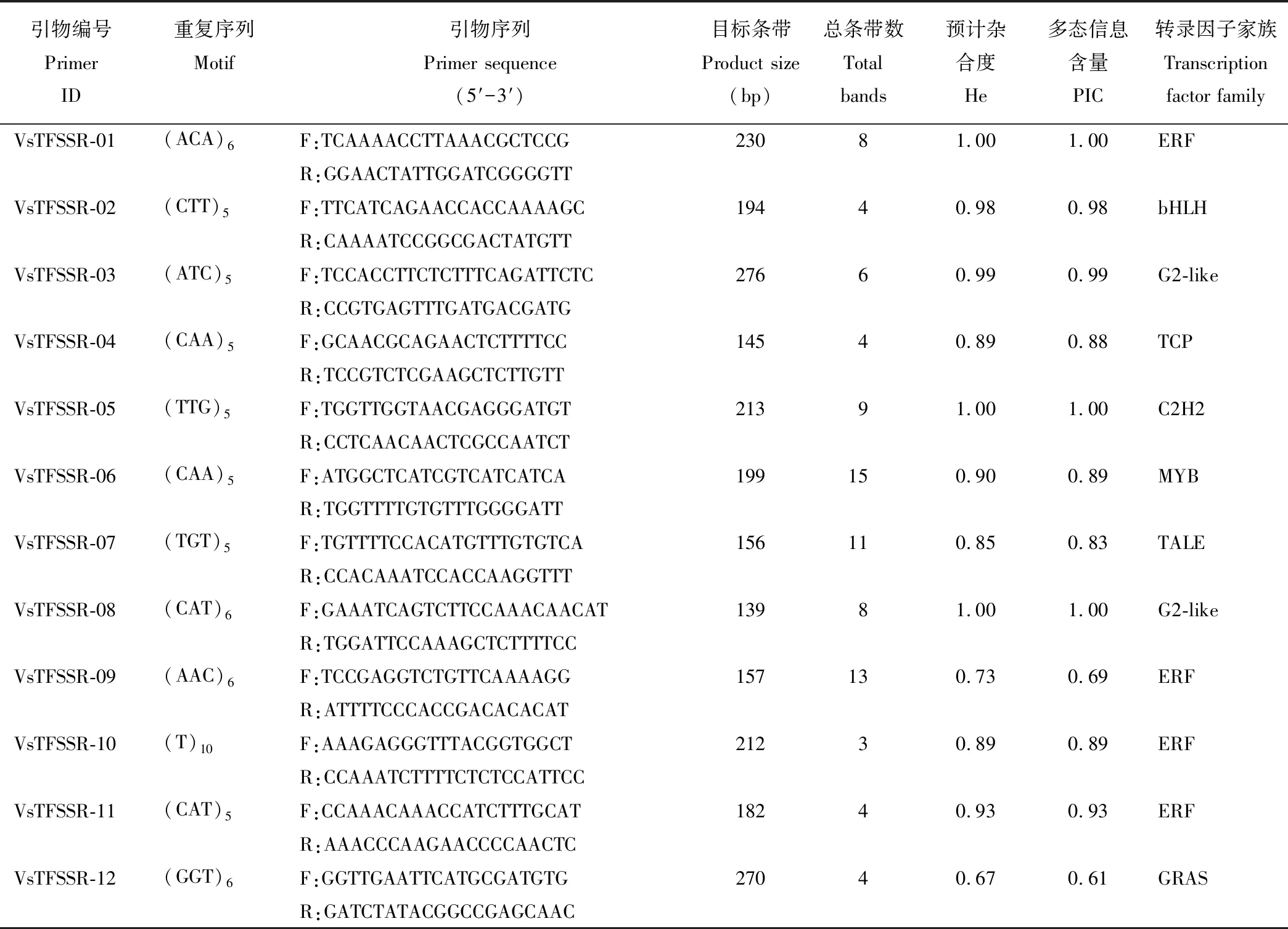
引物编号 Primer ID重复序列 Motif引物序列 Primer sequence (5′-3′)目标条带Product size (bp)总条带数Totalbands预计杂合度He多态信息含量 PIC转录因子家族 Transcription factor familyVsTFSSR-01(ACA)6F:TCAAAACCTTAAACGCTCCGR:GGAACTATTGGATCGGGGTT23081.001.00ERFVsTFSSR-02(CTT)5F:TTCATCAGAACCACCAAAAGCR:CAAAATCCGGCGACTATGTT19440.980.98bHLHVsTFSSR-03(ATC)5F:TCCACCTTCTCTTTCAGATTCTCR:CCGTGAGTTTGATGACGATG27660.990.99G2-likeVsTFSSR-04(CAA)5F:GCAACGCAGAACTCTTTTCCR:TCCGTCTCGAAGCTCTTGTT14540.890.88TCPVsTFSSR-05(TTG)5F:TGGTTGGTAACGAGGGATGTR:CCTCAACAACTCGCCAATCT21391.001.00C2H2VsTFSSR-06(CAA)5F:ATGGCTCATCGTCATCATCAR:TGGTTTTGTGTTTGGGGATT199150.900.89MYBVsTFSSR-07(TGT)5F:TGTTTTCCACATGTTTGTGTCAR:CCACAAATCCACCAAGGTTT156110.850.83TALEVsTFSSR-08(CAT)6F:GAAATCAGTCTTCCAAACAACATR:TGGATTCCAAAGCTCTTTTCC13981.001.00G2-likeVsTFSSR-09(AAC)6F:TCCGAGGTCTGTTCAAAAGGR:ATTTTCCCACCGACACACAT157130.730.69ERFVsTFSSR-10(T)10F:AAAGAGGGTTTACGGTGGCTR:CCAAATCTTTTCTCTCCATTCC21230.890.89ERFVsTFSSR-11(CAT)5F:CCAAACAAACCATCTTTGCATR:AAACCCAAGAACCCCAACTC18240.930.93ERFVsTFSSR-12(GGT)6F:GGTTGAATTCATGCGATGTGR:GATCTATACGGCCGAGCAAC27040.670.61GRAS
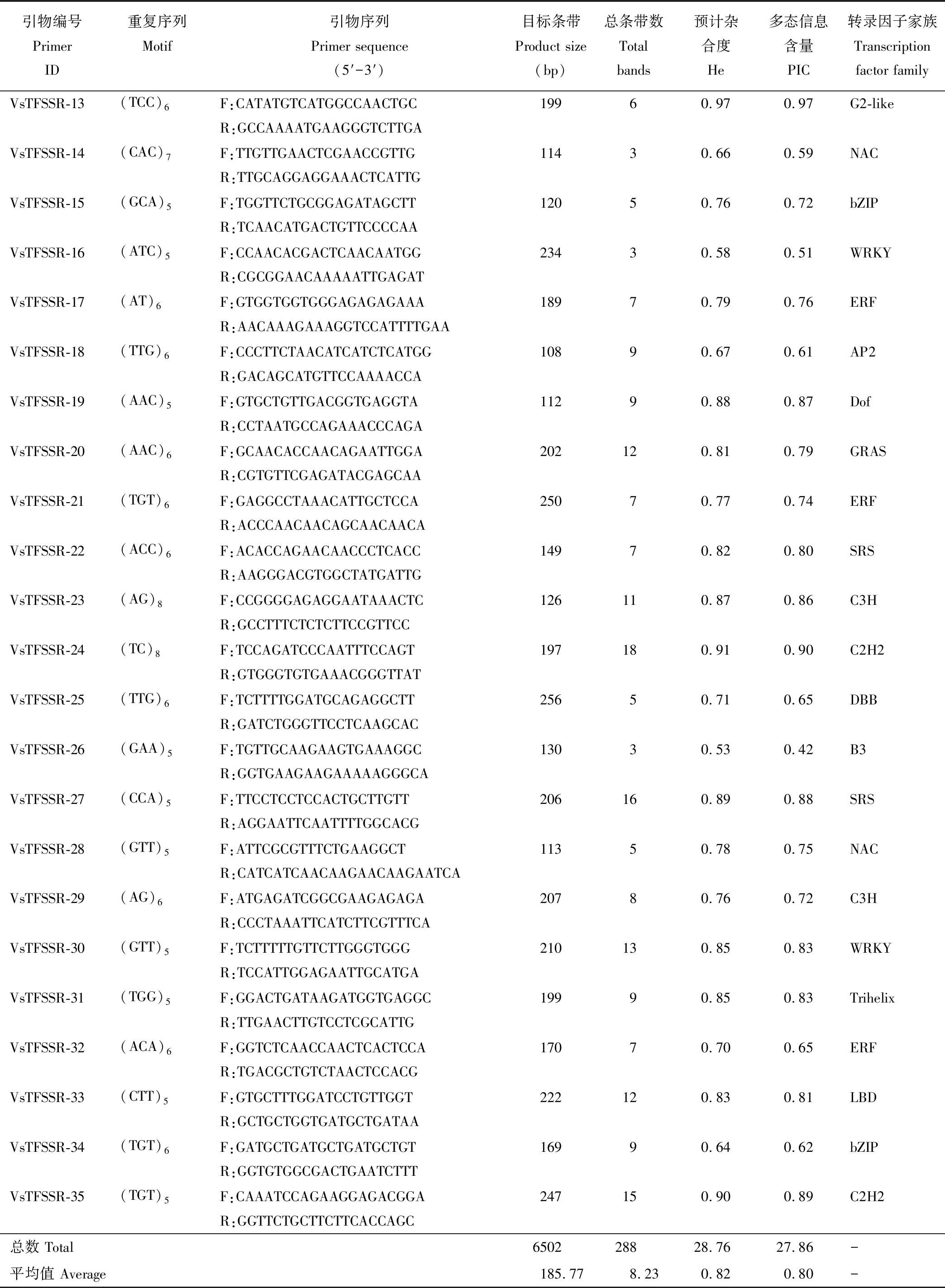
续表3 Continued Table 3
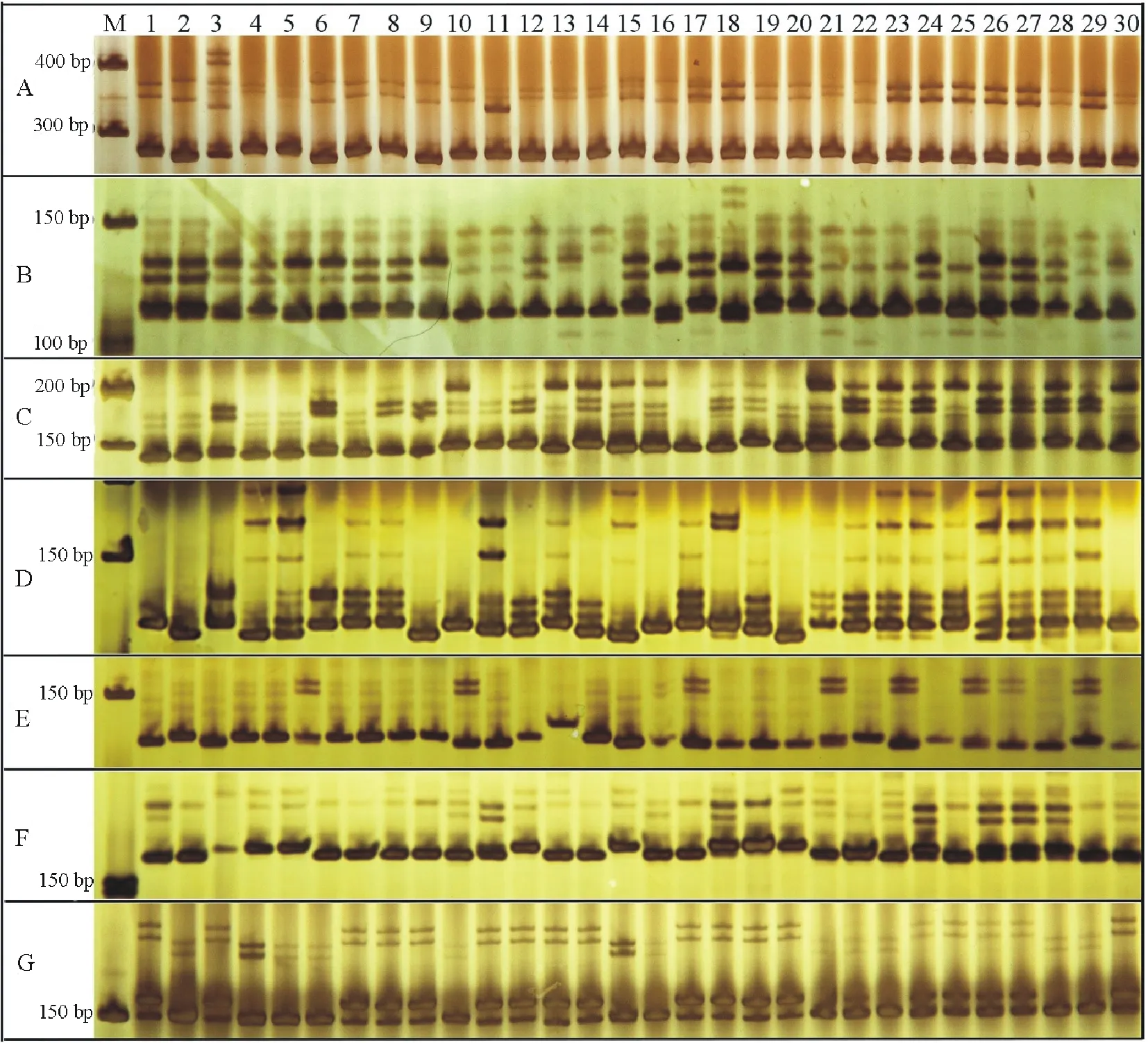
图2 部分VsTFSSR引物的扩增图谱Fig.2 Amplification results by part of VsTFSSR primers A: VsTFSSR-12; B: VsTFSSR-19; C: VsTFSSR-22; D: VsTFSSR-23; E: VsTFSSR-26; F: VsTFSSR-28; G: VsTFSSR-31.
2.4 箭筈豌豆品种聚类分析
利用NTSYS-pc 2.10软件的UPGMA法对30个箭筈豌豆品种进行聚类分析(图3),不同品种间的遗传相似系数(Nei-Li/Dice系数)范围为0.69~0.95,表明不同品种之间存在着丰富的遗传多样性。首先,30份箭筈豌豆品种被聚为两大类:国内品种和国外品种,其中,兰箭1号箭筈豌豆在聚类分析中与国外品种聚为一类,表明兰箭1号箭筈豌豆相较于其他国内品种具有更为丰富的遗传背景。根据聚类结构进一步将30个箭筈豌豆分为6个类群,其中A类群有5个品种,均来自前苏联;B类群共有5个品种,3个品种来自法国,1个来自美国,1个来自中国;C类群共有4个品种,3个来自匈牙利,1个来自日本;D类群共4个品种,3个来自美国,1个来自匈牙利;E类群共9个品种,均来自中国;F类群共3个品种,2个来自美国,1个来自匈牙利。 聚类分析结果表明,所选用的35对SSR引物具有很好的区分效果,可初步将不同地理起源的品种进行区分。
2.5 VsTFSSR引物鉴定箭筈豌豆品种效率分析
利用35对引物在30个箭筈豌豆品种的电泳带型进行相关性分析,相关性分析结果如图4所示。引物VsTFSSR-10与VsTFSSR-26、VsTFSSR-14与VsTFSSR-26之间相关性最强,相关系数为0.89,表明这两对引物间扩增带型差异最小;而VsTFSSR-9与VsTFSSR-24之间相关性最低,相关系数为-0.27,表明扩增带型差异最大。不同引物间的相关性分析可进一步辅助在品种鉴定时进行引物间的优化组合,通过选取相关性较低的引物组合可以提高引物组合的鉴别效率。例如VsTFSSR-6能够区分7个品种,VsTFSSR-18能够区分5个品种,两对引物间的相关性系数为0.28,两对引物组合可以区分11个箭筈豌豆品种。
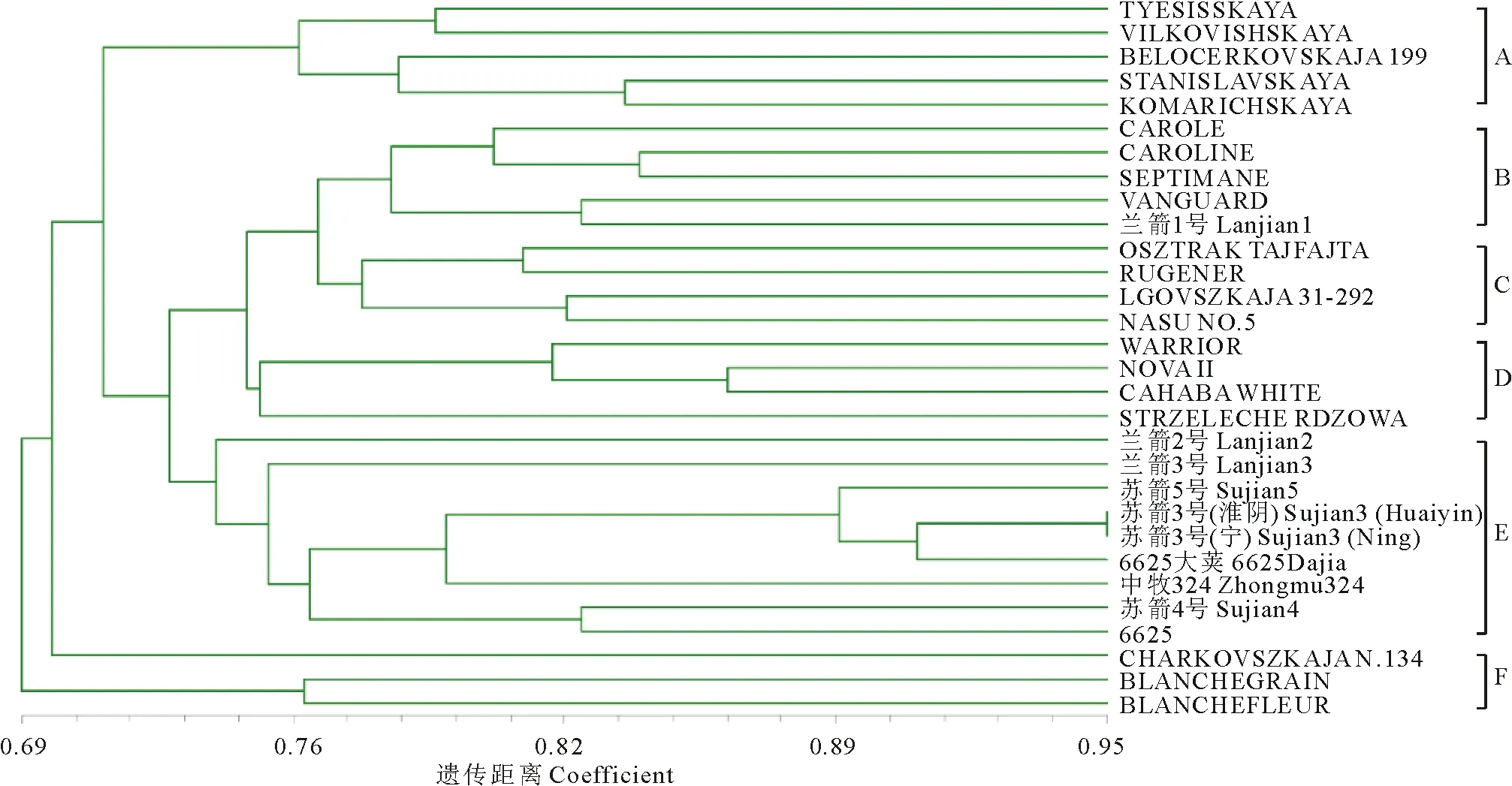
图3 30份箭筈豌豆品种VsTFSSR引物聚类分析Fig.3 Dendrogram of 30 V. sativa cultivars based on VsTFSSR primers
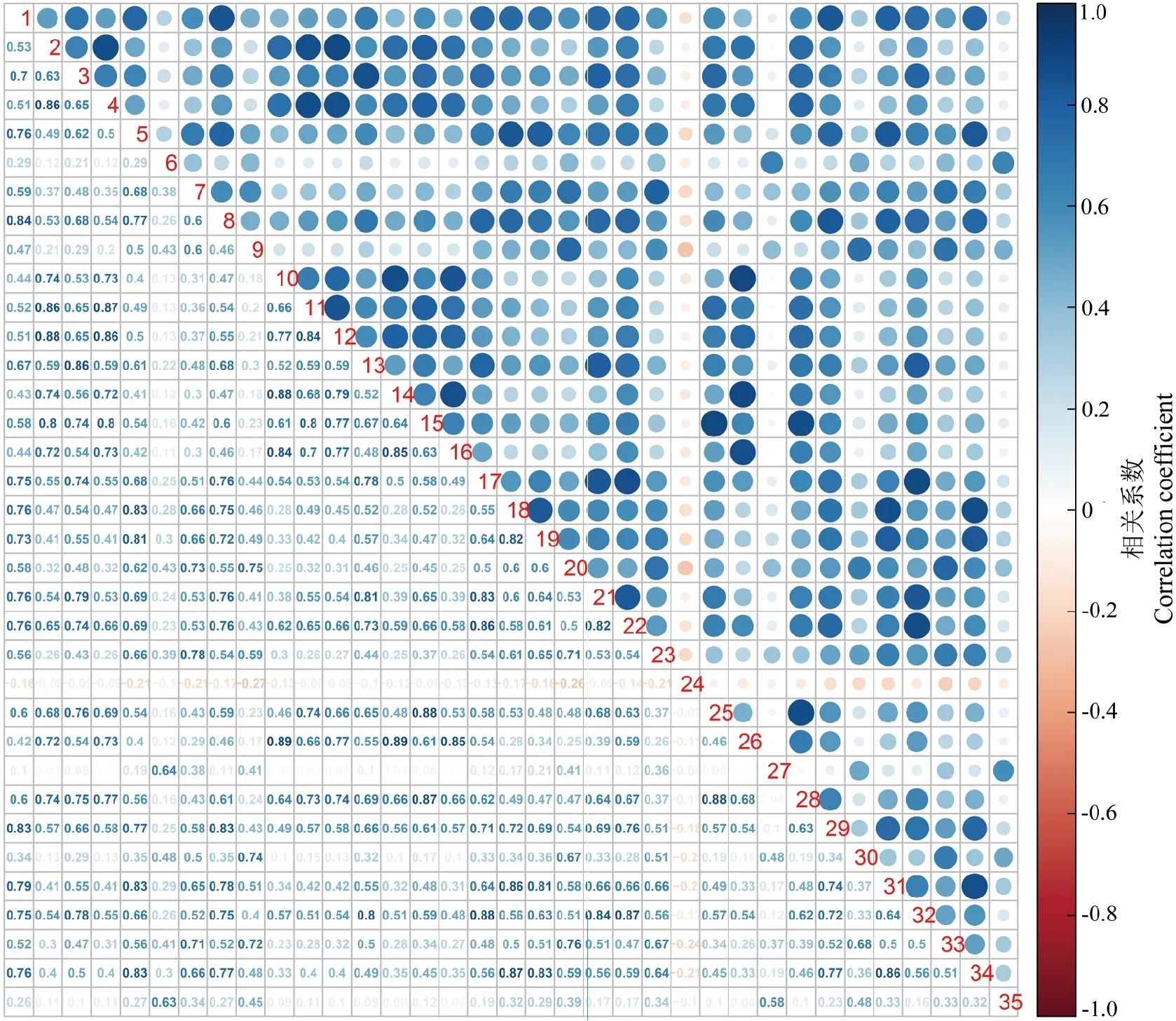
图4 35对VsTFSSR引物扩增结果相关性分析Fig.4 The correlation analyzes based on the 35 VsTFSSR primers amplification product 1~35表示引物VsTFSSR-01~VsTFSSR-35。1-35 indicated the primer ID from VsTFSSR-01 to VsTFSSR-35.
2.6 核心引物确定
在筛选出的35对VsTFSSR多态性引物中,每个箭筈豌豆品种至少在1对VsTFSSR引物中具有特异性条带,即该品种可以用1对或1对以上的引物与其他所有箭筈豌豆品种进行区分(图5)。例如引物VsTFSSR-24能扩增出18个多态性条带,一次性可以区分19个品种;VsTFSSR-30扩增出13个多态性条带,一次性可以区分15个品种;VsTFSSR-35扩增出15个多态性条带,一次性可以区分12个品种。通过对引物扩增的特异性条带数和不同引物间的相关性进行分析,确定利用6对引物(VsTFSSR-21、VsTFSSR-23、VsTFSSR-24、VsTFSSR-30、VsTFSSR-34和VsTFSSR-35)就可将所有的30个箭筈豌豆品种区分开,这6对引物可作为箭筈豌豆品种指纹图谱构建的核心引物。以筛选出的6对核心引物扩增电泳图谱为基础,由 1和 0 组成的字串构成数字指纹,再经Originpro 8软件转换,建立了基于6对引物扩增的兰箭1号、兰箭2号和兰箭3号品种标准模式图(图6)。根据每个品种的特异性带型,可以比较容易地鉴定区分,如VsTFSSR-24、VsTFSSR-30和VsTFSSR-35中的一对引物就可以将上述3个品种完全区分开。
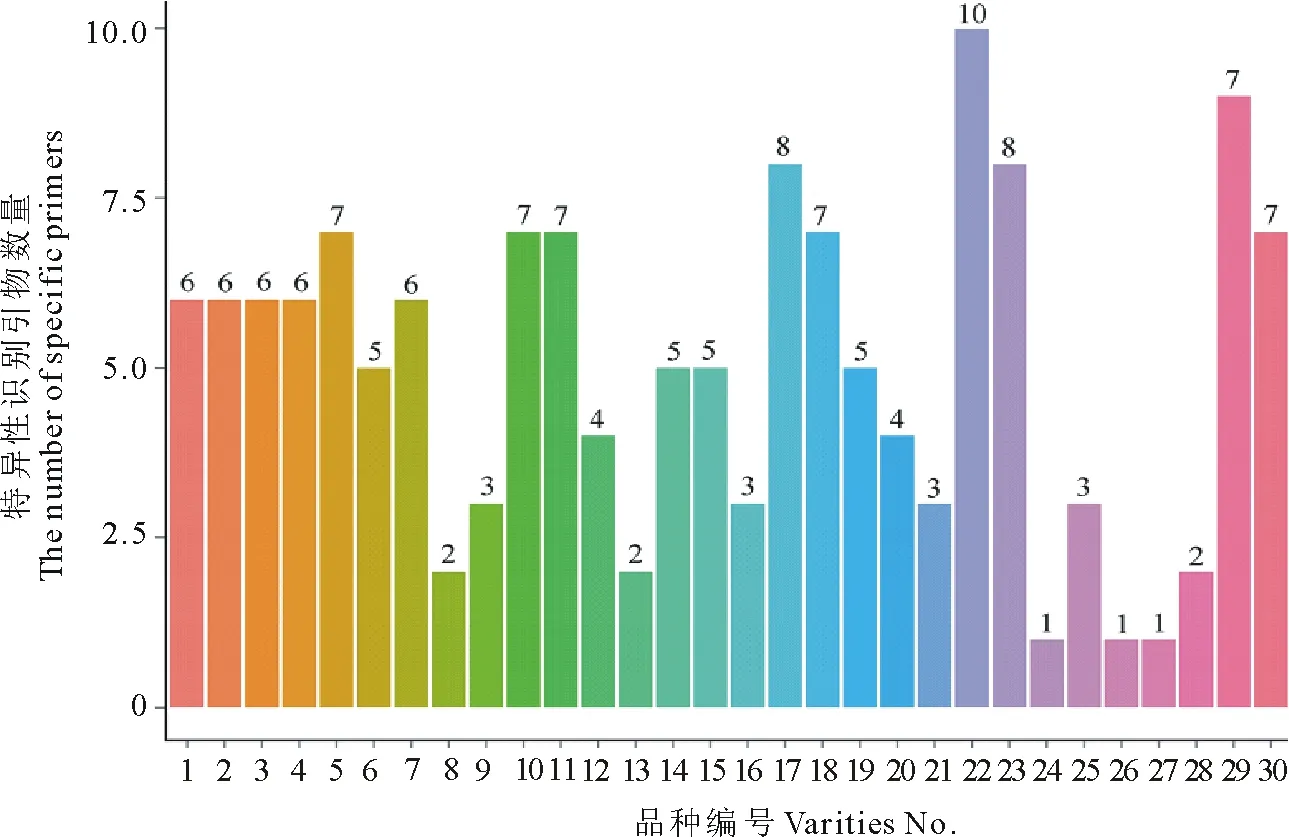
图5 30个箭筈豌豆品种特异性识别引物数量Fig.5 The number of the VsTFSSR primers specifically identified in 30 V. sativa cultivars
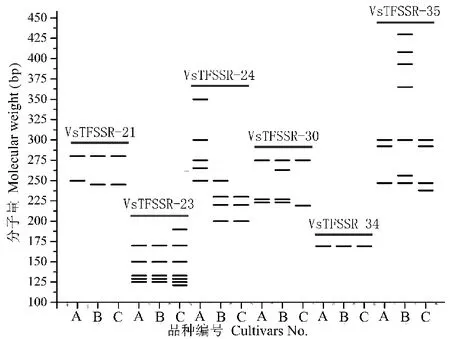
图6 基于6对核心引物扩增的3个箭筈豌豆品种指纹图谱标准模式图Fig.6 Mode image of fingerprintings for three V. sativa cultivars by six core primer pairsA: 兰箭1号 Lanjian1; B: 兰箭2号 Lanjian2; C: 兰箭3号 Lanjian3.
2.7 箭筈豌豆品种指纹图谱构建
统计6对核心引物在30个箭筈豌豆中扩增的1,0数据,将6对引物扩增结果组合在一起即为箭筈豌豆的DNA指纹图谱。如用6对SSR引物扩增TYESISSKAYA品种,在6对引物中得到的图谱分别为0000100、00000000100、000000000000000010、0100010000010、000001000和000000011001000,将其组合到一起为0000100-00000000100-000000000000000010-0100010000010-000001000-000000011001000(表 4),得到由“0”和“1” 组成的73个数字图谱。利用组合的数字图谱构成了30个箭筈豌豆品种的组合指纹图谱数据库,当30条字符串形成能够唯一标识的字符串时,即表明这6对VsTFSSR引物能将30份箭筈豌豆品种全部区分开,每一条字符串可以作为每一份箭筈豌豆的分子身份证号码。
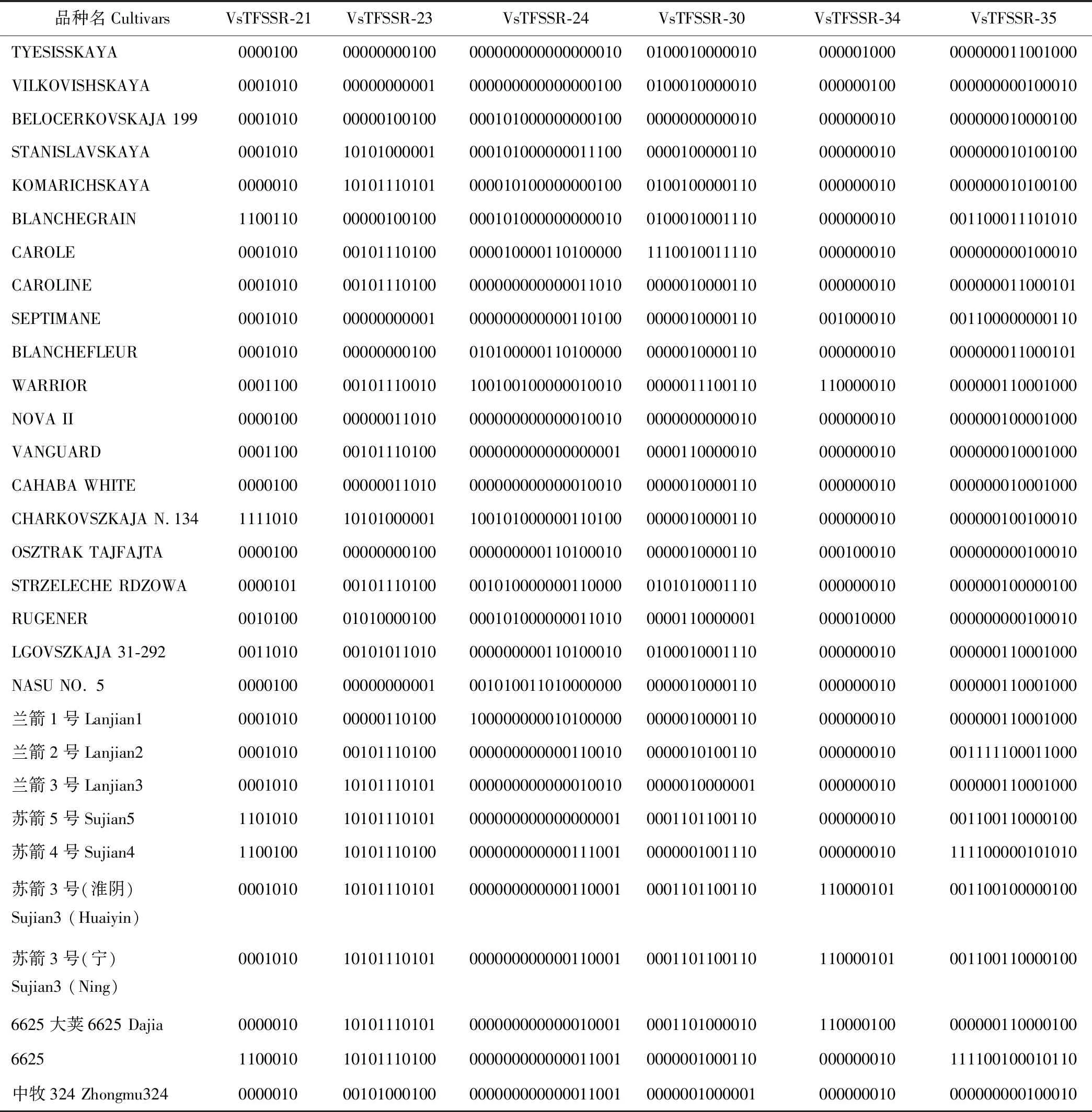
表4 30个箭筈豌豆品种的DNA指纹图谱Table 4 DNA fingerprint of the 30 V. sativa cultivars
3 讨论
相比其他类型的分子标记,SSR分子标记以其独特优越性,从2005年起就被国际植物新品种保护联盟(UPOV)推荐作为建库优选的标记,因此在品种鉴定上具有较高的权威性[21-22]。随着后基因组时代的到来,转录组测序技术已被广泛用于研究模式和非模式植物的生长发育以及对逆境胁迫响应的机制研究[23-24]。通过转录组测序数据开发的 SSR 标记具有 EST-SSR 标记的优点,同时还可以提高植物遗传多样性分析的准确性。相对于其他豆科牧草,如苜蓿(Medicagosativa)、三叶草(Trifolium)、百脉根和草木樨(Melilotussuaveolens)等,目前对箭筈豌豆遗传结构及群体多样性的研究相对较少,分子标记数量十分有限,远不能满足箭筈豌豆遗传多样性研究与分子育种工作的需要。同时,传统的形态学鉴定方法具有耗时长、需要专门的技术人员、易受环境条件限制、需要大量的土地面积等缺点。目前以PCR 技术为基础的分子标记技术已被成功地运用于水稻(Oryzasativa)、茶树(Camelliasinensis)、苜蓿和棉花(Gossypiumspp.)等植物的品种鉴定中[25-28]。
本研究首先通过生物信息学鉴定了箭筈豌豆 Unigene序列中潜在的转录因子,进而检测了转录因子序列中的SSR位点,利用Primer 3软件进行引物设计,成功获得208对转录因子SSR引物,最终从208对SSR引物中筛选获得35对条带清楚、扩增效果稳定的多态性引物。研究表明当PIC值大于0.5可作为信息标记,当PIC值大于0.7可用于构建遗传图谱[29]。在本研究中,35对SSR引物的PIC平均值为0.80,除VsTFSSR-26(PIC=0.42)引物的PIC值小于0.5,其余引物的PIC值均大于0.5;其中27个(77.14%)引物的PIC值大于0.7,表明基于转录因子开发的多态性分子标记在箭筈豌豆遗传多样性和遗传图谱分析中具有较大的潜力。Kim等[30]对两个箭筈豌豆亚种(V.sativassp.sativa和V.sativassp.nigra)进行转录组测序分析,在两个亚种中分别选取100对引物,并分别在9个V.sativassp.sativa和 9个V.sativassp.nigra亚种中对开发的标记进行评价,PIC值为0.38~0.75,在两个箭筈豌豆亚种中的平均PIC值分别为0.54 (sativa)和0.51 (nigra);Chung等[31]利用高通量测序在箭筈豌豆中获得17971条序列,从中鉴定得到2429个SSR位点,共设计并合成了100对cDNA-SSR引物。在32份箭筈豌豆材料中筛选出49对多态性引物,PIC的范围为0.20~0.86,平均值为0.59;Liu 等[32]用96对EST-SSR引物在10个箭筈豌豆材料中进行扩增,PIC的范围为-0.09~0.98,平均值为0.70;Liu等[6]在44个苜蓿品种中评估了27个多态性TFGM(transcription factor gene-derived microsatellite)分子标记,PIC值为0.08~0.84,平均值为0.60。而本研究筛选出的35对VsTFSSR引物在30个箭筈豌豆品种中的PIC平均值为0.80,均高于以上研究结果,表明VsTFSSR标记在箭筈豌豆遗传多样性分析中优于其他类型的SSR标记。
对引物扩增的特异性条带数和不同引物间的相关性进行分析,确定了6对核心引物用于构建30个箭筈豌豆品种的DNA指纹图谱。把6对SSR引物的扩增结果组合在一起就可以将30个箭筈豌豆品种完全区分开,即每个箭筈豌豆品种都有能够唯一标识的一份品种字符串。目前UPOV已为箭筈豌豆制定了DUS测试指南,国内箭筈豌豆的DUS测试指南正在研制中,因此箭筈豌豆SSR引物的开发和指纹图谱的构建可以为SSR标记技术在箭筈豌豆DUS测试中应用奠定基础,在箭筈豌豆品种鉴定和知识产权保护等方面发挥积极作用,同时在育种策略调整和选配优良杂交组合培育新品种等方面具有现实意义。
4 结论
本研究利用箭筈豌豆 Unigene序列鉴定潜在的转录因子基因,设计开发SSR引物;并从中筛选获得35对多态性引物,证明基于箭筈豌豆转录组数据鉴定其转录因子,进而开发SSR标记的可行性。最终用6对核心引物构建了30个箭筈豌豆品种的DNA指纹图谱。本研究可以从分子水平快速准确鉴别和了解箭筈豌豆品种的遗传差异,进而为合理利用箭筈豌豆种质资源提供理论依据。
