西藏地区荞麦与玉米混合青贮对发酵品质和微生物多样性的影响
2019-04-23商振达谭占坤李家奎卓嘎王宏辉巴桑谢国平刘锁珠
商振达,谭占坤,李家奎,卓嘎,王宏辉,巴桑,谢国平,刘锁珠*
(1.西藏农牧学院动物科学学院,西藏 林芝860000;2.西藏高原饲料加工工程研究中心,西藏 林芝 860000;3.华中农业大学动物医学院,湖北 武汉 430070)
西藏地处我国青藏高原西南部,具有特殊的气候条件和地理位置(高寒、高海拔),畜牧业是其农业经济的主导产业,具有不可替代的社会、经济作用[1]。但由于西藏地区草地生产能力极低,牧草生长期短,优质饲料资源严重缺乏,难以为牦牛、藏羊等家畜提供充足的饲草料资源,当前饲料的短缺已成为制约西藏畜牧业发展的瓶颈问题[2]。因此,开发扩大牧草资源,增加青绿饲料来源,对解决西藏地区家畜饲粮短缺问题具有重要意义。
青贮作为一种饲料长期保存的贮存技术,具有减少饲草养分损失、增加饲草的利用价值、调整牧草供应时期、提高饲草消化率和动物适口性等优点。可以进行青贮的饲草很多,但为确保青贮的成功,也需要饲草含有适量的水分和糖分等营养物质。青贮饲料是一个非常复杂的生化物质转化和微生物活动的过程,饲草中的营养成分和微生物菌群结构都可以对其青贮后的饲料发酵品质产生很大的影响[3-6]。近年来,随着高通量测序技术的不断发展,该项技术在微生物研究领域已被广泛使用[7-10]。
荞麦(Fagopyrumesculentum)和玉米(Zeamays)作为西藏地区较为古老的栽培作物,现阶段在西藏广泛种植,其中西藏荞麦的年栽培面积可以达到6667 hm2,西藏青饲玉米的产量可达667 kg·hm-2左右[11-12]。荞麦作为一种饲料,富含蛋白质、脂肪、铁、钙、磷等多种营养成分,其营养价值为玉米的70%。有研究表明,用荞麦饲喂家禽可加快和提高家禽的生长速度和产蛋率;喂猪可提高猪肉品质,饲喂奶牛可提高牛奶的质量[13]。与其他饲料作物相比,荞麦还有生育期短,抗寒能力强等优点,可以在短时间内提供大量优质饲料。但荞麦含水量和含糖量相对较低,难以为单独青贮提供优质的青贮条件。玉米作为一种优质的饲料作物,具有生长速度快、再生能力强、适口性好、营养价值高等优点[14],且玉米的含水量较为合适,含糖量相对较高,可以为青贮提供优质的条件。近年来关于利用玉米与饲草混合青贮改善饲料品质的研究越来越多,如青饲玉米和青稞秸秆(barley straw)混合青贮研究、全株玉米与饲用苎麻(Boehmerianivea)混合青贮研究、全株玉米与高粱(Sorghumbicolor)混合青贮研究等[15-17],且结果均显示混合青贮可以改善饲料的品质。因此,为充分利用西藏地区全株荞麦,扩大西藏地区饲料资源,解决西藏饲料短缺问题,本研究利用常规营养分析方法和高通量测序技术,分析全株荞麦和全株玉米以不同比例进行混合青贮后的发酵品质和微生物菌群结构,探究全株荞麦与全株玉米混合青贮的最佳比例,为西藏地区荞麦饲用提供理论依据,为解决西藏地区非粮饲料开发提供技术支撑。
1 材料与方法
1.1 试验材料
荞麦和玉米种植于西藏林芝西藏农牧学院试验地,该地区平均海拔3100 m,属于热带、亚热带、温带、寒带,湿润和半湿润并存的多种气候带,年降水量650 mm左右,年均温度8.7 ℃,年均日照2000 h,无霜期180 d。青贮材料于2017年3月进行种植,于2017年10月进行刈割,种植期间适时除草、追肥和灌水。两种青贮材料的营养成分见表1。
1.2 试验设计
试验采用完全随机设计,设置5个处理,分别为全株荞麦青贮A组(A1、A2、A3和A4分别为青贮7、14、30和60 d)、全株荞麦∶全株玉米=4∶1混合青贮B组(B1、B2、B3和B4分别为青贮7、14、30和60 d)、 全株荞麦∶全株玉米=3∶2混合青贮C组(C1、C2、C3和C4分别为青贮7、14、30和60 d)、全株荞麦∶全株玉米=2∶3混合青贮D组(D1、D2、D3和D4分别为青贮7、14、30和60 d)、全株荞麦∶全株玉米=1∶4混合青贮E组(E1、E2、E3和E4分别为青贮7、14、30和60 d),每组3袋作为3个重复,共60袋。每组青贮结束后打开青贮发酵罐取样进行分析。
1.3 测定方法
1.3.1青贮饲料制作 将全株荞麦和全株玉米均切成1~3 cm后称取55 g,充分混合均匀后,快速装填并压实于110 mL的小型实验用青贮窖中密封后,置于室温条件下保存,分别在青贮第7、14、30和60天后全部打开,取出全部青贮饲料将其混匀,称35 g放入200 mL的广口三角瓶,加入105 mL的去离子水(青贮饲料∶水=1∶3),在4 ℃的冰箱内浸提24 h。然后对青贮饲料进行榨汁和过滤,将上清液用过滤漏斗通过2层纱布和滤纸过滤,保存滤液待测。滤液用来测定pH值、乳酸、氨态氮和挥发性脂肪酸。将剩余的青贮饲料收集起来烘干,称重粉碎,测定干物质、总氮以及水溶性碳水化合物含量。
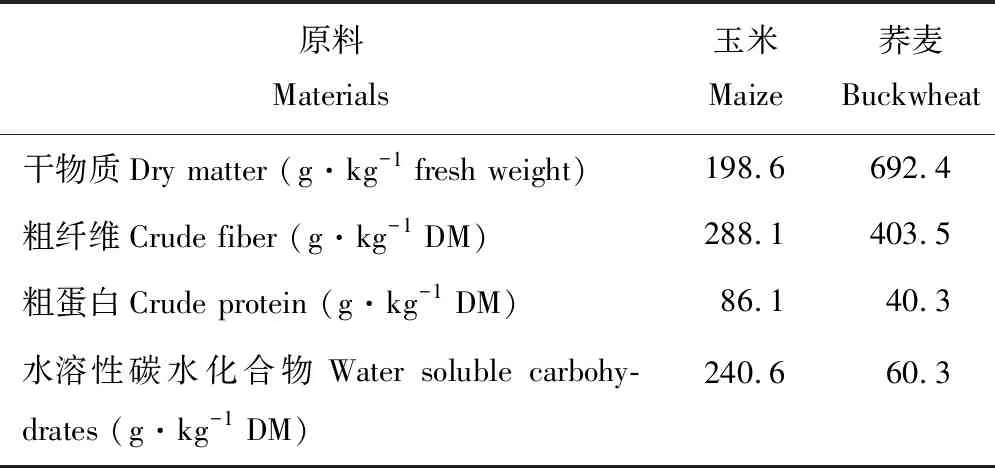
表1 青贮材料营养成分Table 1 The nutritional ingredient of silage material
1.3.2青贮饲料发酵营养成分测定 采用烘干法测定青贮饲料中干物质含量;用HANNA pH211精密pH计(意大利HANNA公司)对青贮样品处理后的过滤液直接测定pH;通过日立高效液相色谱仪测定挥发性脂肪酸含量;通过凯氏定氮法测定总氮(total nitrogen,TN)含量。采用硫酸-蒽酮比色法[18]和苯酚-次氯酸钠比色法[19]分别测定水溶性碳水化合物和氨态氮(ammonia nitrogen,AN)含量。
1.3.3青贮饲料微生物多样性的测定 将每个青贮组中的3个重复样品均匀地混合在一起。使用QIAamp Fast DNA Stool Mini Kit 试剂盒提取青贮饲料中的微生物组总DNA,利用前引物(ACTCCTACGGGAGGCAGCA)和后引物(GGACTACHVGGGTWTCTAAT)获得细菌16S rRNA 基因V3-V4高变异区。扩增产物回收纯化,采用Illumina公司的TruSeq Nano DNA LT Library Prep Kit制备测序文库。使用MiSeq测序仪进行2×300 bp的双端测序并对结果进行分析。Illumina HiSeq测序及结果分析均由上海派森诺生物科技股份有限公司协助完成。
1.4 数据处理
利用UCLUST比对工具,按97%的序列相似度,对OTU(operational taxonomic unit)[20]进行归并和划分,通过与Greengenes数据库的模板序列相对比,对OTU进行分类地位的鉴定。利用Shannon、Simpson、Chao1和ACE 4种多样性指数来分析微生物菌群的丰富度和均匀度。使用QIIME软件进行各分类水平的分类学组成分析。通过IBM SPSS Statistics软件对试验数据进行单因素方差分析。
2 结果与分析
2.1 西藏地区全株荞麦与全株玉米混合青贮发酵品质及营养成分变化
整个青贮过程中,全株荞麦单独青贮组干物质含量显著(P<0.05)高于全株荞麦和全株玉米混合青贮组(表2),且干物质含量随着全株玉米混合比例的增加而显著(P<0.05)下降。全株荞麦单独青贮组pH值显著(P<0.05)高于混合青贮组,且pH值随着全株玉米混合比例的增加而显著(P<0.05)下降。相应的乳酸含量在全株荞麦单独青贮组中显著(P<0.05)低于混合青贮组,且乳酸含量随着全株玉米混合比例的增加而显著(P<0.05)升高。这可能是因为全株荞麦中干物质含量较高,水溶性碳水化合物含量较低,而全株玉米中干物质含量较低,水溶性碳水化合物含量较高。随着青贮天数的增加,各青贮中干物质含量显著下降(P<0.05)或下降(P>0.05)。各混合青贮组中pH值随着青贮的进行有先下降后升高的趋势,而乳酸含量有先升高后下降的趋势。但各混合青贮中的pH始终高于4.2。 本研究中乙酸含量的变化趋势与乳酸含量基本相同,随着青贮天数的增加,各青贮组中丁酸含量逐渐升高,但均低于10 g·kg-1DM。
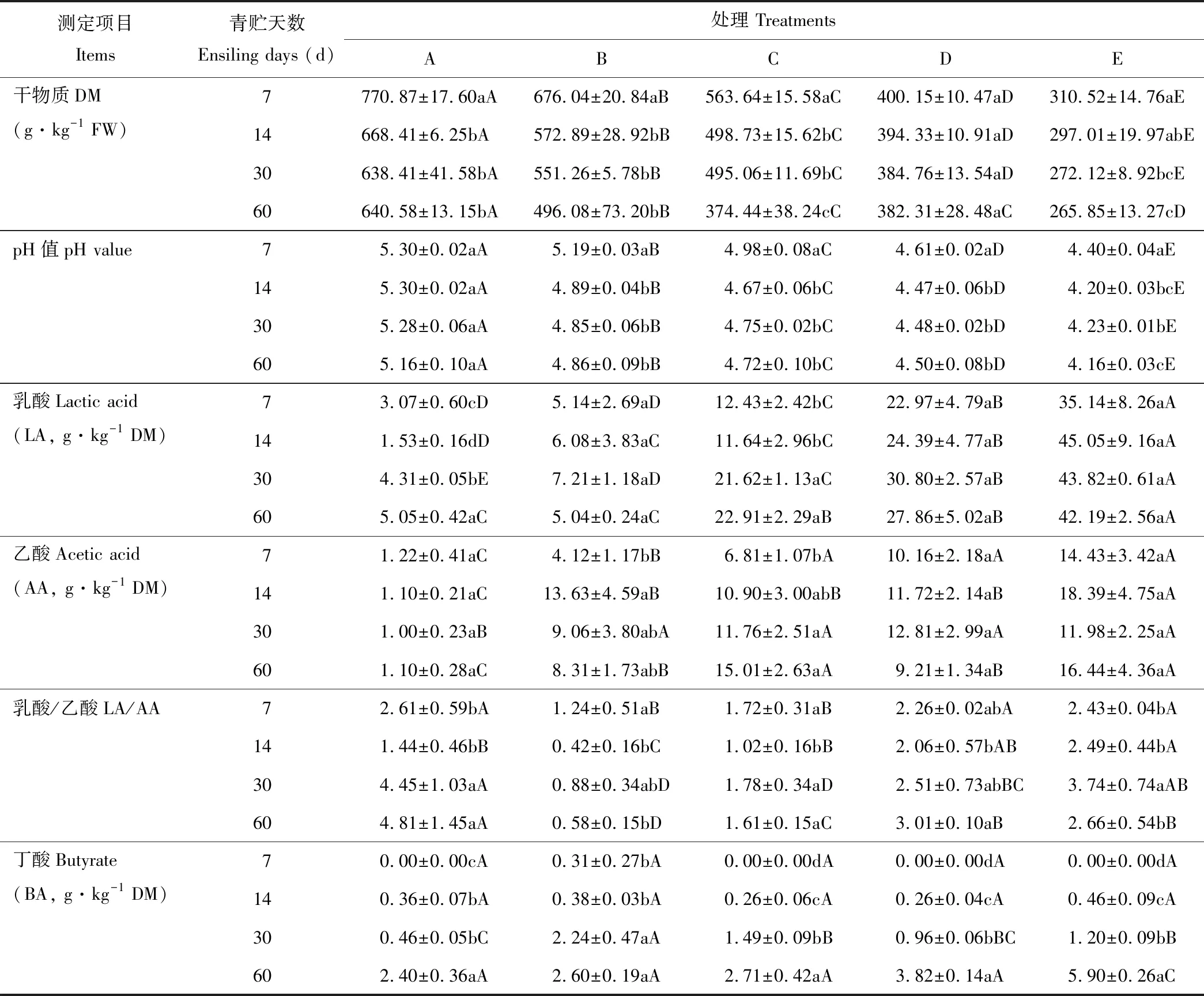
表2 西藏地区荞麦与玉米混合青贮过程中pH值、干物质和挥发性脂肪酸含量的变化Table 2 Changes in pH, DM and volatile fatty acid contents of mixed silages of buckwheat and maize during ensiling in Tibet
注:不同小写字母表示相同处理不同青贮天数间差异显著,不同大写字母表示相同青贮天数不同处理间差异显著(P<0.05),下同。
Note:Values with different lowercase letters show significant differences among different ensiling days in the same treatment, values with different capital letters show significant differences among different treatments in the same ensiling day (P<0.05), the same below.
如表3所示,各混合青贮组中氨态氮/总氮的值均显著高于(P<0.05)或高于(P>0.05)全株荞麦单独青贮组,且随着青贮天数的增加,各混合青贮组中氨态氮/总氮的值有升高的趋势,但均低于100 g·kg-1。各混合青贮组中水溶性碳水化合物的含量均显著低于(P<0.05)或低于(P>0.05)全株荞麦单独青贮组,且随着青贮天数的增加,各混合青贮组中水溶性碳水化合物的含量有下降的趋势,可能是因为混合青贮中加入全株玉米后,提高了碳水化合物的利用效果。
2.2 西藏地区全株荞麦与全株玉米混合青贮发酵微生物多样性研究
2.2.1测序结果及Alpha多样性分析 本研究利用高通量测序技术对5个处理组,共20份青贮饲料样品的菌群V3-V4区进行测序,共计获得753445条有效序列,样品平均有效序列为37672条。将丰度值低于全体样本测序总量0.001%的OTU去除,并按照97%的相似度对OTUs在门、纲、目、科、属、种6个分类水平上进行分类鉴定(图1)。
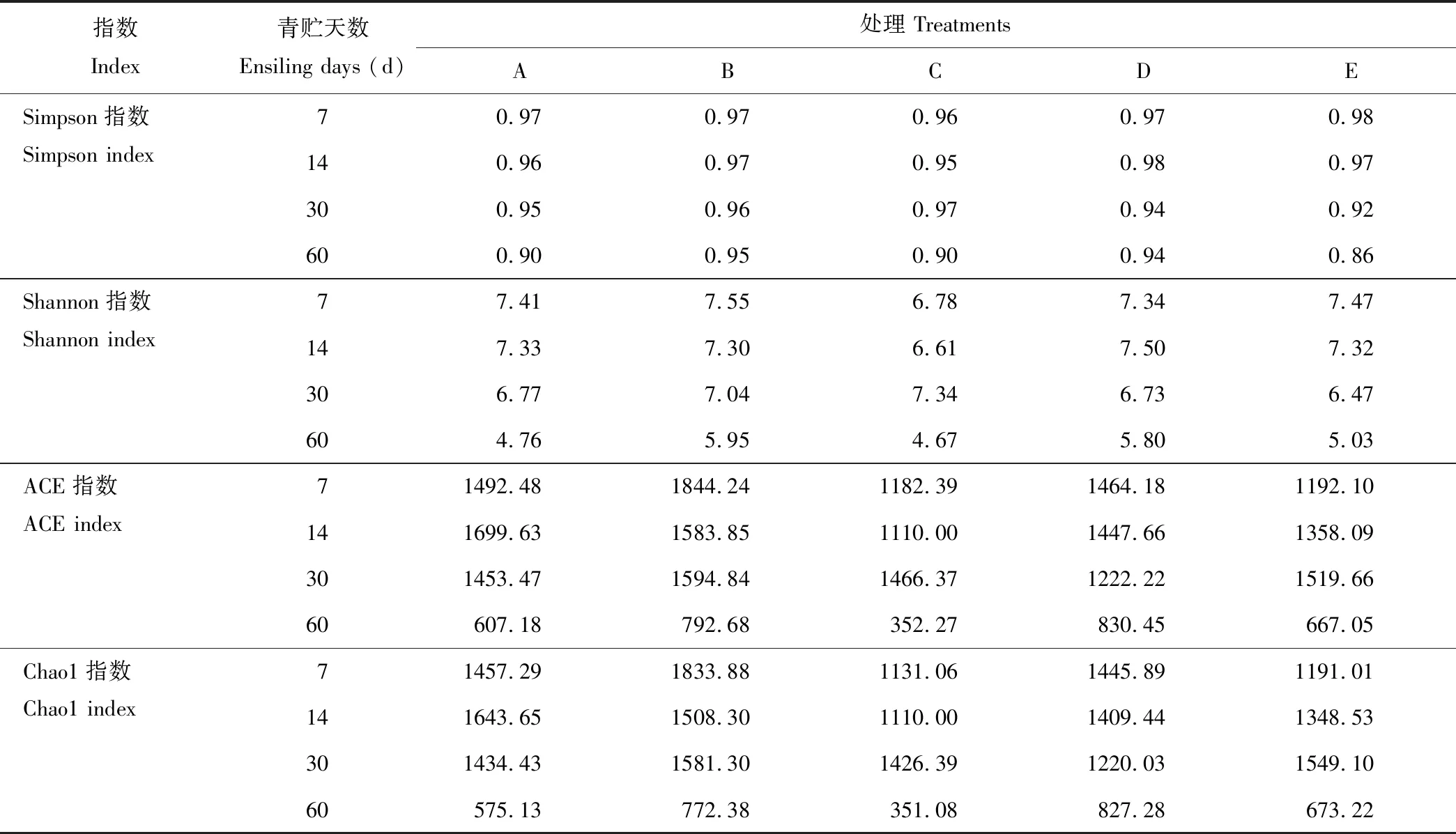
从图2可见,随着测试深度的不断加深,物种观察指数稀释曲线逐渐增加,其斜率逐渐减小,趋于平台期,说明样本测序量已经饱和,大多数菌群被覆盖,足够反映样本中绝大部分细菌物种的信息。由各青贮试验组的4种Alpha多样性指数可知(表4),随着青贮天数的逐渐增加,各青贮组中Simpson和Shannon指数[21]逐渐下降,表明随着青贮的进行,青贮饲料中微生物菌群的均匀度逐渐下降,而各青贮组中Chao1和ACE指数[22-23]随着青贮天数的逐渐增加也逐渐下降,说明随着青贮的进行,青贮饲料中微生物菌群的丰富度逐渐下降。各青贮组中,随着全株荞麦和全株玉米混合青贮的比例不同,4种Alpha多样性指数也不同,表明混合青贮中原料的比例不同,会导致青贮过程中微生物菌群的结构发生变化。
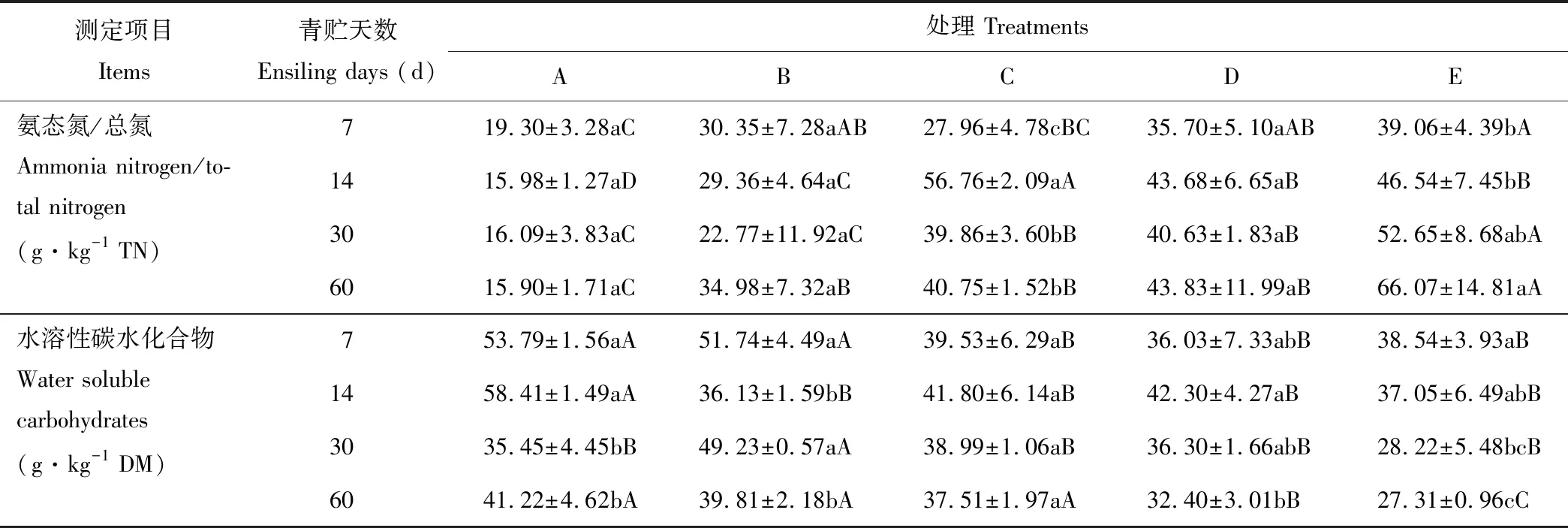
表3 西藏地区荞麦与玉米混合青贮过程中氨态氮/总氮和水溶性碳水化合物含量的变化Table 3 Changes in AT/TN and WSC content of mixed silages of buckwheat and maize during ensiling in Tibet
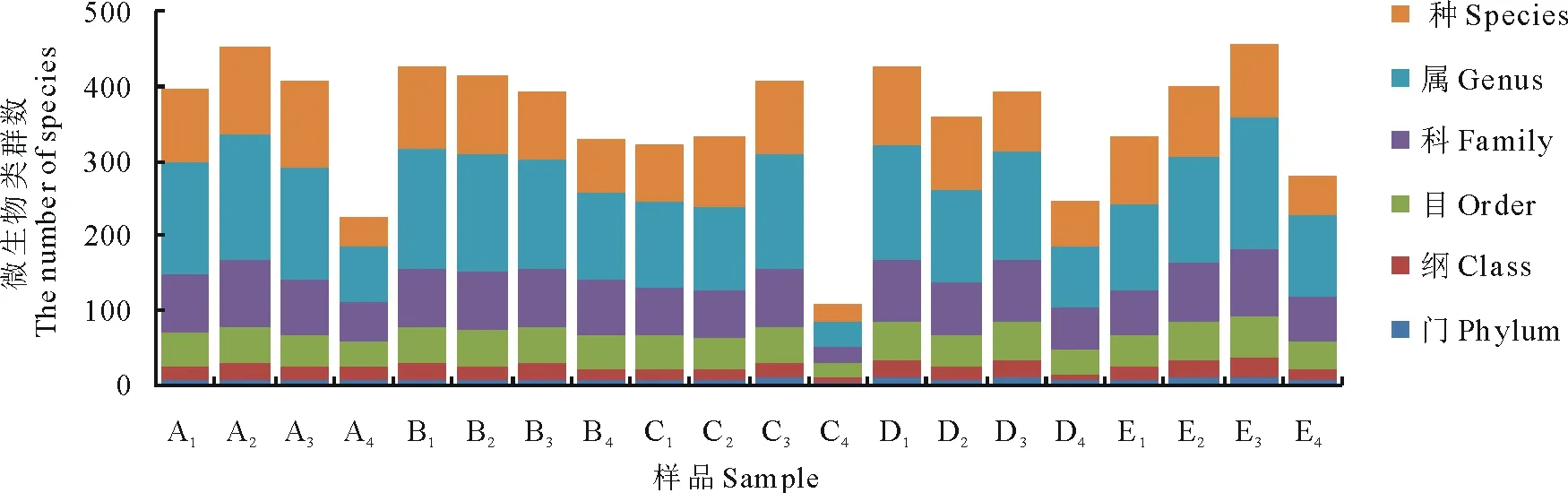
图1 OTUs分类地位鉴定Fig.1 The classification of OTUs in different silage samples

图2 各青贮组稀释曲线Fig.2 Rarefaction analysis per experimental group
指数Index青贮天数Ensiling days (d)处理 TreatmentsABCDESimpson指数Simpson index70.970.970.960.970.98140.960.970.950.980.97300.950.960.970.940.92600.900.950.900.940.86Shannon指数Shannon index77.417.556.787.347.47147.337.306.617.507.32306.777.047.346.736.47604.765.954.675.805.03ACE指数ACE index71492.481844.241182.391464.181192.10141699.631583.851110.001447.661358.09301453.471594.841466.371222.221519.6660607.18792.68352.27830.45667.05Chao1指数Chao1 index71457.291833.881131.061445.891191.01141643.651508.301110.001409.441348.53301434.431581.301426.391220.031549.1060575.13772.38351.08827.28673.22
2.2.2基于门水平的微生物群落结构分析 根据物种注释结果,选取每个样品在门分类水平上丰度大于1%的菌种,分析各青贮样品在门分类水平上相对丰度较高的物种及其比例。表5显示了在门水平上不同青贮组在不同青贮天数中微生物菌群结构的变化(丰度>1%),20个样品中共鉴定出15种菌门,其中丰度大于1%的菌门有5个,分别为变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、蓝细菌门(Cyanobacteria)、放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes),其丰度值依次为51.8%、23.3%、16.2%、7.4%和1.1%,占菌群分类的99.8%,此5种菌门为全株荞麦和全株玉米混合青贮中的优势菌门,0.2%左右的为其他菌门。
比较不同青贮试验组样品可知,混合青贮B组只有在青贮第60天时变形菌门丰度低于全株荞麦青贮组,其他青贮天数时均高于全株荞麦青贮组;混合青贮C组中,变形菌门丰度在青贮7和30 d时高于全株荞麦青贮组,在青贮14和60 d时低于全株荞麦青贮组;混合青贮D组中,变形菌门丰度在青贮7和60 d时低于全株荞麦青贮组,在青贮14和30 d时高于全株荞麦青贮组;而混合青贮E组在青贮第30和60天时变形菌门丰度高于全株荞麦青贮组,青贮第7和14天均低于或接近于全株荞麦青贮组;各混合青贮组中厚壁菌门的丰度在青贮前30 d时均高于全株荞麦青贮组,而在青贮60 d时低于全株荞麦青贮组;与全株荞麦青贮组相比,各混合青贮组中放线菌门和蓝细菌门丰度的变化规律与厚壁菌门丰度的变化规律相反;各混合青贮组中拟杆菌门的丰度大部分低于全株荞麦青贮组。
2.2.3基于属水平的微生物群落结构分析 根据物种注释结果,选取每个样品在属分类水平上丰度大于1%的菌种,分析各青贮样品在属分类水平上相对丰度较高的物种及其比例。表6显示了在属水平上不同青贮组在不同青贮天数中微生物菌群结构的变化(丰度>1%),20个样品中共鉴定出365种菌属,其中丰度大于1%的菌属有10个,分别为假单细胞菌属(Pseudomonas)、乳杆菌属(Lactobacillus)、泛菌属(Pantoea)、链霉菌属(Streptomyces)、魏斯氏菌属(Weissella)、明串珠菌属(Leuconostoc)、贪铜菌属(Cupriavidus)、乳球菌属(Lactococcus)、肠杆菌属(Escherichia)、沙雷菌属(Serratia),其丰度值依次为30.50%、12.60%、9.10%、5.40%、3.40%、3.00%、2.80%、1.60%、1.20%、1.20%,占菌群分类的70.80%,此10种菌属为全株荞麦和全株玉米混合青贮中的优势菌属,29.20%左右的为其他菌属。

表5 基于门水平上各青贮组中微生物菌群结构Table 5 The microflora structure of different silage groups at phylum level (%)

表6 基于属水平上各青贮组中微生物菌群结构Table 6 The microflora structure of different silage groups at genus level (%)

续表6 Continued Table 6
比较不同青贮试验组样品可知,青贮前30 d时,各混合青贮组中乳杆菌属丰度均高于全株荞麦青贮组,且随着全株玉米混合比例的增加而升高,但在青贮第60天时,全株荞麦青贮组中乳杆菌属丰度高于混合青贮组。各混合青贮组中魏斯氏菌属、明串珠菌属和乳球菌属丰度均高于全株荞麦青贮组,而在混合青贮D和E组中泛菌属、肠杆菌属和沙雷菌属的丰度大部分低于全株荞麦青贮组。青贮前30 d时,各青贮组中均无链霉菌属,而青贮第60天时,各青贮组中滋生了链霉菌属。因此,全株荞麦与全株玉米混合青贮,尤其是当混合青贮组中玉米所占比例超过60%时,可以增加乳杆菌属丰度,降低泛菌属、肠杆菌属和沙雷菌属丰度,有利于提升青贮饲料的发酵品质。
3 讨论
由于西藏地区特殊的气候条件和地理位置(高寒、高海拔),造成其草地生产能力极低,优质饲料资源严重缺乏,难以为牦牛、藏羊等家畜提供充足的饲草料资源等问题[1-2]。本研究以西藏地区全株荞麦和全株玉米为青贮原料,研究不同混合比例对全株荞麦和全株玉米混合青贮发酵品质和青贮过程中微生物菌群结构变化的影响,为西藏地区荞麦饲用提供技术支撑。
本试验结果显示,全株荞麦与全株玉米混合青贮后,显著降低了混合青贮组中干物质含量,并且随着全株玉米混合比例的增加而逐渐下降。混合青贮组中pH值显著低于全株荞麦青贮组,并且随着全株玉米混合比例的增加而逐渐下降,相应的乳酸含量随着全株玉米混合比例的增加而逐渐升高,这可能是因为全株玉米中干物质含量低于全株荞麦,致使各混合组随着全株玉米混合比例增加干物质含量显著下降,全株玉米中水溶性碳水化合物含量较高,可以为乳酸菌提供更多的发酵底物,有效地提高乳酸产量,降低了青贮饲料的pH值[24-26],但各青贮组中pH值均没降至常规成功青贮要求的4.2以下[27]。本研究中随着青贮的进行,各青贮组中干物质含量下降,pH值降低,乳酸含量升高,碳水化合物含量降低,这可能是因为全株荞麦和全株玉米物理结构较为粗糙,难以压实,青贮过程中青贮窖中残留较多的空气,使一些好氧性微生物分解蛋白和糖,随着青贮时间的延长和发酵强度的增加,厌氧菌和乳酸菌竞争营养,利用糖和乳酸等底物产生气体,而导致干物质的损失增加。除此之外,随着青贮的进行,全株荞麦和全株玉米混合青贮提高了碳水化合物的利用效率,使pH值降低,乳酸含量升高。本研究中,全株荞麦与全株玉米混合青贮后,虽然没有显著降低青贮饲料中氨态氮/总氮的值和丁酸含量,但各青贮组中氨态氮/总氮的值和丁酸含量均低于优质青贮饲料的要求[28](氨态氮/总氮的值低于100 g·kg-1DM,丁酸含量低于10 g·kg-1DM)。
青贮饲料发酵过程中微生物菌群的丰度和结构的变化影响着青贮饲料的发酵品质和营养成分[29]。因此本研究基于高通量测序技术对全株荞麦与全株玉米混合青贮饲料的微生物菌群结构进行检测,由研究结果得到,样本测序量已经饱和,大多数菌群被覆盖,足够反映样本中绝大部分细菌物种的信息。由4种Alpha多样性指数可知,全株荞麦与全株玉米混合比例不同,会使青贮饲料中微生物菌群的结构发生变化。本研究中共计检测到15种菌门和365种菌属,优势菌门依次为变形菌门、厚壁菌门、蓝细菌门、放线菌门、拟杆菌门,优势菌属依次为假单细胞菌属、乳杆菌属、泛菌属、链霉菌属、魏斯氏菌属、明串珠菌属、贪铜菌属、乳球菌属、肠杆菌属和沙雷菌属。这与胡宗福等[30]对青贮全株玉米中微生物菌群结构的研究结果不同。假单细胞菌属作为一种专性需氧菌,是全株荞麦与全株玉米混合青贮的优势菌属,可能是青贮窖中有空气残留造成的。本研究中混合青贮组中厚壁菌门的丰度高于全株荞麦单独青贮,尤其是在青贮D和E组中,厚壁菌门的丰度较高,说明全株荞麦与全株玉米混合青贮提高了青贮饲料中粗纤维的降解率[31]。青贮前30 d时,各混合青贮组中乳杆菌属丰度均高于全株荞麦单独青贮组,除此之外,各混合青贮组中常见的乳酸菌菌种(lactic acid bacteria,LAB),如魏斯氏菌属、明串珠菌属和乳球菌属的丰度也高于全株荞麦单独青贮组,说明全株荞麦与全株玉米混合青贮后,加强了产生乳酸的能力,降低了青贮饲料的pH值,抑制了有害杂菌的生长(青贮饲料的重要腐败菌革兰氏阳性芽孢杆菌属和梭菌属均不是全株荞麦和全株玉米混合青贮的优势菌属[32-33])。本研究中全株荞麦与全株玉米的混合比例不同,也导致青贮过程中泛菌属、贪铜菌属、肠杆菌属和沙雷菌属的丰度出现变化,这几种菌属的功能还有待进一步研究。
4 结论
全株荞麦和全株玉米混合青贮可以显著改变全株荞麦单独青贮后的发酵品质,降低了青贮饲料的pH值,提高了乳酸含量和水溶性碳水化合物的利用率。提高了厚壁菌门和LAB菌种的丰度,有效抑制了腐败菌的生长。而且这种效果随着全株玉米混合比例越高而越显著。综合考虑全株荞麦利用最大化和青贮饲料发酵品质,建议将全株荞麦和全株玉米以2∶3的比例混合青贮较为适宜。
