高通量质谱法用于小鼠器官内源性肽的鉴定
2019-04-23张佩邵先锋王振山贾辰熙
张佩,邵先锋,王振山,贾辰熙
高通量质谱法用于小鼠器官内源性肽的鉴定
张佩1,2,邵先锋2,3,王振山1,贾辰熙2
1 河北大学 生命科学学院,河北 保定 071000 2 军事科学院军事医学研究院生命组学研究所 国家蛋白质科学中心 (北京) 北京蛋白质组研究中心,北京 102206 3 天津医科大学 基础医学院,天津 300070

张佩, 邵先锋, 王振山, 等. 高通量质谱法用于小鼠器官内源性肽的鉴定. 生物工程学报, 2019, 35(4): 697–706.Zhang P, Shao XF, Wang ZS, et al. Identification of mouse organ endogenous peptides by high throughput mass spectrometry. Chin J Biotech, 2019, 35(4): 697–706.
内源性肽以细胞因子、生长激素、激素肽等形式在人体的内分泌、神经、细胞生长和生殖各个领域发挥功能。神经肽是一种内源性肽,与痛觉、睡眠、情绪、学习与记忆等生理活动相关,不但存在于脑部神经细胞,也存在于其他体液和器官内并发挥重要作用。目前对器官内源性肽的研究仍不足,尤其是其中的神经肽。文中应用液质联用串联质谱高通量鉴定胰腺、心脏、肝脏和肾脏中内源性肽的分布以及神经肽的种类。鉴定结果显示,在肝脏中内源性肽和神经肽的数目最多,而胰腺中最少;所鉴定到的内源性肽具有器官特异性,在4个器官中分别呈现不同的动态分布;4个器官中神经肽的LPV (最长肽变异体) 数目差异较大,而且基因家族的分布也各不相同,比如胰腺中的神经肽多属于Glucagon家族,心脏中的神经肽分别属于ACBD7、Granins、PEBP等几个家族。鉴定结果将为疾病的机制研究和治疗药物的研发提供参考。
器官,内源性肽,神经肽,高通量鉴定,液质联用串联质谱
内源性肽是指源自生物体内的活性肽,含量极少且效应强,分布广泛。内源性肽作为体内的信号调节分子以多种形式存在,比如细胞因子、生长激素、激素肽等,在人体的激素、神经、细胞生长和生殖等生理过程发挥重要功能[1]。目前对于内源性肽的研究相对较少,很多内源性肽的种类、功能等信息相对缺乏。有些未知功能的内源性肽可能是某些疾病的靶点。因此对器官所含内源性肽的大规模鉴定,对阐明其功能有重要意义。
神经肽是重要的一类内源性肽,主要分布在神经系统中,并少量存在于体液和外周器官[2]。在神经系统中,与痛觉、睡眠、情绪、学习、记忆等生理活动密切相关,但在外周器官的非神经细胞中,神经肽对发育分化营养增殖凋亡具有调控作用,比如在胃肠道中有胃泌素参与消化,在血管中肾上腺髓质素有强大的扩张血管的功能[2-5]。由于神经肽含量少且难以提取,所以对外周器官的神经肽的研究屈指可数[6-8]。
近年来,运用质谱仪对蛋白质组学和肽组学进行大规模鉴定的方法已经成熟,质谱法(Mass spectrometry,MS)是利用电场和磁场将运动的离子按自身的质荷比分离后进行检测的方法。与传统的Western blotting、免疫共沉淀的方法比较,质谱法更便利、精准、高效。高灵敏度和高分辨的液质联用串联质谱允许对微量物质进行有效分离,是研究生物样本、检测疾病药物必不可少的分析工具,因此成为含量极少的内源性肽进行鉴定的最佳选择[9-16]。
本研究利用基于质谱技术的肽组学方法,对器官内的内源性肽进行大规模鉴定,并重点表征神经肽,对其数目和种类及不同器官的区域性分布进行对比。取小鼠的心脏、肝脏、肾脏和胰腺4种外周器官,通过研磨,利用酸化甲醇去除组织内的大蛋白分子,从而提取内源性的多肽。为避免大蛋白降解造成的信号污染,整个实验过程在冰上进行。样品制备完毕后用液质联用串联质谱法进行器官中内源性肽的大规模鉴定。
1 材料与方法
1.1 小鼠器官的采集
动物:SPF级C57BL/6雄性小鼠,8周龄,体重约35 g,购自北京维通利华实验动物技术有限公司,饲养于国家蛋白质科学中心动物饲养平台。为了避免环境改变对小鼠生理稳定的影响,购买后饲养1周使小鼠对新的环境适应保持各个生理指标的平衡。
解剖器官:用水合氯醛 (4%,0.20 mL/20 g) 腹腔注射麻醉小鼠。在体式显微镜下结扎左侧颈外动脉,注射针头从左侧颈动脉进入颈总动脉,观察老鼠的呼吸和心跳是否正常,在保证心跳和呼吸正常的情况下平稳注入生理盐水,生理盐水循环全身,取心脏、肝脏、肾脏和胰腺。
微波炉加热[17]:为了去除蛋白酶体外再次酶切造成背景干扰,器官立即在微波炉内 (800 W,30 s) 加热使蛋白酶失活[3],样品−80 ℃保存。
1.2 内源性肽的提取
肽的提取[10]:将器官分别放在玻璃研磨器 (5 mL容量),加入2 mL酸化甲醇提取液(90% LC/MS级甲醇,9%超纯水,1% LC/MS级乙酸),在冰上顺时针研磨,直至器官破碎溶解于提取液,水浴超声2 min,4 ℃、20 000×离心10 min,上清液加入到30 kDa的超滤管,进一步去除大蛋白和脂质,收集液蒸干。0.1%甲酸水 (99.9%超纯水,0.1%甲酸) 重悬,使用C18反向色谱除盐 (Agilent,USA),最后用100 mL洗脱液(45%乙腈,0.1%乙酸,54.9%超纯水) 洗脱,蒸干后−20 ℃保存备用,具体流程如图1。
1.3 液质联用串联质谱参数设定
液相为Thermo EASY-nLC1000 (Thermo Fisher Scientific,Bremen,Germany),取500 ng样品溶于0.1%甲酸水注入液相的C18色谱柱 (预柱内C18填料:直径3 μm,孔径120 Å,长度为5 cm;分析柱内C18填料:直径1.9 μm,孔径120 Å,长度为12 cm),在速度为600 nL/min、时间为65 min的分离条件进行分离,5%–40%的分离液 (0.1%甲酸,99.9%乙腈),电压为2.2 kV。
质谱为Thermo Q ExactiveTMHF(Thermo Fisher Scientific,Bremen,Germany),用MS/MS的采集模式分析肽,一级分辨率为120 000,二级分辨率为15 000,一级的扫面范围是250–1 800/,每次扫描丰度在前20的离子被29%的碰撞能量进行高能碰撞裂解。自动增益控制目标设置:一级为3×e6和二级为2×e5,最大注入时间:一级和二级都是80 ms,动态排除时间为13 s,电荷排除:+1、+8、>+8价。
1.4 数据处理
所有质谱原始数据均使用PEAKS Studio (Version 8.5) 先进行肽段的从头测序,再进行数据库的搜库,搜库参数设置:前体质量最大偏差10 ppm,碎片离子偏差在0.2 Da以内,肽段FDR≤1%且-10logP≥20,无酶切,动态修饰包括Amidation、Oxidation (M)、Phosphorylation (STY)、Acetylation (K),每条肽段最多允许存在2个动态修饰。
数据库来源:(1) 内源性肽库:UniProt中小鼠的全蛋白库,删除所有神经肽的前体。(2) 神经肽数据库:a. Swepep[18](http://www.swepep.org/);b. Neuropedia[19](http://proteomics.ucsd.edu/Software/ NeuroPedia/);c. Neuropep[20](http://isyslab.info/ NeuroPep/);d. UniProt小鼠的神经肽的前体。
为了重点分析神经肽,将神经肽库从内源性肽中取出单独分析。以下所描述的内源性肽为不包含神经肽的其他内源性肽。
2 结果与分析
用肽组学的方法得到肽的数目如表1所示,其中,在肝脏中鉴定到的内源性多肽和神经肽的数目最多,分别为3 471和427个;胰腺中皆为最少。

图1 小鼠器官内源性肽提取鉴定流程图

表1 四个器官中内源性肽和神经肽的鉴定数目
2.1 内源性肽和神经肽在4个器官中的动态范围
对所鉴定到的各器官中内源性肽和神经肽的动态范围进行分析,如图2A所示,发现内源性肽和神经肽在不同器官内的动态范围差别较大。在肝脏中鉴定到的内源性肽和神经肽数目最多,而且动态范围最大;而胰腺中的内源性肽和神经肽数目最少。心脏的神经肽数目比胰腺多,但是动态范围却比胰腺要小。相同的内源性肽和神经肽在不同器官中的丰度差异同样很大,例如图2A中的内源性肽的Ferritin (96–114)和有功能的神经肽Little-SAAS的丰度差异,神经肽Little-SAAS[21]在心脏中高丰度表达,但是在肾脏中丰度较低。此分析结果表明器官间内源性肽和神经肽的分布存在较大的组织区域性,充分证明了肽组学方法的高效性。

2.2 内源性肽丰度的累积分布
为了分析器官内源性肽在总体水平的分布情况,对内源性肽和神经肽的丰度进行排序,作出累积分布图。图2B为内源性肽和神经肽的累积分布图,示意为4个等级:Q1表示前25%,Q2表示25%–50%,Q3表示50%–75%,Q4表示75% –100%。在4个器官的神经肽的分布中,有功能的全长肽Thymosin-beta-4分别占胰腺、心脏和肾脏的累积丰度第一位,肝脏中的排列是第四。Thymosin-beta-4[22]具有增强细胞免疫功能和调节免疫平衡等作用,在器官内发挥重要功能。4个器官累积丰度最高的前3个神经肽的具体信息如表2所示。
2.3 四个器官共同鉴定到的肽以及肽的器官特异性
将所有的内源性肽、内源性肽所对应的前体蛋白和神经肽分成4个区域:共同存在于4个器官、共同存在于3个器官、共同存在于2个器官和只存在于1个器官的特异性的肽。结果见图3,其中的外层数据圆是所有的内源性肽和内源肽对应的蛋白前体,内部4个数据圆是内源性肽和神经肽分别相对应的器官分布注释。4个器官共有肽的数目相对较少,仅为45条,而且共有的蛋白前体 (45条肽来源的蛋白前体) 仅有25个。表3为4个器官中共有的内源性肽前体蛋白。器官特异性的内源性肽和其前体蛋白的数目较多,表4为每个器官中丰度最高的前5个器官特异性内源肽的蛋白前体。将所有器官特异性肽的蛋白前体作GO分析 (图3A内部),取每个器官中高度富集的前5个生物过程,发现不同器官中特异性内源肽来源的蛋白前体所参与的生物过程有显著差异。胰腺和心脏中的蛋白前体大多参与细胞成分和染色体等的产生过程,肾脏中大多数蛋白前体参与有机氮、酰胺以及核苷酸的合成,而肝脏中的蛋白前体多参与细胞代谢等过程。
图3B为神经肽的器官区域性分布,4个器官共有的神经肽为3条,器官特异性的神经肽较多,表5中将每个器官中丰度最高的前3个器官特异性神经肽列出。所有鉴定到的神经肽中有6条为功能已报道的完整神经肽,其中Thymosin-beta-4和Little-SAAS共存同在于4个器官内。Little-SAAS[21]与神经昼夜节律相关,同样在体内发挥重要作用。在肾脏中有3条特异性的功能性完整肽:缓激肽(Bradykinin)[23]、血管紧张素-1 (Angiotenxin-1)[24]和神经肽Y (Neuropeptide-Y)[25-27],这3条肽都与心血管疾病密切相关。

表2 四个器官中累积分布排名前三的神经肽
Top1,2 and 3 are the top three peptides in the abundance of each organ, and Top1 is the most abundant peptide.
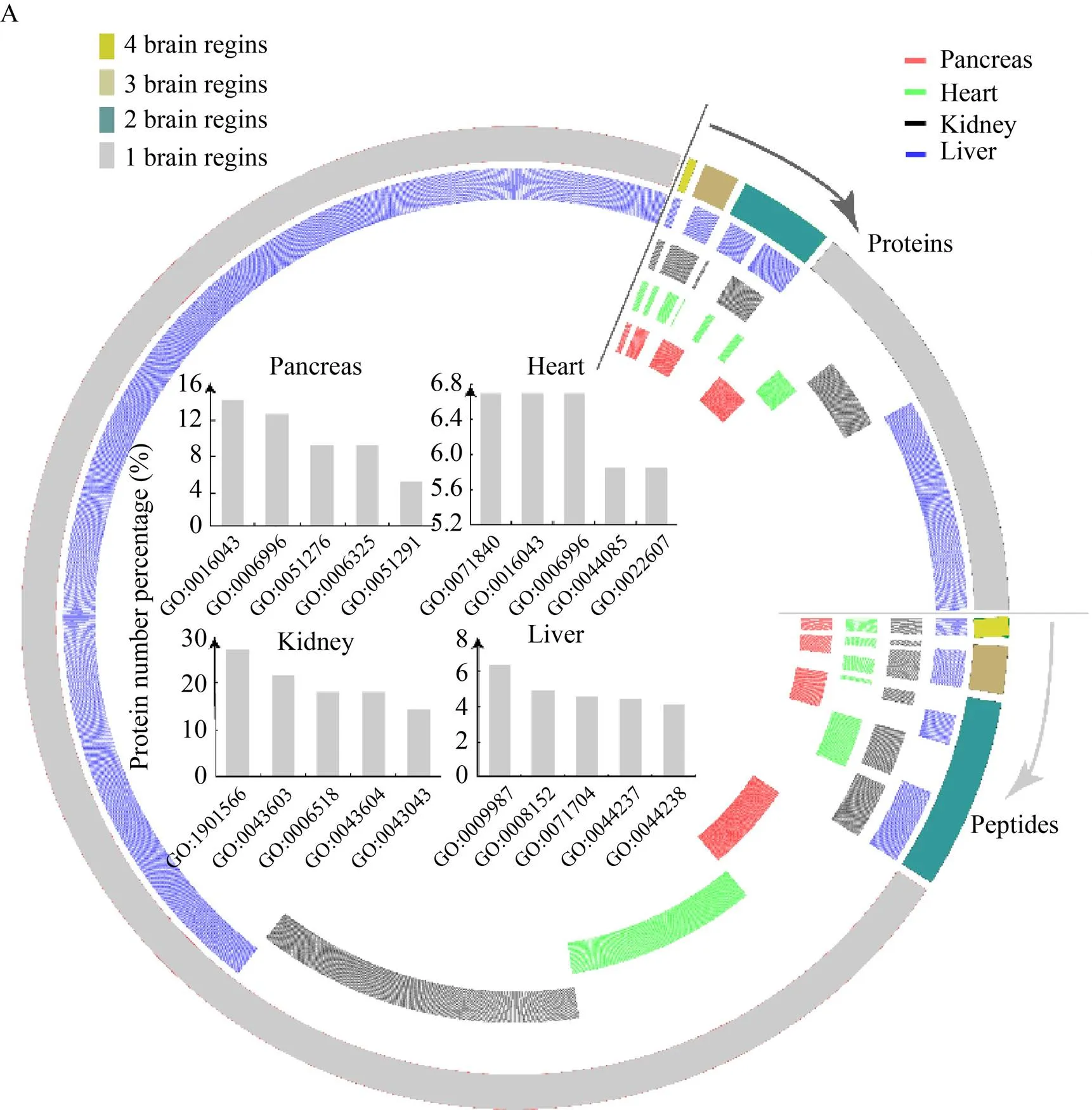
图3 四个器官中内源性肽及其蛋白前体和神经肽的分布

表3 四个器官共有的内源性肽的前体蛋白

表4 丰度最高的前5个器官特异性内源性肽的前体蛋白

表5 丰度最高的前3个器官特异性神经肽前体
内源性肽的组织特异性与蛋白水平特异性可能与其基因的表达丰度有一定关联,且与蛋白的降解动力学有关[1,28]。
2.4 内源性肽和神经肽主成分分析
主成分分析旨在利用降维的方法,把多种因素转化成几种成分,其中每个主成分都能够反映原始数据的真实信息。主成分数据投影到一个二维或者三维的空间内,反映样本间的相关性。内源性肽主成分分析图中 (图4) 胰腺和肾脏的距离较近,而在神经肽主成分分析图中心脏和肾脏的距离比较近。通过主成分分析,充分展示了器官之间在内源性肽和神经肽角度的相似性和差异性。

图4 四个器官中内源性肽和神经肽的主成分分析
2.5 最长肽变异体 (LPV) 分析
非特异性蛋白酶切割会产生阶梯特征的肽序列,为了进一步降低数据的复杂性,Secher等开发了LPV算法[9]。将器官内所鉴定到的神经肽进行LPV分析 (图5A),胰腺、心脏、肾脏和肝脏中LPV数目分别为23、54、126和300。胰腺和心脏中鉴定到的神经肽的总数量差异不显著,但是LPV的数目相差较大,说明心脏中由非特异性蛋白酶产生的阶梯序列较少。4个器官LPV分布情况如图5B所示,共有的LPV序列仅有1条,序列为SDKPDMAEIEKFDKSKLKKTETQEKNP LPSKETIEQEKQAGES。
2.6 神经肽的基因家族分析
根据www.neuropeptides.nl网站[29]对神经肽基因家族的分类,将4个器官中鉴定到的所有神经肽进行分类,标出神经肽数目前10个家族 (图6)。胰腺中的神经肽多属于Glucagon家族,心脏中的神经肽分别属于ACBD7、Granins、PEBP等几个家族。肾脏中的神经肽极少数属于Thymosin家族且均匀分布在其他家族。肝脏中的神经肽在每个家族都有分布,但在Glucagon中较少。此结果显示器官之间神经肽基因家族分布存在较大差异,也说明器官内的神经肽由于基因家族特异性分布而发挥不同的功能。

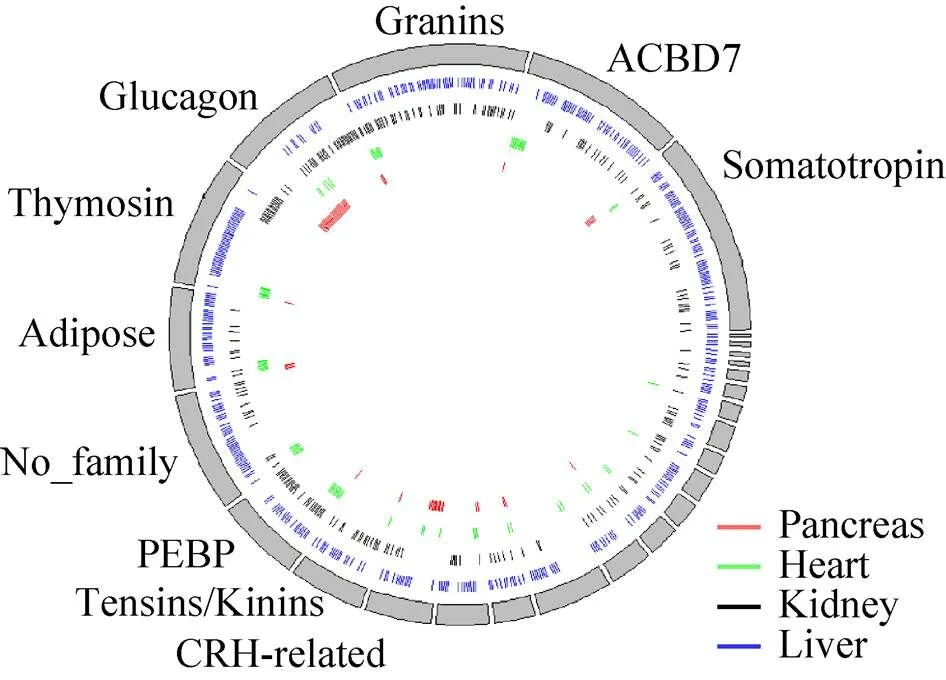
图6 神经肽的基因家族分析
3 讨论
本研究对胰腺、心脏、肝脏和肾脏4个器官的内源性肽进行大规模鉴定,并对其中的种类、数目分布等进行分析,同时对4个器官内的神经肽进行了表征。结果显示,肝脏的内源性肽数目最多且与细胞代谢密切相关;肝脏中神经肽的数目也是最多,且基因家族呈均值分布,这些神经肽在体内参与了较多的生理功能。胰腺中内源性肽和神经肽数目都是最少的,其内源性肽大多参与体内细胞合成等基本功能,其神经肽70%分布在Glucagon家族,对血糖的调控具有重要作用。近年来科学家发现胰高血糖素样肽-1 (Glucagon-like peptide-1,GLP-1)[30-31]对神经病理性疼痛具有镇痛作用,希望将来研究出以GLP-1为靶点的新型抗慢性疼痛药物,减轻慢性疼痛患者痛苦。在心脏中,神经肽主要分布在ACBD7、Adipose、Granins、PEBP等几个基因家族,阿片肽(Adipose)一直是近年来神经生物学研究的热点[1-2],它们对机体的心血管功能、内分泌免疫网络的调节以及消化系统、呼吸系统等都具有重要作用。肾脏中除了与其他器官共有的具有功能性的完整肽以外,还包含3条具有肾脏特异性的功能性完整肽。缓激肽 (Bradykinin)[23]是一种有效的内皮依赖性血管舒张剂,能降低血压。它还会导致支气管和肠道内非血管平滑肌的收缩,增加血管通透性,并参与疼痛机制。缓激肽也会引起钠尿,导致血压下降。已经有研究表明血管紧张素-1 (Angiotenxin-1)[24]与血管机能具有密切联系。神经肽Y (Neuropeptide-Y)[25]在原发性高血压、充血性心力衰竭、冠心病、糖尿病的发生发展过程中有着极其重要的病理生理学意义。这3个出现在肾脏中的功能性的完整神经肽都与心血管疾病相关,在预防和治疗一些心血管疾病具有重要的意义。在神经肽的PCA分析中,肾脏和心脏的距离最近,由此可见肾脏中和心脏中神经肽以及功能之间具有密切联系。
内源性肽尤其是神经肽在人体中发挥重要功能,是疾病诊断、预防、治疗的关键,也是药物研发的重要靶点。随着技术的发展,先进的仪器和更高效的纯化方法不断被开发并应用于蛋白质组学和肽组学。本研究对器官内源性肽的探索将为未来内源性肽机制的深入研究提供参考。
[1] Adams ML, Brase DA, Welch SP, et al. The role of endogenous peptides in the action of opioid analgesics. Annals of Emergency Medicine, 1986, 15(9): 1030-1035.
[2] Fricker LD. Neuropeptides and Other Bioactive Peptides: From Discovery to Function. New York: Morgan & Claypool Life Sciences, 2012.
[3] Hökfelt T, Bartfai T, Bloom F. Neuropeptides: opportunities for drug discovery. Lancet Neurol, 2003, 2(8): 463–472.
[4] Mathè AA, Stenfors C, Brodin E, et al. Neuropeptides in brain: effects of microwave irradiation and decapitation. Life Sci, 1990, 46(4): 287–293.
[5] Kormos V, Gaszner B. Role of neuropeptides in anxiety, stress, and depression: from animals to humans. Neuropeptides, 2013, 47(6): 401–419.
[6] Mooney C, Haslam NJ, Pollastri G, et al. Towards the improved discovery and design of functional peptides: common features of diverse classes permit generalized prediction of bioactivity. PLoS ONE, 2012, 7(10): e45012.
[7] Sköld K, Svensson M, Kaplan A, et al. A neuroproteomic approach to targeting neuropeptides in the brain. Proteomics, 2002, 2(4): 447–454.
[8] Fälth M, Sköld K, Svensson M, et al. Neuropeptidomics strategies for specific and sensitive identification of endogenous peptides. Mol Cell Proteomics, 2007, 6(7): 1188–1197.
[9] Secher A, Kelstrup CD, Conde-Frieboes KW, et al. Analytic framework for peptidomics applied to large-scale neuropeptide identification. Nat Commun, 2016, 7: 11436.
[10] Shao XF, Ma M, Chen RB, et al. Identification of mouse brain neuropeptides by high throughput mass spectrometry. Chin J Biotech, 2018, 34(4): 594–601 (in Chinese). 邵先锋, 马敏, 陈瑞冰, 等. 高通量质谱法用于小鼠脑部神经肽的鉴定. 生物工程学报, 2018, 34(4): 594–601.
[11] Altelaar AFM, Mohammed S, Brans MAD, et al. Improved identification of endogenous peptides from murine nervous tissue by multiplexed peptide extraction methods and multiplexed mass spectrometric analysis. J Proteome Res, 2009, 8(2): 870–876.
[12] An ZM, Chen YD, Koomen JM, et al. A mass spectrometry-based method to screen forα-amidated peptides. Proteomics, 2012, 12(2): 173–182.
[13] Schmidlin T, Boender AJ, Frese CK, et al. Diet-induced neuropeptide expression: feasibility of quantifying extended and highly charged endogenous peptide sequences by selected reaction monitoring. Anal Chem, 2015, 87(19): 9966–9973.
[14] Che FY, Lim J, Pan H, et al. Quantitative neuropeptidomics of microwave-irradiated mouse brain and pituitary. Mol Cell Proteomics, 2005, 4(9): 1391–1405.
[15] Buchberger A, Yu Q, Li LJ. Advances in mass spectrometric tools for probing neuropeptides. Ann Rev Anal Chem, 2015, 8(1): 485–509.
[16] Yamaguchi H, Sasaki K, Satomi Y, et al. Peptidomic identification and biological validation of neuroendocrine regulatory peptide-1 and -2. J Biol Chem, 2007, 282(36): 26354–26360.
[17] van Dijck A, Hayakawa E, Landuyt B, et al. Comparison of extraction methods for peptidomics analysis of mouse brain tissue. J Neurosci Methods, 2011, 197(2): 231–237.
[18] Fälth M, Sköld K, Norrman M, et al. SwePep, a database designed for endogenous peptides and mass spectrometry. Mol Cell Proteomics, 2006, 5(6): 998–1005.
[19] Kim Y, Bark S, Hook V, et al. NeuroPedia: neuropeptide database and spectral library. Bioinformatics, 2011, 27(19): 2772–2773.
[20] Wang Y, Wang MX, Yin SW, et al. NeuroPep: a comprehensive resource of neuropeptides. Database, 2015, 2015: bav038.
[21] Wardman JH, Berezniuk I, Di S, et al. ProSAAS-derived peptides are colocalized with neuropeptide Y and function as neuropeptides in the regulation of food intake. PLoS ONE, 2011, 6(12): e28152.
[22] Banerjee I, Zhang JL, Moore-Morris T, et al. Thymosin beta 4 is dispensable for murine cardiac development and function. Circulat Res, 2012, 110(3): 456–464.
[23] Marcos-Contreras OA, de Lizarrondo SM, Bardou I, et al. Hyperfibrinolysis increases blood-brain barrier permeability by a plasmin- and bradykinin-dependent mechanism. Blood, 2017, 128(20): 2423–2434.
[24] Wang XH, Li L, Hölscher C, et al. Val8-glucagon-like peptide-1 protects against Aβ1–40-induced impairment of hippocampal late-phase long-term potentiation and spatial learning in rats. Neuroscience, 2010, 170(4): 1239–1248.
[25] Broberger C, Johansen J, Johansson C, et al. The neuropeptide Y/agouti gene-related protein (AGRP) brain circuitry in normal, anorectic, and monosodium glutamate-treated mice. Proc Natl Acad Sci U S A, 1998, 95(25): 15043–15048.
[26] Sajdyk TJ, Shekhar A, Gehlert DR. Interactions between NPY and CRF in the amygdala to regulate emotionality. Neuropeptides, 2004, 38(4): 225–234.
[27] Tatemoto K, Carlquist M, Mutt V. Neuropeptide Y-A novel brain peptide with structural similarities to peptide YY and pancreatic polypeptide. Nature, 1982, 296(5858): 659–660.
[28] Camargo ACM, Fernandes BL, Cruz L, et al. Bioactive Peptides Produced by Limited Proteolysis. New York: Colloquium Series on Neuropeptides, 2012.
[29] Burbach JPH. Neuropeptides from concept to online database www.neuropeptides.nl. Eur J Pharmacol, 2010, 626(1): 27–48.
[30] Perry T, Lahiri DK, Sambamurti K, et al. Glucagon-like peptide-1 decreases endogenous amyloid-β peptide (Aβ) levels and protects hippocampal neurons from death induced by Aβ and iron. J Neurosci Res, 2003, 72(5): 603–612.
[31] DellaValle B, Brix GS, Brock B, et al. Glucagon-like peptide-1 analog, liraglutide, delays onset of experimental autoimmune encephalitis in Lewis rats. Front Pharmacol, 2016, 7: 433.
Identification of mouse organ endogenous peptides by high throughput mass spectrometry
Pei Zhang1,2, Xianfeng Shao2,3, Zhenshan Wang1, and Chenxi Jia2
1 School of Life Sciences, Hebei University, Baoding 071000, Hebei, China 2 Beijing Proteome Research Center, National Center for Protein Sciences (Beijing), Beijing Institute of Lifeomics, Beijing 102206, China 3 Basic Medical College, Tianjin Medical University, Tianjin 300070, China
Endogenous peptides, in the form of cytokines, growth hormones and hormone peptides, play an important role in human hormones, nerves, cell growth and reproduction. Neuropeptide is a kind of endogenous peptide, which is related to the physiological activities of pain, sleep, emotion, learning and memory. Neuropeptides exist not only in the nerve cells of the brain, but also in other body fluids and organs. At present, there is still a lack of research on endogenous peptides, especially on neuropeptides. In this study, high-throughput liquid chromatography tandem mass spectrometry was used to identify the distribution of endogenous peptides in the pancreas, heart, liver and kidney as well as the types of neuropeptides. The results showed that the number of endogenous peptides and neuropeptides in the liver was the highest while that of the pancreas was the lowest. The identified endogenous peptides were organ-specific and presented different dynamic distribution in four kinds of organs. The number of LPV (Longest peptide variant) of neuropeptide in the four organs varies greatly, and the distribution of gene family is also different. For example, neuropeptide in pancreas belongs to Glucagon family, while neuropeptide in heart belongs to ACBD7, Granins, PEBP and other families. The identification results will provide reference value for the mechanism study of diseases and the research and development of therapeutic drugs.
organ, endogenous peptide, neuropeptide, high-throughput identification, LC-MS/MS
10.13345/j.cjb.180377
September 13, 2018;
November 13, 2018
National Key R&D Program of China (Nos. 2017YFA0505702, 2016YFA0501302), National Natural Science Foundation of China (No. 21675006).
Chenxi Jia. E-mail: cja@mail.ncpsb.org
Zhenshan Wang. E-mail: zswang@hbu.edu.cn
国家重点研发计划 (Nos. 2017YFA0505702, 2016YFA0501302),国家自然科学基金 (No. 21675006) 资助。
2018-12-10
http://kns.cnki.net/kcms/detail/11.1998.q.20181207.1331.004.html
(本文责编 陈宏宇)
