拉萨青稞种植农田土壤中真菌区系分析
2019-04-23刘青海达娃卓玛卢向阳白军平
潘 虎,刘青海,田 云,达娃卓玛,卢向阳,次 顿,白军平
(1.西藏自治区农牧科学院 农业质量标准与检测研究所,西藏 拉萨 850032;2.湖南农业大学 生物科学技术学院,湖南 长沙 410128)
青稞(HordeumvulgareLinn.var.nudumHook.f.)是西藏第一大农作物,是藏区农牧民不可替代的粮食作物。西藏地处我国西南边陲,高寒、低温、缺氧等极端环境造就了独特的土壤微生物群落组成,但同时也导致西藏土壤微生物活性下降,造成青稞农田土壤较为贫瘠[1-2]。土壤微生物是土壤生态系统中碳、氮、磷等元素转换和循环的主要动力,也是土壤有机质分解、腐殖质形成等生化过程的主要参与者,在整个土壤生态系统中起着不可替代的作用[3-4]。目前,西藏地区土壤微生物群落组成的研究还处于起步阶段。荣新山等[5]采用高通量测序技术对藏北退化高寒草原土壤真菌多样性进行分析,结果表明,藏北退化高寒草原土壤真菌群落的优势门类主要为子囊菌门(Ascomycota)、担子菌门(Basidiomycota)等;段双全等[6]利用核糖体DNA限制性酶切片段多态性分析了西藏羊八井废弃热井沉积物中的真核微生物多样性,结果表明,沉积物中主要的真核微生物有子囊菌、壶菌、担子菌和非培养真菌等;赵垦田等[7]利用马丁氏培养基从拉萨半干旱河谷砂生槐灌丛土壤中分离鉴定的优势真菌主要为青霉属(Penicillium)、酵母属 (Saccharomyces)、木霉属(Trichoderma)和拟青霉(Paecilomyces)等,但有关青稞农田土壤真菌区系的研究尚未见系统报道[8]。鉴于此,以高原特色农作物青稞为研究对象,以青稞种植土壤为试验材料,通过Illumina公司高通量测序技术分析青稞种植土壤中真菌的群落结构,为青稞种植土壤真菌资源的挖掘与利用提供基础信息。
1 材料和方法
1.1 试验材料
依据西藏青稞生育期,分别于2016年3月25日[播种前期(Group A)]、7月8日[灌浆期(Group B)]、9月28日[收获后期(Group C)]在拉萨周边选择9块大面积青稞种植农田采集土壤样品(表1)。土壤样品采用5点取样法,样品混匀后用无菌塑封袋封装[将土壤样品编号为n-1、n-2、n-3,其中,n代表样品采样点(共9个采样点),1代表播种前期采集的样品,2代表灌浆期采集的样品,3代表收获后期采集的样品],-18 ℃保存备用。

表1 土壤样品采集点信息Tab.1 The sampling site information of soil samples
1.2 试验方法
1.2.1 土壤样品基因组DNA的提取 采用天根生化科技(北京)有限公司土壤基因组DNA提取试剂盒(DP 336)提取青稞种植农田土壤样品中微生物的总DNA,按说明书操作,所提取的总DNA于-20 ℃保藏备用。
1.2.2 真菌转录间隔区(ITS)部分序列的聚合酶链式反应(PCR)扩增及测序 用提取的总DNA为模板,采用PCR扩增真菌ITS部分序列片段。扩增引物为R:5′-TCCTCCGCTTATTGATATGC-3′和F:5′-GCATC-GATGAAGAACGCAGC-3′[9],PCR扩增体系(50 μL):10×Buffer 5 μL、dNTP(2.5 mmol/L)4 μL、引物各1 μL、TakaRaTaq(5 U/μL) 0.25 μL、模板1 μL、无菌水37.75 μL。扩增条件:95 ℃预变性5 min,95 ℃ 变性30 s,55 ℃退火 1 min,72 ℃延伸1.5 min,30个循环;72 ℃延伸10 min,扩增产物采用Min Elute PCR Purefication Kit 纯化后4 ℃保存。取2 μL PCR产物,2%琼脂糖凝胶电泳检测。将PCR扩增产物送至杭州晶佰生物科技有限公司进行测序,测序平台为Illumina-Miseq。
1.2.3 生物信息学分析 采用CASAVA(v 1.8.2)软件对原始测序结果进行图像碱基识别,原始数据经过预处理去除低质量的序列后,应用Pandaseq(v 2.7)和Trimmomatic(v 0.33)软件进行数据优化分析,获得高质量序列数据。计算在97%的相似水平上每个样本的操作分类单元(OTUs)数量,并绘制稀释曲线(Rarefaction curves)[10]。利用Qiime(v 1.7)软件计算样品包括超(Chaol)指数和香农(Shannon)指数的阿尔法(α)多样性值,Chaol指数值越高表明群落物种的丰富度越高,Shannon指数值越高表明群落物种的多样性越高[11]。
2 结果与分析
2.1 土壤样品中真菌群落丰富度及多样性分析
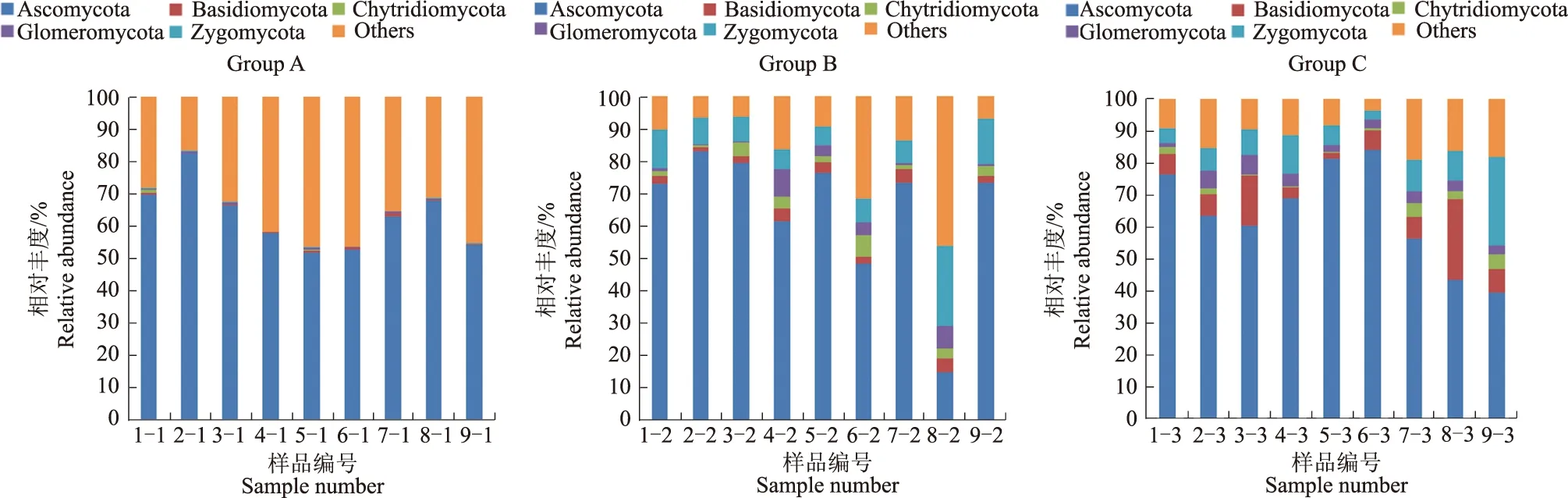
从表2和图1可见,所有土壤样品真菌的稀释曲线均已进入平台期,所有土壤样品的测序深度指数均在0.980以上,表明随着测序数量的增加,发现新的真菌种类的概率较小,测序数据能够较好地反映土壤样品中真菌群落区系组成。通过Illumina高通量测序,发现3个不同时期样品的Chaol指数均值和Shannon指数均值大小排序均为Group A 以97%的一致性将序列聚类成为OTUs,对所有OTUs的代表序列进行物种注释后,土壤样品中真菌群落在门水平上主要划分为以下5类:子囊菌门(Ascomycota)、担子菌门(Basidiomycota)、壶菌门(Chytridiomycota)、球囊菌门(Glomeromycota)和接合菌门(Zygomycota)(图2)。对土壤样品在属水平上的真菌的相对丰度进行分析,结果表明,接合菌门(Zygomycota)的被孢霉属(Mortierella),子囊菌门(Ascomycota)的足孢子菌属(Podospora)、赤霉菌属(Gibberella)、分子孢子菌属(Cladosporium)和毛壳菌属(Chaetomium)等是各样品中在属水平上相对丰度排名前15的主要物种,是拉萨青稞种植农田土壤中的优势真菌类群(图3)。 表2 土壤样品中真菌的α多样性及OTUs数量Tab.2 The α diversity and OTUs quantity of fungi in each soil sample 图1 土壤样品中真菌序列的稀释曲线Fig.1 Rarefaction curves of pyrosequencing reads of fungi in each soil sample 图2 土壤样品门水平上主要真菌的相对丰度Fig.2 Relative abundance analysis of the major fungi in each soil sample at phylum level 图3 土壤样品属水平上前15类真菌的相对丰度Fig.3 Relative abundance analysis of the top 15 fungi in each soil sample at genus level 对不同采样点土壤样品的真菌群落进行主成分(PCoA)分析,结果(图4)表明,在Group A中样品9-1的真菌群落组成与其他样品差异最大,通过对属水平的前15类真菌的相对丰度比较发现,样品9-1真菌群落中独有的嗜热丝孢菌属(Thermomyces)是引起群落组成差异显著的重要原因。在Group B中除2-2和9-2外,其他样品的真菌群落组成差异相对一致,通过PCoA分析显示,1-2、3-2、4-2、5-2、6-2、7-2、8-2 7个样品单独聚合归为相近的一类,通过对属水平上前15类真菌的相对丰度比较发现,样品2-2中真菌群落独有的球囊霉属(Glomus)、样品9-2中真菌群落独有的离蠕孢霉属(Bipolaris)可能是引起群落真菌组成差异显著的重要原因。在Group C中,样品1-3、5-3、6-3的真菌群落组成差异最小,而样品3-3、4-3分别与组内其他样品的真菌群落组成差异较大,通过对属水平的前15类真菌的相对丰度比较发现,样品3-3中真菌群落独有的管柄囊霉属(Funneliformis)、小画线壳属(Monographella),样品4-3中真菌群落独有的蛇颈龙属(Ophiosphaerella)和埃里格孢属(Embellisia)可能是引起真菌群落组成差异显著的重要原因。而Group C中的 7-3、8-3、9-3样品真菌群落中因有油瓶霉属(Lecythophora)被PCoA分析单独聚合归为一类。GroupB 内的样品PCoA聚合较Group A和Group C相对一致,即除2-2和9-2样品外,Group B 内的其他样品真菌群落组成差异较小,说明在青稞灌浆期土壤中真菌群落具有趋同特征。 问:我在中国工作过,如果中国警察对我提出要求,我会听从。如果今后来瑞典旅游的中国游客面临与瑞典警察对话的情况,您对他们有什么建议? 图4 土壤样品中真菌群落主成分分析Fig.4 The PCoA analysis of fungi OTUs in each soil sample 对Group A与Group B、Group C之间各样品属水平上前15类真菌差异情况进行分析(表3),结果表明,1、5、7号样品在不同采样时期真菌群落组成分别在顶囊壳属(Gaeumannomyces)、金孢子菌属(Emmonsia)和茎点霉属(Phoma)存在显著差异。其中,样品1-1真菌组成分别与1-2、1-3相比具有较多的顶囊壳属(Gaeumannomyces),样品5-1真菌组成分别与5-2、5-3相比具有较多的金孢子菌属(Emmonsia),而样品7-1真菌组成分别与7-2、7-3相比具有较多的茎点霉属(Phoma)。采用多重比较法(LSD)对属水平上各样品真菌组间差异进行分析(表4),结果显示,在播种前期、 灌浆期和收获后期,1、2、4、5、7号样品真菌群落组成分别在金孢子菌属(Emmonsia)、暗球腔菌属(Phaeosphaeria)、被毛孢属(Hirsutella)、金孢子菌属(Emmonsia)、小毛盘菌属(Cistella)上存在显著差异。 表3 不同时期同一地点属水平上前15类真菌差异分析Tab.3 Difference analysis of the top 15 fungi in same location between different periods 注:P<0.05表示各样品间差异达显著水平,下同。 Note:P<0.05 indicate significant differences between different samples,the same below. 表4 属水平上土壤样品真菌组间差异分析Tab.4 Difference analysis of fungi between groups at genus level in each soil sample 土壤微生物群落功能多样性能描述微生物群落状态,同时能灵敏地反映出土壤的质量变化,土壤微生物群落功能的多样性与均一性不仅能提高土壤生态系统的稳定性,同时也能提升土壤微生态环境的抵抗能力[12-13]。本试验首次采用Illumina高通量测序技术对拉萨9处不同青稞种植农田土壤进行了真菌群落结构解析,结果显示,土壤真菌群落在门的水平上主要为子囊菌门 (Ascomycota)、担子菌门(Basidiomycota)、壶菌门(Chytridiomycota)、球囊菌门(Glomeromycota)和接合菌门(Zygomycota),在属的水平上主要为被孢霉属(Mortierella)、足孢子菌属(Podospora)、赤霉菌属(Gibberella)、分子孢子菌属(Cladosporium)和毛壳菌属(Chaetomium)等,青稞灌浆期较播种前期、收获后期真菌群落组成差异较小,其土壤真菌群落具有趋同特征。普布次仁等[14]对西藏真菌归纳统计结果显示,西藏真菌总计185科551属2 599种,其中担子菌门、子囊菌门、球囊菌门、接合菌门、壶菌门等是西藏地区的优势真菌类群。MAESTRE等[15]和REN等[16]研究结果表明,土壤真菌群落的优势门类主要为子囊菌门和担子菌门。本试验结果与上述研究较为一致。同时,针对藏北那曲草原[5]、青海果洛“三江源”高山草甸[17]、美国科罗拉多州高山苔原[18]等高寒草原生态系统的真菌多样性研究结果与本试验也较为一致,表明拉萨地区青稞种植农田土壤真菌群落组成与高寒草原等其他生态系统具有较大的相似性。但本试验结果与赵垦田等[7]的研究差异较大,说明采用分子生物学手段与可培养手段能够对微生物群落结构的研究结果造成较大差异[19-24],不同的植被环境类型也会影响土壤微生物群落的组成。2.2 土壤样品中真菌OTUs结果分析



2.3 不同采样点土壤样品真菌区系差异分析

2.4 不同采样时期土壤样品真菌区系差异分析


3 结论与讨论
