双液原电池在实验探究中的应用
2019-04-22张青杨胡晓红
张青杨 胡晓红
摘要:使用双液原电池装置将氧化反应和还原反应区域分开,可以排除外在因素或体系中的其它微粒给氧化还原反应实验探究造成干扰的问题,有效发展学生“证据推理”的核心素养。
关键词:双液原电池;实验探究;证据推理;核心素养
文章编号:1008-0546(2019)02-0088-02 中图分类号:G633.8 文献标识码:B
《普通高中化学课程标准(2017版)》凝练了“化学学科核心素养”,提出了学业质量要求,引导中学课堂教学从“知识教学”到“能力教学”再到“素养教学”的转变。近年高考的化学实验正在由“教材实验的复现与改进”转向对“化学原理的探究与创新”的考查,旨在通过实验探究论证的过程培养学生逻辑思维、批判思维和创新思维。
电化学是重要的化学基础知识和科学研究的常用手段,在原电池、电解池装置中连接电流计或电压表能够把氧化还原反应的电子转移可视化、定量化,使得我们能够将宏观的实验现象和微观的反应历程进行关联,从而为化学原理证实和证伪提供证据支持。而双液原电池是高中化学《选修4》教材中出现的一种研究氧化还原反应原理及能量变化的实验装置,该装置的优点在于将氧化反应和还原反应分开进行,能够帮助我们更加细致地研究氧化还原反应及其影响机理。
一、探究外界条件对物质氧化性或还原性的影响
物质的氧化性、还原性的强弱会受浓度、温度、酸碱性等外界因素的影响,但不同条件的改变对氧化性、还原性都产生影响还是只对其中一项产生影响?是对氧化性影响大还是对还原性影响大?为完成这些化学规律、原理的探究,我们可以借助双液原电池装置,通过改变所加物质的聚集状态(固体形状及颗粒大小)、温度、浓度、pH等条件之中的单个条件,通过电表示数的变化即可验证氧化还原反应中具体条件对物质氧化性(或还原性)的影响情况。
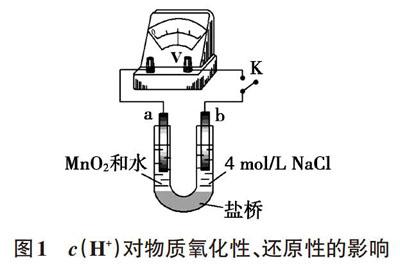
例如,为研究c(H+)对Cl-的还原性、MnO2的氧化性哪个影响程度更大,我们可以组装双液原电池装置(如图1),待电压表指针稳定后分别向左侧和右侧滴加几滴硫酸,从电压表示数变化的大小可以证明c(H+)对MnO2的氧化性影响更为显著。
二、排除氧化剂与氧化产物(或还原剂与还原产物)的相互干扰
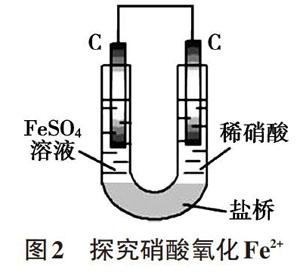
在水溶液中,由于水解、电离及反应过程中的产物等原因造成微粒种类较多,微粒相互间的反应可能比较复杂,常常出现异常现象,对反应原理的研究造成干扰。双液原电池装置可以将氧化剂、还原剂及其相关产物隔离开来,是排除干扰因素很好的方法。例如,研究0.1mol/L FeSO4溶液与8mol/L稀硝酸的反应时会观察到溶液变为棕色,原因是Fe2+与还原产物NO发生反应Fe2++NOFe(NO)2+(棕色),放置一段时间后,待NO逸出后溶液才变为黄色。如果利用双液原电池(如图2),可以将还原剂(Fe2+)与还原产物(NO)隔离开来,生成的NO与Fe2+不能接触,溶液就不会出现棕色,可以直接观察到U型管左侧溶液变黄的理想现象。
三、解决溶液中多种反应竞争问题
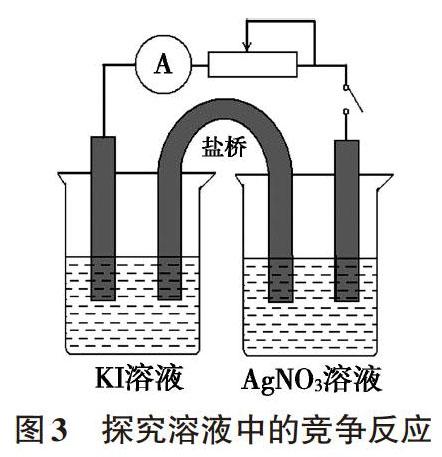
在水溶液中,离子之间可能存在复分解反应、氧化还原反应、络合反应等多种可能性,实际反应以哪种方式进行与离子浓度、氧化还原性强弱、配位的难易程度等多种因素有关。比如查阅标准电极电势可知φ(Ag+/Ag)=+0.7996V、φ(I2/I-)=+0.5350V,理论上溶液中浓度为1.0mol/L的Ag+能够将1.0mol/L的I-氧化。但若将1.0mol/L的AgNO3和KI两溶液混合,实际上Ag+与I-会发生复分解反应生成AgI沉淀,即使使用淀粉指示剂也难以检出I2生成。欲验证Ag+与I-能否发生氧化还原反应,我们可以使用双液原电池装置(如图3)进行验证,有效避免Ag+与I-生成沉淀而不妨碍验证氧化还原反应的发生[1]。
四、对氧化还原反应进行定量化探究
铁、铝在浓硝酸中的钝化是中学化学的重要知识,但金属钝化所需的硝酸浓度教材中并未做出具体说明。如果想探究这个问题,可以调节双液原电池装置(如图4)中定量加入硝酸和水的体积来调控硝酸的浓度,根据电流计指針“先偏转再反向偏转”的现象来判断反应情况,从而较为精确地测定硝酸使铝钝化的最低浓度[2]。
双液原电池在研究氧化还原反应中具有科学性和可操作性,在排除干扰、控制变量、对比分析、定量显示等方面都有良好表现。使用双液原电池装置进行实验探究,不仅是很好的教学辅助方法,同时也是激发学生探究兴趣、提升学生获取证据能力、培育学科核心素养的有效策略。
参考文献
[1]金剑锋.基于热力学和电化学原理厘清反应的竞争问题[J].化学教学,2017(12):81-83
[2]诸佳丹,丁伟.原电池法探究金属铭在浓硝酸中的钝化行为[J].北学教学,2017(9):59-62
