组蛋白H3K27me3对骨骼肌发育调控研究进展
2019-04-22甘炎民周健全绒洪林君李紫聪郑恩琴刘德武吴珍芳蔡更元顾婷
甘炎民,周健,全绒,洪林君,李紫聪,郑恩琴,刘德武,吴珍芳,2,蔡更元,2,顾婷
组蛋白H3K27me3对骨骼肌发育调控研究进展
甘炎民1,周健1,全绒1,洪林君1,李紫聪1,郑恩琴1,刘德武1,吴珍芳1,2,蔡更元1,2,顾婷1
1. 华南农业大学动物科学学院,国家生猪种业工程技术研究中心,广州 510642 2. 广东温氏食品集团股份有限公司,新兴 527439
组蛋白甲基化是发生在核小体核心组蛋白各亚基N-端肽链的一种修饰方式。在组成核小体的4种亚基中,H3亚基N-端肽链第4、9、27、36和79等位点的赖氨酸为甲基化热点,甲基化类型包括一、二、三甲基化(mono-, di-, tri-methylation)。H3K27me3是发生在组蛋白H3亚基第27位赖氨酸的三甲基化,主要发挥转录抑制的作用,参与骨骼肌的发育调控。研究表明,H3K27me3能够与骨骼肌增殖和分化的关键转录因子(如MyoD和MyoG等)及细胞周期蛋白特异性结合,并与其他表观遗传调控因子lncRNA及miRNA等互作,对骨骼肌的增殖和分化时间以及程度进行精细调控。本文系统介绍了组蛋白甲基化的类型以及H3K27甲基化和去甲基化的生物学过程,总结了目前已报道的H3K27me3在骨骼肌成肌细胞增殖和分化过程中发挥的作用,以期辅助科研工作者了解H3K27me3在骨骼肌发育过程中的作用,以及为进一步提高哺乳动物肌肉品质提供参考。
组蛋白;甲基化;骨骼肌;H3K27me3
在自然界中,哺乳动物的个体生长、肌肉质量与骨骼肌的生长发育相关。骨骼肌由束状肌纤维组成,是动物个体中体积最大、质量占比最高的组织,对运动系统、姿势行为、支撑作用至关重要。骨骼肌的生长发育受经典遗传和表观遗传学的共同精细调控,其中骨骼肌成肌细胞的增殖、分化及肌管融合和肌纤维体积增大是研究骨骼肌发育的核心问题。近年来组蛋白甲基化修饰成为表观遗传学领域的研究热点,能通过改变核小体结构/细胞周期蛋白基因表达以及增殖和分化相关关键蛋白的表达,与其他表观因子互作等途径参与骨骼肌发育。其中,组蛋白H3亚基第27位赖氨酸三甲基化(histone H3 lysine 27 tri-methylation, H3K27me3)是抑制性组蛋白修饰,在骨骼肌发育过程中扮演着重要角色。结合近年来与骨骼肌发育相关的H3K27三甲基化的研究进展,本文主要对组蛋白结构和甲基化修饰类型、H3K27位点的甲基化和去甲基化的调控机制及其调控骨骼肌发育的过程进行了综述,以期为科研工作者了解H3K27三甲基化对骨骼肌发育过程的调控提供帮助及进一步解析骨骼肌发育机制提供借鉴和参考。
1 组蛋白结构和甲基化修饰类型
在真核生物细胞核中,DNA链缠绕在核心组蛋白外,形成染色质的基本单位—核小体。由于组蛋白富含精氨酸和赖氨酸,带有正电荷,因此能与带有负电荷的DNA密切结合。组蛋白主要由H1、H2A、H2B、H3和H4 等5种类型蛋白质亚基组成,而其中的4种组蛋白亚基—H2A、H2B、H3和H4由一球形结构域及暴露在核小体表面的N端尾区组成,每个亚基各两拷贝组成八聚体(histone octamer),形成核小体基本结构中的核心组蛋白。两个核小体由组蛋白H1亚基与连接DNA (linker DNA)串联起来,彼此靠拢、紧密相连[1]。
核心组蛋白氨基酸链两端分别为C末端和N末端:N末端富含碱性氨基酸,如精氨酸和赖氨酸;C末端富含疏水氨基酸,如异亮氨酸和缬氨酸。C端氨基酸由于其疏水性质聚集在组蛋白中心,N端碱性氨基酸暴露在八聚体外周,形成“组蛋白的尾巴”,这些暴露的碱基容易被不同的基团修饰。1964年,Murray[2]在鼠伤寒沙门菌()鞭毛蛋白中发现了N-甲基化赖氨酸,这是最早发现的组蛋白甲基化修饰。组蛋白甲基化是指蛋白侧链氨基酸在各甲基化酶的催化下,以S-腺苷甲硫氨酸(S-adenosyl methionine, SAM)作为甲基供体,获得不同数目甲基的一种翻译后修饰(post-translational modification, PTM)[3]。目前为止,已经发现了多种特异性组蛋白甲基化酶,其中不同的赖氨酸甲基转移酶(histone lysine methyltransferases, HKMTs)能将赖氨酸残基分别进行单甲基化(mono-/ -me1)、双甲基化(di-/ -me2)以及三甲基化(tri-/ -me3)修饰,而精氨酸甲基转移酶(protein arginine methyltransferase, PRMT)催化精氨酸残基,对其进行单甲基化或者双甲基化修饰[1,4]。
组蛋白H3是发生修饰最多的亚基,其第4、9、27、36和79位赖氨酸残基是甲基化修饰的热点[5],对基因表达起着重要的调控作用。一般来说,组蛋白H3不同位点的赖氨酸甲基化修饰能够调节染色质结构,使染色质处于疏松或紧密状态,从而对基因转录活性进行调控[6];此外,组蛋白H3不同位点赖氨酸的甲基化与其他类型的修饰方式相互作用,如H3K4me1和H3K27ac,分别对基因启动子和增强子的活性调节发挥关键的调控作用[7,8]。
2 H3K27动态修饰过程及其作用机制
H3K27修饰是一个动态的过程,包括主动甲基化和被动去甲基化。在主动甲基化过程中,H3K27由基因增强子同源物2 (Zeste gene enhancer homolog2, EZH2)识别,并将甲基基团(-CH3)转移到组蛋白H3的27位赖氨酸残基上[9]。因此,EZH2的表达与H3K27me3水平成正比。此外,EZH2是组成多梳蛋白抑制复合物2 (polycomb repressive complex2, PRC2)的3个核心亚基之一,而PRC2是动植物机体中两大重要的多梳蛋白抑制复合物之一,其组成成分较PRC1更为保守,由EZH1/EZH2、基因抑制因子(suppressor of zeste12, Suz12)以及胚胎外胚层发育因子(embryonic ectoderm development, EED)组成。而H3K27me3去甲基化由其去甲基化酶—赖氨酸特异性脱甲基酶6B (lysine- specific demethylase 6B, Kdm6B/JMJD3)和赖氨酸特异性脱甲基酶6A (lysine-specificdemethylase 6A, Kdm6A/UTX)催化,两者皆为含有Jumonji C(JmjC)结构域的双加氧酶。H3K27me3被去甲基化后能解除转录抑制活性,启动靶基因表达[10]。研究表明,UTX作为H3K27特异性去甲基转移酶,不仅能够使H3K27me2去除二甲基化,还能使H3K27me3去除三甲基化[11]。Karl等[12]在小鼠胚胎细胞中抑制H3K27去甲基化酶UTX和JMJD3的表达后,发现基因启动子区H3K27me3的表达水平升高。
H3K27me3修饰是组蛋白H3亚基最稳定的表观修饰标记之一,对基因转录、DNA复制和修复具有调控作用,参与干细胞分化、肌肉分化和发育等生命活动[13]。H3K27me3修饰位点主要位于基因启动子和转录起始位点附近,是抑制性组蛋白修饰,参与基因表达、胚胎发育和细胞分化等过程[14,15]。H3K27me3通过3种方式抑制基因的表达:(1) EZH2催化组蛋白H3K27三甲基化(形成H3K27me3),被组成PRC1的色素框-结构域蛋白(chromobox- domain protein, CBX)亚基识别并进一步募集PRC1复合物,其RING1亚基将组蛋白H2A亚基第119位赖氨酸单泛素化(H2AK119ub1),使染色质结构更加致密,基因转录起始位点无法与转录酶RNA Pol Ⅱ结合(图1A)[10,16,17],这是目前发现的H3K27me3最经典的调控方式;(2) H3K27me3募集其他抑制性调控因子,如DNA甲基化转移酶(DNA methyltransferase, DNMT),使与之结合的DNA序列甲基化(图1B);(3) H3K27me3在受精卵中特异结合于印记基因的母源等位基因,以不依赖DNA-甲基化的形式对不同亲本来源的等位基因(主要为母本来源)进行印记(imprinting) (图1C)[18]。
3 H3K27me3与骨骼肌发育
3.1 H3K27me3及其修饰酶对成肌细胞增殖的调控
肌肉质量通常由肌纤维的数目和横截面积决定,肌纤维数目的增加表现为肌肉增生,肌纤维横截面积的增加表现为肌肉肥大[19]。肌纤维数目的增加依赖于肌细胞的增殖,而细胞能否维持增殖状态受细胞周期蛋白和转录调控因子的共同作用。研究表明,细胞周期蛋白(如细胞周期蛋白激酶Cdk6)需要维持在较高的表达水平,以及生肌调节因子(myogenic regulatory factors, MRFs),如MyoG、MyoD、Myf5和Myf6需要维持在较低的表达水平才能保证骨骼肌细胞处于增殖状态[19]。肌细胞生成素(Myogenin, MyoG)是含螺旋-环-螺旋结构的转录因子,在成肌分化中发挥关键作用。H3K27me3能直接抑制基因的表达,促进骨骼肌细胞的增殖。Asp等[20]发现成肌细胞系C2C12分化前基因组中总体的H3K27me3修饰水平显著高于分化后,特异性抑制基因的表达,维持成肌细胞增殖状态。这与小鼠胚胎肌肉发育的过程一致。在小鼠早期胚胎(d9.5)的肌节中,H3K27me3的甲基化酶EZH2及H3K27me3表达较高,抑制MyoG的表达,同时成肌分化因子MHCⅡb的启动子和MCK的增强子等调控区域也被EZH2和转录因子YY1识别,形成H3K27me3修饰,然后进一步募集组蛋白去乙酰化酶HDAC1,促进成肌细胞增殖[21]。H3K27me3修饰同样促进家畜骨骼肌的增殖。Byrne等[22]发现在出生前后的绵羊骨骼肌基因组中H3K27me3修饰大量存在于启动子中,抑制基因的转录活性。肌骨素(myostatin,)基因能抑制骨骼肌增殖,抑制的表达能提高家畜的肌肉量。研究表明,在原代分离的绵羊成肌细胞中敲除可上调H3K27me3的甲基化酶EZH2的表达,促进肌细胞增殖[23]。

图1 H3K27me3抑制基因表达的作用机制
A:H3K27me3募集PRC1复合物抑制转录;B:H3K27me3促进DNA序列甲基化;C:H3K27me3对等位基因进行 印记。
H3K27me3除了可直接靶向调节成肌分化因子及细胞周期蛋白的表达外,还可与长链非编码RNA (lncRNA)互作,调控骨骼肌细胞的增殖。lncRNA是近年来新发现的一类非编码RNA,能通过与H3K27me3的互作对骨骼肌增殖分化发挥重要的调控作用。Jin等[24]发现lncRNA SYISL能通过募集H3K27me3甲基化酶EZH2,进行H3K27me3修饰,进而抑制细胞周期蛋白激酶Cdk6的抑制因子基因的表达及激活靶基因的表达,促进成肌细胞增殖,提高肌纤维数、肌肉密度和肌肉质量(图2)。Andresini等[25]发现lncRNA Kcnq1ot1在骨骼肌细胞C2.7中通过促进细胞周期抑制因子基因上结合位点处H3K27me3的累积量,阻碍转录因子MyoD的结合,从而抑制细胞周期抑制因子p57的表达,促进骨骼肌增殖。
骨骼肌卫星细胞是一类特殊的具有干细胞性质的肌细胞,在肌肉损伤修复等过程中发挥重要作用。H3K27me3对于骨骼肌卫星细胞的发育同样是必不可缺。研究表明,EZH2是维持骨骼肌卫星细胞标记基因表达的重要调控因子。在小鼠卫星细胞中将在骨骼肌中特异性敲除后,小鼠的肌肉量显著下降,卫星细胞增殖受抑制,且肌肉的损伤修复功能发生缺陷[26],说明卫星细胞中基因组H3K27me3水平的下调影响其增殖。该结果得到了其他研究的证实。Woodhouse等[27]同样制备骨骼肌卫星细胞特异敲除小鼠,发现小鼠肌肉量下降,肌纤维横截面积下降,且存活率显著下降,仅54%的条件敲除小鼠存活到50日龄,但静息状态的卫星细胞数目未发生变化,推断H3K27me3水平的降低对维持骨骼肌自身数目无影响,但抑制卫星细胞的生长增殖。
H3K27me3及其甲基化酶EZH2对其他类型的肌细胞增殖的作用与骨骼肌细胞不完全一致。在横纹肌肉瘤细胞中用siRNA敲低的表达,细胞周期抑制因子的表达上调,抑制横纹肌肉瘤细胞的增殖[28]。而Yu等[29]发现,在小鼠鼻滴灰尘诱导哮喘模型中加入H3K27me3去甲基化酶抑制剂GSK-J4,即维持H3K27me3水平能显著抑制气管平滑肌的增殖和迁移以及炎症反应,从而抑制哮喘的发生。LncRNA TINCR能将EZH2募集到靶基因启动子区,提高H3K27me3水平从而抑制的转录,抑制心肌细胞增殖和肥大[30]。此外,Akerberg等[31]构建了缺失H3K27me3去甲基化酶JMJD3和UTX的斑马鱼(),与野生型斑马鱼的心脏组织对比,发现共表达JMJD3和UTX能显著降低H3K27me3表达量,并促进心肌细胞的增殖。
以上研究表明,H3K27me3主要促进成肌细胞和骨骼肌卫星细胞的增殖,但具有细胞类型特异性。
3.2 H3K27me3及其修饰酶对成肌细胞分化的调控
H3K27me3及其修饰酶不仅促进骨骼肌细胞的增殖,还对成肌细胞分化起重要调控作用。Adrian等[32]通过全基因组定位分析,发现在人的胚胎成纤维细胞中H3K27me3能与多种诱导细胞特异分化的基因,包括各种成肌调节因子和肌酸激酶(creatine kinase, CKM)等的调控区域结合,H3K27me3被去甲基化使骨骼肌成肌分化因子去抑制,从而诱导骨骼肌分化。骨骼肌中H3K27me3的去甲基化对启动骨骼肌分化过程至关重要。骨骼肌中H3K27me3的去甲基化的过程分为两步:在肌肉分化早期,反式激活蛋白Six4募集去甲基化酶UTX到骨骼肌分化相关基因的启动子和编码区部分区域,使转录起始位点附近区域发生H3K27me3去甲基化;转录复合物RNA Pol Ⅱ与成肌分化因子结合并向下游延伸,辅助UTX将基因编码区下游的H3K27me3标记去除[33]。
肌肉的分化过程主要由生肌调节因子调控,大量研究表明这些生肌调节因子与EZH2的表达趋势相反。在小鼠肌肉分化过程中,EZH2显著下调表达,促进肌细胞分化[21]。同样,在山羊骨骼肌卫星细胞的分化过程中,EZH2的表达量在分化过程中显著下调[34]。此外,Asp等[20]发现H3K27me3的下调是控制基因表达和触动成肌细胞分化的开关。而在C2C12和骨骼肌卫星细胞中过表达基因,从而提高H3K27me3的水平能抑制这两种肌细胞的分化[21]。
H3K27me3除了可直接调控成肌细胞的分化过程外,也能与lncRNA及siRNA互作,进而调控成肌细胞的分化。最近研究发现,敲除lcnRNA SYISL能显著降低成肌分化因子、以及启动子上H3K27me3的水平,促进成肌细胞分化[24]。而SYISL含有多个潜在的miRNA结合位点,如miR-1、miR-125、miR-214、miR-133和miR-124位点,它们参与调节成肌分化[35]。此外,在横纹肌肉瘤细胞中用siRNA敲低的表达,即降低H3K27me3的水平,能上调/的 表达,促进横纹肌肉瘤细胞的分化[35]。同样,H3K27me3在虹鳟鱼()发育过程中下调表达,促进的同源基因和在发育4~8天分化过程中上调表达,促进其肌肉分化[36]。在C2C12细胞中敲除H3K27me3去甲基化酶UTX,即提高H3K27me3的水平能抑制骨骼肌分化[33]。实际上在分化中的成肌细胞,UTX会被招募到和基因的转录调节区域,使H3K27me3下调,进一步促进成肌细胞的分化。此外,组蛋白伴侣Spt6可促进UTX在染色质上富集并降低调节区域的H3K27me3水平[37]。
MicroRNA (miRNA)能通过影响H3K27me3的修饰水平从而调控骨骼肌分化。研究表明,miR-214在骨骼肌分化中发挥重要作用。在成肌细胞中,miR-214前体所在的内含子上募集了大量PRC2复合物,使H3K27me3高表达,miR-214转录受到抑制,抑制细胞分化;在成肌细胞分化时,EZH2的表达量下调,miRNA调控区域的H3K27me3结合量降低,使和能与miR-214转录前体调控区域结合,促进miR-214表达,而miR-214又能与EZH2的3′非翻译区结合,负调控EZH2的表达,进一步促进分化的进行[38]。类似的调控模式在横纹肌肉瘤细胞中也有报道。EZH2和H3K27me3能与miR-101的转录前体序列miR-101-2结合,抑制其表达,同时miR-101也能负调控EZH2的表达[39]。此外,有研究表明miR-26a也能通过靶向EZH2基因,促进C2C12的分化[40]。
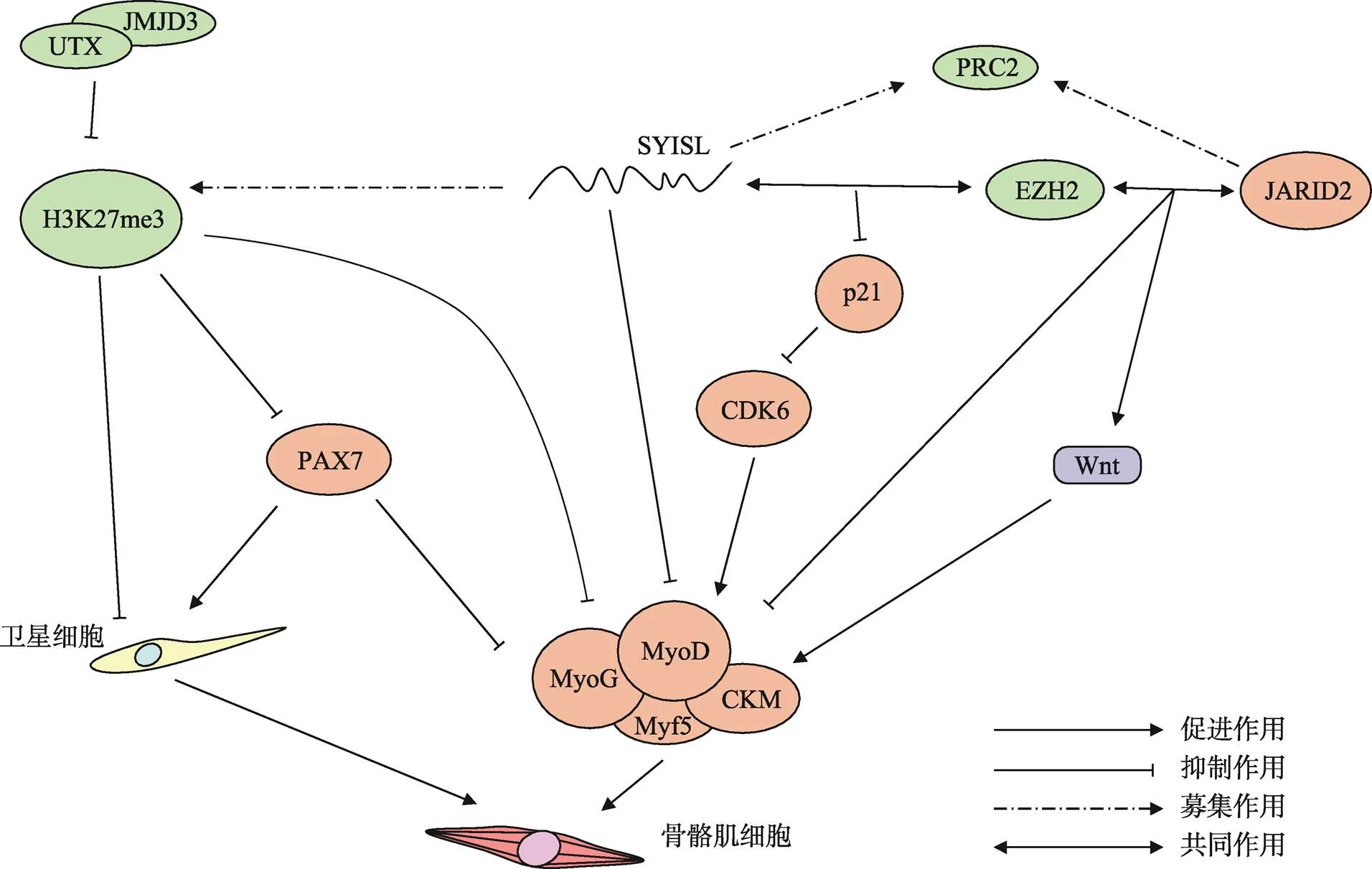
图2 H3K27me3参与调控成肌细胞增殖和分化的过程
H3K27me3通过抑制Pax7和生肌调节因子的表达从而调节骨骼肌的增殖和分化;在卫星细胞的增殖和分化过程中,H3K27me3会促进卫星细胞的增殖但抑制卫星细胞的分化。H3K27me3的甲基化酶EZH2能分别与JARID2和lncRNA SYISL作用,调控生肌调节因子的表达。
虽然上述研究表明H3K27me3的下调是促进骨骼肌分化的,但也有研究表明H3K27me3在某些基因上的修饰可能通过信号通路的级联反应抑制肌肉细胞的分化。JARID2是jumonji蛋白家族中起抑制性作用的主要成员,为PRC2复合体中非催化亚基[41]。2018年,Adhikari和Davie[42]发现JARID能通过抑制Wnt通路的拮抗剂Sfrp1从而激活Wnt通路,Wnt通路的非经典途径被激活,即Wnt蛋白与细胞膜FZD受体(frizzled)结合,β-连环蛋白(β-catenin)降解复合体分解,释放β-catenin进入细胞核,与成肌细胞分化因子和的调控区结合,促进其表达,从而促进骨骼肌分化。这说明H3K27me3也可能促进骨骼肌分化,与前人的报道结果相反。
综上所述,H3K27me3通过以下几个方面对骨骼肌发育过程进行调控:(1) H3K27me3及其甲基化酶EZH2能够直接特异性结合细胞周期蛋白及成肌分化相关基因,如、、等因子,从而促进成肌细胞增殖抑制肌肉的分化,而当H3K27me3受到去甲基化酶UTX、JMJD3作用,发生去甲基化,则促进其分化;(2) H3K27me3与lncRNA及miRNA等互作,调控肌肉发育;(3) H3K27me3能调控骨骼肌发育重要的信号通路,如Wnt信号通路,以启动骨骼肌分化过程(图2)。
4 结语与展望
哺乳动物骨骼肌发育是一个非常复杂的过程,受经典遗传和表观遗传共同调控。H3K27me3作为组蛋白甲基化修饰类型的重要一员,其本身能特异性结合成肌分化相关基因,起到调节骨骼肌增殖分化过程的作用。H3K27me3还参与调控骨骼肌发育信号通路,并能与lncRNA及miRNA等互作,以调控骨骼肌发育。目前已有大量研究表明H3K27me3在骨骼肌发育过程中发挥了重要的调控作用,但其对骨骼肌发育机制的具体调控过程尚不清楚。因此,本文主要概述了H3K27me3及其修饰酶对骨骼肌成肌细胞增殖分化的调控。然而,H3K27me3在骨骼肌发育过程的分子调控机制尚无进一步研究,其与骨骼肌发育的更深层次关联也有待阐明。H3K27me3对骨骼肌的调控为人们对于骨骼肌发育的认识提供一个新角度,为更深入了解和阐明骨骼肌分化和生长发育过程提供新的研究方向。随着对H3K27me3调控骨骼肌发育机制的深入研究,将为促进骨骼肌生长发育提供理论基础,不仅可以提高个体生长水平及运动能力,也可应用于畜禽生产中提高肌肉质量及肌肉产量以产生更多经济效益。因此,深入研究H3K27me3对骨骼肌发育的调控机制有着重要的价值和意义,为哺乳动物促进个体生长、提高肌肉质量及肌肉损伤后修复提供解决方案。
[1] Jiang ZW, Liu XG, Zhou ZJ. The regulation of histone modifications., 2009, 36(10): 1252–1259.蒋智文, 刘新光, 周中军. 组蛋白修饰调节机制的研究进展. 生物化学与生物物理进展, 2009, 36(10): 1252– 1259.
[2] Murray K. The occurrence of Epsilon-N-methyl lysine in histones.,1964, 3(1): 10–15.
[3] Kim S, Paik WK. Studies on the origin of epsilon-N- methyl-L-lysine in protein., 1965, 240(12): 4629–4634.
[4] Martin C, Zhang Y. The diverse functions of histone lysine methylation.,2005, 6(11): 838–849.
[5] Song BY, Zhu WG. Advances in effector protein of histone methylation.,2011, 33(4): 285–292.宋博研, 朱卫国. 组蛋白甲基化修饰效应分子的研究进展. 遗传, 2011, 33(4): 285–292.
[6] Chang CP, Bruneau BG. Epigenetics and cardiovascular development.,2012, 74: 41–68.
[7] Creyghton MP, Cheng AW, Welstead GG, Kooistra T, Carey BW, Steine EJ, Hanna J, Lodato MA, Frampton GM, Sharp PA, Boyer LA, Young RA, Jaenisch R. Histone H3K27ac separates active from poised enhancers and predicts developmental state., 2010, 107(50): 21931–21936.
[8] Heintzman ND, Hon GC, Hawkins RD, Kheradpour P, Stark A, Harp LF, Ye Z, Lee LK, Stuart RK, Ching CW, Ching KA, Antosiewicz-Bourget JE, Liu H, Zhang X, Green RD, Lobanenkov VV, Stewart R, Thomson JA, Crawford GE, Kellis M, Ren B. Histone modifications at human enhancers reflect global cell-type-specific gene expression., 2009, 459(7243): 108–112.
[9] Vieux-Rochas M, Fabre PJ, Leleu M, Duboule D, Noordermeer D. Clustering of mammalian Hox genes with other H3K27me3 targets within an active nuclear domain., 2015, 112(15): 4672–4677.
[10] Agger K, Cloos PA, Christensen J, Pasini D, Rose S, Rappsilber J, Issaeva I, Canaani E, Salcini AE, Helin K. UTX and JMJD3 are histone H3K27 demethylases involved in HOX gene regulation and development., 2007, 449(7163): 731–734.
[11] Hong S, Cho YW, Yu LR, Yu H, Veenstra TD, Ge K. Identification of JmjC domain-containing UTX and JMJD3 as histone H3 lysine 27 demethylases., 2007, 104(47): 18439–18444.
[12] Shpargel KB, Starmer J, Yee D, Pohlers M, Magnuson T. KDM6 demethylase independent loss of histone H3 lysine 27 trimethylation during early embryonic development., 2014, 10(8): e1004507.
[13] Vermeulen M, Eberl HC, Matarese F, Marks H, Denissov S, Butter F, Lee KK, Olsen JV, Hyman AA, Stunnenberg HG, Mann M. Quantitative interaction proteomics and genome-wide profiling of epigenetic histone marks and their readers., 2010, 142(6): 967–980.
[14] Simon JA, Kingston RE. Mechanisms of polycomb gene silencing: knowns and unknowns., 2009, 10(10): 697–708.
[15] Schuettengruber B, Chourrout D, Vervoort M, Leblanc B, Cavalli G. Genome regulation by polycomb and trithorax proteins., 2007, 128(4): 735–745.
[16] Marchesi I, Bagella LM. Role of enhancer of zeste homolog 2 polycomb protein and its significance in tumor progression and cell differentiation. In: Radzioch D. Chromatin Remodeling. In tech, 2013, 119–152.
[17] Dhar SS, Lee S, Chen K, Zhu G, Oh W, Allton K, Gafni O, Kim YZ, Tomoiga AS, Barton MC, Hanna JH, Wang Z, Li W, Lee MG. An essential role for UTX in resolution and activation of bivalent promoters., 2016, 44(8): 3659–3674.
[18] Inoue A, Jiang L, Lu F, Suzuki T, Zhang Y. Maternal H3K27me3 controls DNA methylation-independent imprinting., 2017, 547(7664): 419–424.
[19] Braun T, Gautel M. Transcriptional mechanisms regulating skeletal muscle differentiation, growth and homeostasis.,2011, 12(6): 349–361.
[20] Asp P, Blum R, Vethantham V, Parisi F, Micsinai M, Cheng J, Bowman C, Kluger Y, Dynlacht B D. Genome-wide remodeling of the epigenetic landscape during myogenic differentiation., 2011, 108(22): E149–E158.
[21] Caretti G, Di Padova M, Micales B, Lyons GE, Sartorelli V. The Polycomb Ezh2 methyltransferase regulates muscle gene expression and skeletal muscle differentiation.,2004, 18(21): 2627–2638.
[22] Byrne K, Mcwilliam S, Vuocolo T, Gondro C, Cockett NE, Tellam RL. Genomic architecture of histone 3 lysine 27 trimethylation during late ovine skeletal muscle development., 2014, 45(3): 427–438.
[23] Wei C, Ren H, Xu L, Li L, Liu R, Zhang L, Zhao F, Lu J, Zhang X, Du L. Signals of Ezh2, Src, and Akt Involve in myostatin-Pax7 pathways regulating the myogenic fate determination during the sheep myoblast proliferation and differentiation., 2015, 10(3): e0120956.
[24] Jin JJ, Lv W, Xia P, Xu ZY, Zheng AD, Wang XJ, Wang SS, Zeng R, Luo HM, Li GL, Zuo B. Long noncoding RNA SYISL regulates myogenesis by interacting with polycomb repressive complex 2., 2018, 115(42): E9802–E9811.
[25] Andresini O, Rossi MN, Matteini F, Petrai S, Santini T, Maione R. The long non-coding RNA Kcnq1ot1 controls maternal p57 expression in muscle cells by promoting H3K27me3 accumulation to an intragenic MyoD-binding region., 2019, 12(1): 8.
[26] Juan AH, Derfoul A, Feng X, Ryall JG, Dell'Orso S, Pasut A, Zare H, Simone JM, Rudnicki MA, Sartorelli V. Polycomb EZH2 controls self-renewal and safeguards the transcriptional identity of skeletal muscle stem cells., 2011, 25(8): 789–794.
[27] Woodhouse S, Pugazhendhi D, Brien P, Pell JM. Ezh2 maintains a key phase of muscle satellite cell expansion but does not regulate terminal differentiation., 2012, 126(Pt 2): 565–579.
[28] Ciarapica R, Carcarino E, Adesso L, De Salvo M, Bracaglia G, Leoncini PP, Dall'Agnese A, Verginelli F, Milano GM, Boldrini R, Inserra A, Stifani S, Screpanti I, Marquez VE, Valente S, Mai A, Puri PL, Locatelli F, Palacios D, Rota R. Pharmacological inhibition of EZH2 as a promising differentiation therapy in embryonal RMS., 2014, 14: 139.
[29] Yu Q, Yu X, Zhao W, Zhu M, Wang Z, Zhang J, Huang M, Zeng X. Inhibition of H3K27me3 demethylases attenuates asthma by reversing the shift in airway smooth muscle phenotype., 2018, 48(11): 1439–1452.
[30] Shao M, Chen G, Lv F, Liu Y, Tian H, Tao R, Jiang R, Zhang W, Zhuo C. LncRNA TINCR attenuates cardiac hypertrophy by epigenetically silencing CaMKII., 2017, 8(29): 47565–47573.
[31] Akerberg AA, Henner A, Stewart S, Stankunas K. Histone demethylases Kdm6ba and Kdm6bb redundantly promote cardiomyocyte proliferation during zebrafish heart ventricle maturation., 2017, 426(1): 84–96.
[32] Bracken AP, Dietrich N, Pasini D, Hansen KH, Helin K. Genome-wide mapping of Polycomb target genes unravels their roles in cell fate transitions., 2006, 20(9): 1123–1136.
[33] Seenundun S, Rampalli S, Liu QC, Aziz A, Palii C, Hong S, Blais A, Brand M, Ge K, Dilworth F J. UTX mediates demethylation of H3K27me3 at muscle-specific genes during myogenesis., 2010, 29(8): 1401–1411.
[34] Li JT, Zhao W, Li DD. MiR-101a targeting EZH2 promotes the differentiation of goat skeletal muscle satellite cells., 2017, 39(9): 828–836.李俊涛, 赵薇, 李丹丹. MiR-101a靶向EZH2促进山羊骨骼肌卫星细胞的分化. 遗传, 2017, 39(9): 828–836.
[35] Luo W, Nie Q, Zhang X. MicroRNAs involved in skeletal muscle differentiation., 2013, 40(3): 107–116.
[36] Seiliez I, Froehlich JM, Marandel L, Gabillard J, Biga PR. Evolutionary history and epigenetic regulation of the three paralogous pax7 genes in rainbow trout., 2015, 359(3): 715–727.
[37] Wang AH, Zare H, Mousavi K, Wang C, Moravec CE, Sirotkin HI, Ge K, Gutierrez-Cruz G, Sartorelli V. The histone chaperone Spt6 coordinates histone H3K27 demethylation and myogenesis., 2013, 32(8): 1075–1086.
[38] Juan AH, Kumar RM, Marx JG, Young RA, Sartorelli V. Mir-214-dependent regulation of the polycomb protein Ezh2 in skeletal muscle and embryonic stem cells., 2009, 36(1): 61–74.
[39] Vella S, Pomella S, Leoncini PP, Colletti M, Conti B, Marquez VE, Strillacci A, Roma J, Gallego S, Milano GM, Capogrossi MC, Bertaina A, Ciarapica R, Rota R. MicroRNA-101 is repressed by EZH2 and its restoration inhibits tumorigenic features in embryonal rhabdomyosarcoma., 2015, 7(1): 82–94.
[40] Wong CF, Tellam RL. MicroRNA-26a targets the histone methyltransferase Enhancer of Zeste homolog 2 during myogenesis.2008, 283(15): 9836–9843.
[41] Li G, Margueron R, Ku M, Chambon P, Bernstein BE, Reinberg D. Jarid2 and PRC2, partners in regulating gene expression., 2010, 24(4): 368–380.
[42] Adhikari A, Davie J. JARID2and the PRC2complex regulate skeletal muscle differentiation through regulation of canonical Wnt signaling., 2018, 11(1): 46.
Histone H3K27me3 in the regulation of skeletal muscle development
Yanmin Gan1, Jian Zhou1, Rong Quan1, Linjun Hong1, Zicong Li1, Enqin Zheng1, Dewu Liu1, Zhenfang Wu1,2, Gengyuan Cai1,2,Ting Gu1
Histone methylation is a modification which occurs in the N-terminal peptide chains of the histone nucleosome. The 4th, 9th, 27th, 36th and 79th lysines in N-terminal peptide chain of histone H3 are hot spots for this modification, including mono-, di-, and tri-methylation. H3K27me3 is the tri-methylation modification on histone H3 lysine 27, which mainly functions as a transcriptional repressor regulating skeletal muscle development. Studies have shown that H3K27me3 can finely regulate skeletal muscle proliferation, including the level and duration of skeletal muscle development by specifically binding to myogenic regulatory factors (e.g., MyoD, MyoG, etc.), cell cycling regulators, and epigenetic regulators including lncRNA and miRNA. In this review, we introduce the types and mechanisms of histone methylation and de-methylation of H3K27. We also summarize how H3K27me3 functions in the proliferation and differentiation of skeletal muscle cell. This review will contribute to the comprehension of the function of H3K27me3 in regulating skeletal muscle development and provide reference for further improving our understanding of mammalian muscle.
histone; methylation; skeletal muscle; H3K27me3
2018-09-27;
2019-02-26
国家自然科学基金项目(编号:31802036)和广东省自然科学基金项目(编号:2017A030310001)资助[Supported by the National Natural Science Foundation of China(No.31802036) and the Guangdong Provincial Natural Science Foundation of China (No.2017A030310001)]
甘炎民,硕士研究生,专业方向:动物遗传与繁育。E-mail: 542362882@qq.com
顾婷,博士,讲师,研究方向:动物遗传与繁育。E-mail: tinggu@scau.edu.cn蔡更元,博士,研究员,研究方向:动物遗传与繁育。E-mail: cgy0415@163.com
10.16288/j.yczz.18-272
2019/3/6 10:19:23
URI: http://kns.cnki.net/kcms/detail/11.1913.R.20190306.1018.002.html
(责任编委: 李明洲)
