三种一致性分析法在糖化血红蛋白测定系统临床评价中的应用
2019-04-22张剑波汪智英
张剑波,房 俊,汪智英,曹 玫,何 煦,陈 杰
(四川省医学科学院·四川省人民医院中心实验室,四川 成都 610072)
糖化血红蛋白(HbA1c)作为糖尿病的首选诊断标准,又是糖尿病筛查以及血糖控制的“金标准”,其测定结果具有溯源性和可比性非常重要[1]。经过近十多年的不断改进,离子交换-高效液相色谱法(HPLC法)检测HbA1c达到了临床应用要求的精密度和稳定性。因此,美国和日本等国家将其作为HbA1c标准参考系统的参考方法[2]。国内HbA1c检测设备市场几乎被进口品牌占据,介于进口仪器和试剂成本较高,因而采用国产设备具有较低的成本优势。按照临床实验室质量管理要求,实验室如要采用国产仪器和试剂替代进口必须确保两种系统测定结果的一致性[3]。2018年1月6~19日我科同时对某国产和进口HbA1c检测系统的110例测定结果进行回归分析、Kappa检验和Bland-Altman分析法的一致性评估,现报道如下。
1 资料与方法
1.1一般资料本研究所用110例EDTA抗凝全血,采集于四川省人民医院的门诊、住院以及体检中心的110例受试者。其中男53例,女57例,年龄(44.7±18.5)岁。试验样本的HbA1c线性区间和数量要求见表1。本研究的试验设计通过四川省人民医院药物(器械)临床试验伦理委员会审核。

表1 HbA1c检测系统比对试验样本的线性区间和数量要求
1.2测试系统及试剂盒美国Bio-Rad公司生产的D-10型HPLC法血红蛋白测定系统及配套试剂、校准品、质控品;国内某公司最新研发的TH3600型HPLC法糖化血红蛋白分析仪及配套试剂、校准品、质控品(注:因该产品尚处于临床研究和注册申报阶段,暂不能标明品牌和生产商)。两套测试系统检测前均用相应校准品校准,以确保结果的准确性。每天比对试验时必须测定各自的配套质控品,只有室内质控结果在可接受范围内(CV<3%)时测定数据才可被接受。
1.3方法本次试验采用对比法,即采用进口的D-10型血红蛋白测试系统及配套试剂盒作为参考标准(以下简称“比对试剂系统”),对国产的TH3600型糖化血红蛋白分析仪及测定试剂盒(以下简称“评价试剂系统”),以同一样本组分别在比对试剂系统和评价试剂系统上检测,进行同步比较一致性的临床研究。
1.4统计学方法采用EXCEL 2007进行线性回归分析,得到回归方程Y=aX+b和相关系数R2,R2>0.95说明有线性相关;采用MATLAB 2013软件进行Kappa检验和Bland-Altman分析,Kappa值分级:0.0~0.20极低的一致性、0.21~0.40一般的一致性、0.41~0.60 中等的一致性、0.61~0.80高度的一致性、0.81~1几乎完全一致[4];Bland-Altman分析计算两组结果差值的95%一致性界限,一致性界限外最大差值和最大相对误差的临床可接受判别标准参照2018年度NGSP官方对CAP室间质评的认证标准,即允许偏倚在±6.0%靶值之间[5]。
2 结果
2.1数据预处理参照美国临床和实验室标准协会EP9-A3文件[6],计算比对试剂系统和评价试剂系统测定同一样本结果间的差值绝对值的平均数。如果差值超出该平均数的4倍时,则判定该样本为离群点。为了避免受少数离群值的过分影响,可将不多于总样本数2.5%的极端样本剔除。通过分析110例样本测定结果,满足结果间差值超出该平均数4倍的样本例数为2例,占样本总数的1.8%,符合试验设计要求。接下来,对剩下的108例测定数据进行一致性分析。
2.2线性回归分析及偏倚评估以评价试剂系统结果为Y轴,比对试剂系统结果为X轴作散点图(图1),得到回归方程Y=0.983X+0.107,R2=0.987,显示两者之间具有明显的线性关系。以回归方程作4个医学决定水平的偏倚分析,分析结果的临床可接受判断标准参照2018年度NGSP官方对CAP室间质评的认证标准,即允许偏倚在±6.0%靶值之间[5]。表2显示,预期偏倚和相对预期偏倚结果均明显小于CAP室间质评允许的误差,表明评价试剂系统能满足临床可接受性。

图1 HbA1c试剂盒比对结果散点图
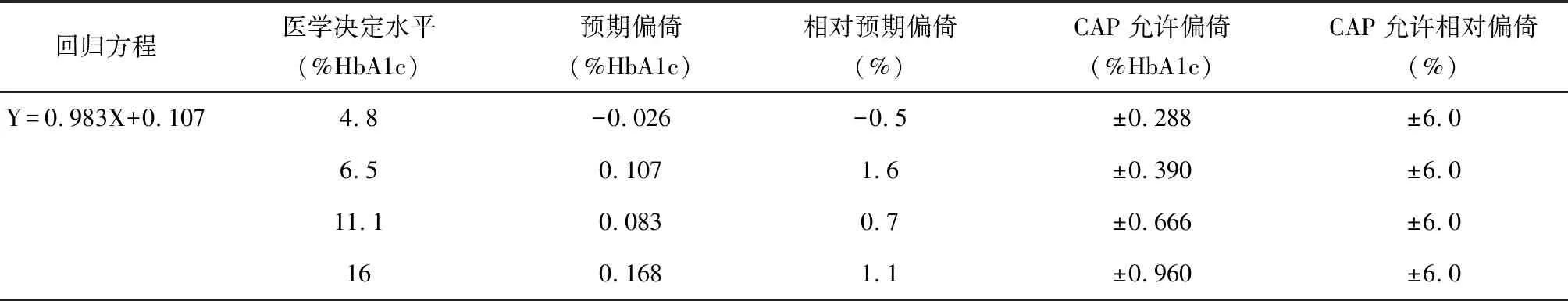
回归方程医学决定水平(%HbA1c)预期偏倚(%HbA1c)相对预期偏倚(%)CAP允许偏倚(%HbA1c)CAP允许相对偏倚(%)Y=0.983X+0.1074.8-0.026-0.5±0.288±6.06.50.1071.6±0.390±6.011.10.0830.7±0.666±6.0160.1681.1±0.960±6.0
2.3Kappa统计量一致性检验将108例EDTA抗凝全血检测结果进行整理,按照Kappa统计量,给出其列联表,计算得到K=0.891,说明两种试剂系统的结果几乎完全一致。见表3。

表3 评价试剂系统和比对试剂系统检测结果列联表


图2 评价试剂与比对试剂系统差值的Bland-Altman分析
3 讨论
据卫生部临床检验中心2018年HbA1c室间质评回报的统计结果(按仪器品牌和方法学)显示:国内采用的测定HbA1c方法有多种,其中使用HPLC法的实验室最多(1284/1784,占比72.0%)。但由于不同方法、不同测定系统,以及不同实验室质量管理能力的差异都会导致各个实验室测定结果的差距很大,更谈不上溯源性和可比性。这也是国内尚未将HbA1c纳入糖尿病诊断指南的根本原因[7]。为实现HbA1c检验结果的可比性,上世纪末美国、日本和瑞典等国家都建立了各自国家的参考方法和参考实验室,并要求对临床实验室和生产厂家每年的比对和认证,极大地提升了这些国家生产的糖化血红蛋白分析系统的质量水平和检测结果的一致性。这也是国内市场几乎被美国和日本品牌产品占据的主要原因之一。2013年卫生部临检中心建立的HbA1c参考方法和一级参考物质于2013年通过CNAS ISO17025/ISO15195医学参考实验室认可,使我国HbA1c标准化建设提升到较高水平,同时也对促进国内临床实验室和生产厂家在HbA1c检验结果一致性方面有着非常重要和积极的意义。
四川省人民医院中心实验室的HbA1c项目在2014~2015年通过美国国家糖化血红蛋白一级实验室认证(NGSP Level-1),且近五年均获得卫生部临床检验中心室间质评和正确度验证合格证书,其结果有很好的溯源性和可比性。能为此项临床研究提供可靠的技术、人力和物力保障。
在医学研究中,常涉及到对两种或两种以上的方法学或分析系统的定量检测结果进行一致性评价。过去常用的统计学方法是进行配对t检验、相关分析和回归分析等。但是,这些方法只评价了两组数据之间的集中程度或者同步变化的趋势与紧密程度,仅反映了一致性评价的某一方面。准确的一致性评价应同时考虑到数据之间的集中趋势、离散趋势以及相关性,只有这三个方面均“一致”,才能说明方法或者分析系统之间的“可互换性”[8]。首先,本研究采用回归分析对结果的线性相关性进行了分析,并通过对医学决定水平的偏倚评估,检验了回归方程的有效性。其次,采用的Kappa一致性检验不仅可用于有序或者无序分类资料的一致性检验,而且还能给出一个具体的值,因而是一个描述一致性较为理想的指标,常用来检验分类变量的一致性或重现性问题[4]。最后,采用的Bland- Altman 分析法是定量分析与定性分析的有机结合。在评价一致性的时候既考虑了随机误差同时也考虑了系统误差对一致性的影响,同时结合专业意义对95%可信区间外的值进行临床可接受性判断[8]。因此,综合上述三种统计学分析方法对评价试剂和比对试剂系统检测结果进行的比较全面的一致性评价分析,我们认为国产的评价试剂系统是临床可接受的,并且与进口的比对系统具备“可互换性”。
中国是一个糖尿病高发的国家,据最近的流行病学调查,在成年人中,糖尿病患者约11.6%(1.14亿),糖尿病前期人群约50.1%(4.93亿)[9]。面对这样一个庞大的HbA1c检测市场,我们欣喜地看到国产检验设备生产厂家正不断研发出具有自主知识产权的糖化血红蛋白分析系统及配套试剂,正在逐步改变过去临床实验室中进口设备一统天下的局面。本次临床研究也显示该国产糖化血红蛋白分析系统及配套试剂与美国Bio-Rad D-10型血红蛋白分析系统的检测结果有着很好的一致性,可作为临床实验室常规使用的选择。但是,需要指出的是在本次历时近一个月的临床试验过程中评价系统曾发生过一次高压阀的运行传感器故障,这可能也是造成2个样本结果为离群值的原因。当前,随着国际标准化组织对HbA1c检测标准化的不断推进,2019年NGSP官方将对厂家和实验室认证的通过标准从±6%提高到±5%[5]。因此,国产厂家在快速发展的同时,也要有“高质量发展”的理念,才能最终与进口品牌分庭抗礼。
