MCM7与RACK1在肺癌中的表达及其临床意义
2019-04-22吴非孙虓栾岚李响韩昱晨
吴非,孙虓,栾岚,李响,韩昱晨
(1沈阳医学院附属中心医院病理科,沈阳 110024;2 中国医科大学基础医学院病理教研室,中国医科大学附属第一临床学院病理科,沈阳 110001; 3沈阳医学院附属中心医院药剂科,沈阳 110024;4上海市胸科医院病理科,上海 200000)
有活性的蛋白激酶C受体1(receptor for activated C kinase1, RACK1),由GNB2L1基因编码,分子量为36kDa。RACK1结构中包含7个WD40重复序列,相关报道提示RACK1的WD40重复序列正是RACK1与众多蛋白相互作用的基础[1]。RACK1主要分布在细胞质和细胞膜中,为多种蛋白质-蛋白质相互作用提供支架,从而涉及多种信号传导途径。RACK1可以调节许多细胞的作用,包括细胞生长、分化、粘附、迁移和免疫[2,3]。微小染色体维持蛋白7(minichromosome maintenance protein 7,MCM7)是微小染色体维持(minichromosome maintenance,MCM)蛋白家族的成员,对维持MCM复合体的螺旋酶活性有重要意义,对于真核细胞中DNA复制和增殖的启动至关重要。本团队前期研究中,使用酵母双杂交筛选鉴定MCM7为RACK1结合蛋白之一。RACK1是MCM7相互作用蛋白。蛋白激酶C激活的特征是由胞质转至胞膜或细胞骨架,这一转位依赖于RACK1蛋白。RACK1缺乏的细胞运动能力减弱。RACK1促进细胞增殖[4]。那么RACK1与MCM7在各类型肺癌组织中如何表达,是否可以应用于临床病理诊断及指导预后,尚需进一步研究证实。本研究应用免疫组化实验检测MCM7与RACK1在各类型肺癌中表达,并探讨二者与肺癌临床病理因素间关系。
材料与方法
1 标本
收集中国医科大学第一附属医院及沈阳医学院附属中心医院病理科2008年1月至2016年12月手术切除的原发灶及相应癌旁正常肺组织石蜡块,包括肺腺癌150例,肺鳞癌150例,肺大细胞癌20例和肺小细胞癌50例。
2 试剂
鼠单克隆抗体 RACK1购自BD公司,鼠单克隆抗体MCM7购自Santa Cruz公司。辣根过氧化物酶标记的山羊抗鼠IgG购自北京中山金桥生物技术有限公司。S-P免疫组化试剂盒(kit-9701)购自福州迈新生物科技开发有限公司。
3 免疫组织化学(S-P)法及判读标准
石蜡切片置于60℃烘箱中烘烤2h,室温冷却后二甲苯脱蜡40min,梯度乙醇水化,蒸馏水冲洗5min×3次,后于pH6.0的柠檬酸盐抗原修复液中高温高压修复2min,PBS冲洗5min×3次,加入3%过氧化氢去除内源性过氧化物酶20min,PBS冲洗5min×3次,非免疫动物血清室温孵育10min(以封闭特异性位点),去血清加一抗MCM7(1∶100)、RACK1(1∶200),4℃于冰箱孵育过夜;PBS冲洗5min×3次,加即用型广谱试剂盒C液(鼠兔共用二抗)室温孵育20min;PBS冲洗5min×3次,加即用型广谱试剂盒D液,室温20min;PBS冲洗5min×3次;DAB显色,自来水终止显色。苏木素复染,自来水冲洗反蓝,梯度酒精脱水,中性树胶封片。
以肺癌细胞胞浆内出现棕黄色颗粒为阳性表达,结合阳性细胞百分比及阳性细胞染色强弱两个方面评分。MCM7、RACK1阳性表达根据阳性细胞百分率和染色程度进行半定量结果判定:无阳性细胞记0分,阳性细胞百分率≤50%记1分,51%~75%记2分,≥75%记3分;胞质和/或细胞核基本不着色记0分,染色棕黄记1分,染色棕色记2分,染色褐色记3分。每张切片的阳性细胞百分率得分和染色程度等分两项相加作为最后得分。总分0~1分记阴性(-),2~3分记为弱阳性(+),4~5分记为阳性(++),6分记为强阳性(+++);以阴性至弱阳性为低表达,阳性至强阳性为高表达。
4 统计学分析
数据应用SPSS(Statistical Package for Social Science)13.0统计学软件进行统计学分析,计量资料采用χ2检验,双变量相关性分析采用Pearson相关性分析、生存分析采用Kaplan-Meier法等。P<0.05为差异具有统计学意义。
结 果
1 MCM7与RACK1在肺癌中表达高于癌旁正常肺组织
MCM7与RACK1在正常支气管上皮中呈阴性或低表达,在肺癌中弥漫弱阳性或散在阳性表达;MCM7阳性定位于细胞核,RACK1阳性定位于细胞质、膜(图1)。MCM7与RACK1在肺癌中阳性率为89.5%(287/370)、88.9%(239/370),均明显高于正常肺组织(MCM:χ2=12.608,P=0.000;RACK1:χ2=25.273,P=0.000)(图1-图3,表1)。
2 CM7与RACK1二者在肺癌中表达与临床病理因素间关系
免疫组织化学统计学分析显示,MCM7与RACK1的表达水平均与肺癌的病理分级(P=0.003,P=0.002)、淋巴结转移(P=0.008,P=0.002)、组织学分类(P=0.000,P=0.000)和TNM分期(P=0.004,P=0.012)相关。二者与患者年龄(P=0.617,P=0.355)、性别(P=0.110,P=0.613)无相关性。MCM7高表达情况在鳞状细胞癌(Squamous cell carcinoma,SCC,122/150,81.3%)、腺癌(Adenocarcinoma,ADC,93/150,62.0%)、大细胞癌(Large cell lung cancer,LCLC,6/20,30%)、小细胞癌(Small cell lung cancer,SCLC,23/50,46%);在鳞癌、腺癌中表达明显高于其他组织学类型;RACK1高表达情况在SCC(123/150,82.0%)、ADC(130/150,86.7%)、LCLC(8/20,35%)、SCLC(5/50,10%);在鳞癌、腺癌中表达均明显明显高于其他组织学类型(表2)。

图1 正常支气管上皮、鳞状上皮不典型增生和鳞癌中MCM7和RACK1表达的免疫组织化学检测。A,MCM7在正常支气管上皮呈阴性;B,RACK1在正常支气管上皮低表达(*),在鳞状上皮不典型增生(**)和鳞癌(***)中的表达增强;比例尺,100µmFig. 1 Immunohistochemical exmination for expression of MCM7 and RACK1A in normal bronchial epithelium, squamous epithelial dysplasia and squamous cell carcinoma. A, MCM7 is negative in normal bronchial epithelial; B, RACK1 is weak in normal epithelium (*) and strong in squamous epithelial dysplasia (**) and squamous cell carcinoma (***); scale bar, 100µm
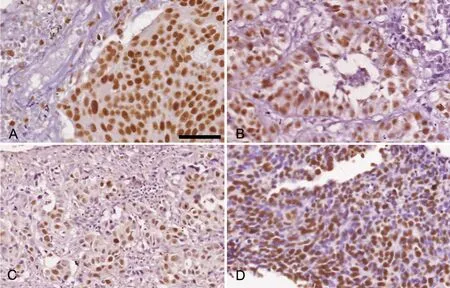
图2 MCM7表达于癌细胞核。A,鳞癌;B,腺癌;C,大细胞癌;D,小细胞癌;比例尺,100µmFig. 2 MCM7 expression in the cancer cell nuclei; A, squamous cell carcinoma; B, adenocarcinoma; C, large cell carcinoma; D, small cell carcinoma;scale bar, 100µm
3 MCM7与RACK1高表达患者生存时间缩短
应用Kaplan-Meier法分析MCM7、RACK1蛋白表达与各类型肺癌患者生存时间(P=0.006,P=0.002,Log-rank检验)的关系(图4,图5),显示MCM7、RACK1高表达组(4-6分)生存时间明显低于低表达组(0-3分)。
4 MCM7与RACK1在肺癌中的表达正相关
对肺癌免疫组化MCM7与RACK1蛋白表达应用Pearson相关性分析,结果显示二者具有正相关性(r=0.401,P=0.000)(表 3)。

图3 RACK1 表达于癌细胞质和细胞膜。A,鳞癌;B,腺癌;C,大细胞癌;D,小细胞癌;比例尺,100µmFig. 3 RACK1 expression in cytoplasm and cell membrane of cancer cells. A, squamous cell carcinoma; B, adenocarcinoma; C, large cell carcinoma;D, small cell carcinoma; scale bar, 100µm

表1 MCM7和RACK1在肺癌和癌旁正常肺组织中的表达Tab. 1 Expression of MCM7 and RACK1 in lung cancer and adjacent normal lung tissues
讨 论
MCM7为DNA复制许可复合体MCM的关键成员,在控制DNA复制的起始过程中起重要的作用,与细胞周期调控、转录、细胞增殖密切相关[5],其在DNA复制调控中的重要作用已愈来愈引起人们的关注。已有的研究显示,在多种肿瘤中MCM7表达升高,MCM7过度表达可以促进肿瘤生长。脑膜瘤中Ⅱ级MCM7蛋白表达水平高于Ⅰ级[6]。Guan等[7]发现乳头状尿路上皮肿瘤中MCM7表达随着肿瘤分级的增加而升高。然而,Ishibashi等[8]研究表明MCM7是Dukes C期结直肠癌患者复发的危险因素。体外研究表明,MCM7低表达显著抑制食管癌细胞系中的细胞增殖,集落形成和迁移[9]。Kwok等[10]提示MCM2-7基因可能与乳腺癌中的常见转录因子(AML-1a,GATA-1,SRY)密切相关。Yang等[11]应用免疫组织化学研究表明MCM7联合Ki67可作为评价胃癌和癌前病变的更敏感的增殖指标。
有报道显示,MCM7在直径小于3cm的肺腺癌中表达,与性别、组织学分级、组织学亚型、肿瘤大小显著相关[12]。也有研究的免疫组织化学分析显示,331名非小细胞肺癌中有196名MCM7阳性染色,而在各种正常组织中未观察到显著的染色,研究还发现MCM7表达升高与非小细胞肺癌患者预后不良相关[13]。 而本研究的结果表明MCM7在正常支气管上皮不表达,在各种组织学类型肺癌组织中均有表达,MCM7高表达率在各类型肺癌中分别为SCC(122/150,81.3%)、ADC(93/150,62.0%)、LCLC(6/20,30%)、SCLC(23/50,46%),在非小细胞肺癌中高表达率明显高于其他组织学类型。同时分析出MCM7过度表达可以促进肿瘤生长、转移,并导致患者生存时间缩短。还表明MCM7表达与病理分级、TNM分期相关。

表2 MCM7与RACK1在各类型肺癌中表达与临床病理因素间关系Tab. 2 Relationship between expression of MCM7 and RACK1 in various types of lung cancer and clinicopathological factors
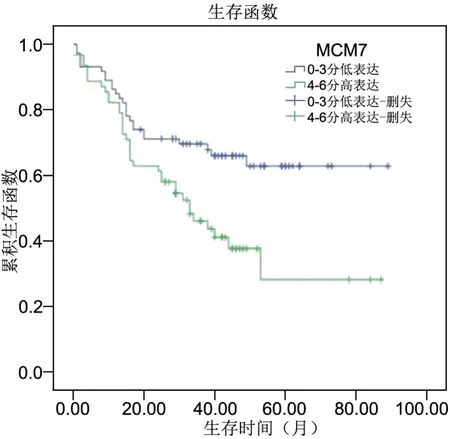
图4 Kaplan-Meier法分析MCM7表达与各类型肺癌患者生存时间的关系(P=0.006,Log-rank检验)Fig. 4 Kaplan-Meier analysis of the relationship between MCM7 expression and survival time of various types of lung cancer patients (P=0.006,Log-rank test)
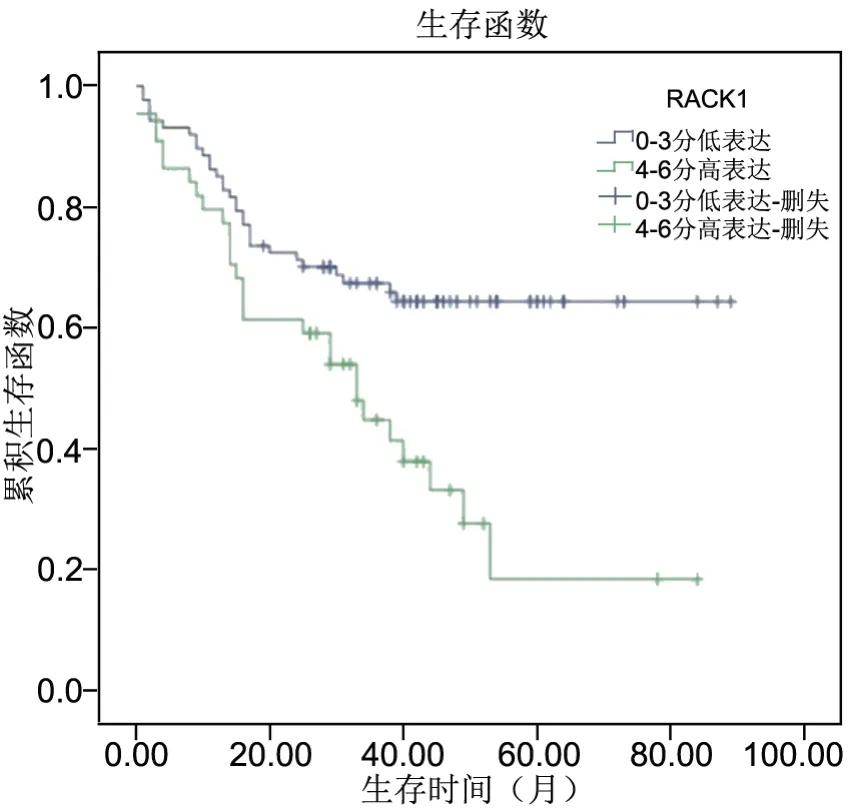
图5 Kaplan-Meier法分析RACK1与各类型肺癌患者生存时间(P=0.002,Log-rank检验)Fig. 5 Kaplan-Meier analysis of the relationship between RACK1 expression and survival time of patients with various types of lung cancer(P=0.002, Log-rank test)

表3 肺癌组织中MCM7与RACK1蛋白表达的相关性(Pearson相关分析)Tab.3 Correlation between MCM7 and RACK1 protein expression in lung cancer tissue microarrays (Pearson correlation analysis)
最近,研究人员发现RACK1在许多肿瘤如鼻咽癌、结肠直肠癌、肺腺癌,肝细胞癌、食管鳞状细胞癌中高表达。关于其在肿瘤发生中的作用,RACK1主要参与肿瘤生长、侵袭和转移[14-18]。然而,其致癌性质存在一些相互矛盾的结果;该蛋白可以对Src活性产生阴性对照,并对Ki-Ras介导的形态学细胞转化产生抑制作用[19]。据报道,它在胃癌中是下调的,作为负调节Wnt信号的肿瘤抑制剂[20]。有研究应用免疫组织化学研究了184例肺癌和配对的正常肺组织,RACK1表达在腺癌中显著增高且频繁,但在肺鳞状细胞癌和大细胞癌中几乎检测不到。此外,RACK1的表达也与腺癌患者的病理分期、肿瘤大小和淋巴结状态显著相关[21]。而本研究结果显示RACK1在各种组织学类型肺癌中均有表达,RACK1高表达率在各类型肺癌中分别为SCC(123/150,82.0%)、ADC(130/150,86.7%)、LCLC(8/20,35%)、SCLC(5/50,10%);在鳞癌、腺癌中高表达率均明显高于其他组织类型。RACK1表达水平与肺癌的病理分级、组织分类、TNM分期、淋巴结转移相关。在III期、IV期肺癌组织中的表达高于I期、II期肺癌,有淋巴结转移的肺癌中高于无淋巴结转移患者。高表达者生存时间短。
我们的前期研究[4]发现 RACK1是MCM7 结合蛋白之一,并证明RACK1通过MCM7/RACK1 /Akt信号复合物介导MCM7磷酸化,从而调控人类非小细胞肺癌细胞生长和细胞周期进程。 RACK1作为中央脚手架,将Akt与MCM7接近。RACK1的过度表达增加Akt和MCM7之间的相互作用并促进Akt依赖性MCM7磷酸化,这进而增加MCM7与染色质和MCM复合物形成的结合。这些变化一起促进DNA复制和细胞增殖。研究结果揭示了调节非小细胞肺癌生长的新信号通路[22]。而本研究结果显示,MCM7与RACK1不仅在非小细胞肺癌中高表达,在某些小细胞肺癌中也存在高表达现象。 那么,二者在小细胞肺癌中是否也存在调控关系,尚需进一步研究。
综上所述,本研究首次发现并证实了RACK1与MCM7在非小细胞肺癌和小细胞肺癌中均存在高表达现象,且二者表达具有正相关性,MCM7与RACK1联合检测有可能成为各类型肺癌细胞增殖、预测肺癌预后和临床靶向治疗的生物学新指标。
