ALS转基因小鼠脊髓中miRNA-132表达减少BDNF表达增加
2019-04-22孙丹王淑坤丁康刘美逸蒋欣陈燕春周风华
孙丹,王淑坤,丁康,刘美逸,蒋欣,陈燕春,周风华*
(1潍坊医学院病理学教研室,2.潍坊医学院生物科学与技术学院,3.潍坊医学院组织学与胚胎学教研室,潍坊,261053)
肌萎缩侧索硬化症(amyotrophic lateral sclerosis,ALS)是脊髓、脑干运动神经元进行性变性所致的慢性神经退行性疾病。运动神经元退化会导致肌肉萎缩和进行性麻痹,病人最终因呼吸肌麻痹导致呼吸衰竭而死亡[1]。microRNA(miRNA)是一类小的内源性调控RNA,它能够在转录后水平上调控目的基因的表达。miRNA-132在神经元中表达丰富,在神经退行性疾病中可通过直接或间接调控其目的基因发挥作用[2]。脑源性神经营养因子(brain derived neurotrophic factor,BDNF)是神经营养因子家族的成员,中枢神经系统含量丰富,在维持正常神经元发育、存活及神经可塑性中起重要作用[3]。miRNA-132、BDNF在ALS中的作用尚不明确。本实验选取ALS转基因鼠,通过原位杂交、qRT-PCR、Western blot及免疫荧光技术检测miRNA-132、BDNF在ALS转基因鼠脊髓组织中的表达变化,探讨miRNA-132、BDNF在ALS发病中的作用及意义。
材料与方法
1 实验动物准备
实验用SOD1-G93A ALS转基因小鼠均购自美国Jackson实验室。小鼠饲养、合笼及30d小鼠DNA鉴定均按吴欣等[4]方法进行。取成年ALS鼠95d、108d和122d的脊髓组织,以同窝野生型鼠作为对照,部分组织4%多聚甲醛灌注固定,制成冰冻切片(厚度7μm)用于原位杂交及免疫荧光检测,部分组织液氮冻存用于分子生物学实验。
2 qRT-PCR
用Trizol一步法提取ALS转基因鼠脊髓组织RNA并逆转录[4],miRNA-134、BDNF逆转录及扩增反应参照之前的程序进行[5]。miRNA-134、BDNF的检测分别以U6、β-actin作为内对照。miRNA-134和U6反转录引物分别为:5’-GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACGGGCGA-3’和 5’-CGCTTCACGAATTTGCGTGTCAT-3’。BDNF 上游引物 5’-TCCACGGACAAGGCAACTT-3’, 下 游 引 物 5’-TCGTCGTCAGACCTCTCGAA-3’;β-actin 上 游 引 物5’-CGTTGACATAAGTAAAGACC-3’,下游引物 3’-ACAGTCCGCCTAGAAGCAC-5’。
3 原位杂交
脊髓组织冰冻切片行原位杂交检测,具体实验步骤参照之前进行[6]。地高辛标记miRNA-132探针购自丹麦Exqion公司,使用浓度为1:100。
4 Western blot检测
用含1mmol/L PMSF的RIPA裂解液冰上裂解脊髓组织30min,4℃离心15min,并测蛋白浓度。配制12%的SDS-DAGE 凝胶,每孔上样30μl,恒压80V,40min,再恒压120V ,70min,之后PVDF膜进行转膜,恒流300mA,110min。5%脱脂奶粉封闭抗原2h,之后孵育一抗 BDNF(1∶500,Arigo)、GAPDH(1∶2000,Proteintech Group),冰箱 4℃ 过夜。次日孵育羊抗兔和羊抗小鼠HRP 酶标二抗(1∶5000)2h,滴加ECL后暗室曝光。应用Image J软件分析Western blot条带光密度,以BDNF与GAPDH条带光密度值代表BDNF相对水平。
5 免疫荧光
参照之前的方法[6]将制好的脊髓冰冻切片进行免疫荧光染色,滴加兔抗 BDNF(1∶100)、鼠抗β-tubulin Ⅲ(1∶200),4℃ 孵育过夜。滴加 Cy3 标记的羊抗兔(1∶200)和 Alexafluor 488 标记的羊抗鼠(1∶200)荧光二抗,滴加 Hoechst(1∶800),荧光显微镜下观察 BDNF 及 β-tubulin Ⅲ 表达情况。
6 统计学分析
采用Prism 5.01 软件 (GraphPad Software, San Diego, CA, USA) 进行统计学分析。所有数据均以均数±标准(¯x±s)表示,P<0.05为差异有统计学意义。
结 果
1 miRNA-132在ALS转基因鼠脊髓组织表达降低
qRT-PCR 检测显示,与WT鼠相比,在ALS发病的早、中、晚期miRNA-132在ALS转基因鼠脊髓组织表达下调(图1A);原位杂交结果显示,miRNA-132阳性表达呈紫蓝色颗粒,在脊髓前角、脊髓后角均可查见阳性细胞,与WT鼠相比,脊髓前角中miRNA-132阳性信号表达下降(图1B)。
2 BDNF在ALS转基因鼠脊髓组织表达增加
qRT-PCR及Western blot检测发现,与WT鼠相比,ALS转基因鼠脊髓组织中BDNF在mRNA及蛋白水平均显著上调(图2,图3);免疫荧光染色显示,ALS转基因鼠和WT鼠脊髓前角中均检测到BDNF免疫阳性细胞,且与β-tubulin Ⅲ标记的神经元共表达。与WT鼠对比,ALS鼠脊髓前角运动神经元中BDNF免疫阳性反应显著升高增强(图4)。
讨 论

图1 ALS鼠中miRNA-132 mRNA表达降低。A,qRT-PCR检测的统计学分析(与WT比较:*,0.01<P<0.05;**,P<0.01; n=3);B,原位杂交组织化学检测(比例尺,50um)Fig. 1 Expression of miRNA-132 mRNA in ALS mice. A, statistical analysis for qRT-PCR detection results (compared with WT∶ *, 0.01<P<0.05; **,P<0.01; n=3); B, in situ hybridization histochemical examination (scale bar, 50um)
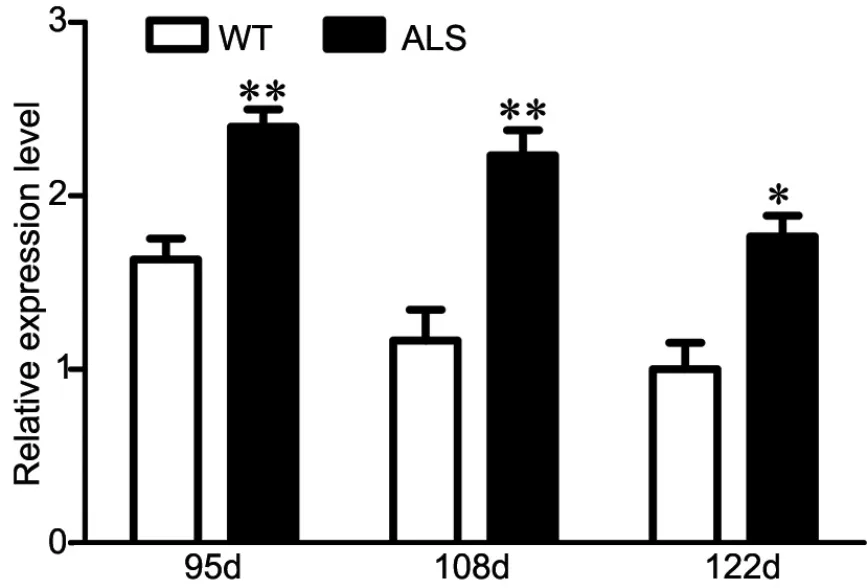
图2 ALS鼠中BDNF mRNA表达的 qRT-PCR检测。与WT比较:*,0.01<P<0.05;**,P<0.01;n=3Fig. 2 qRT-PCR detection for expression of BDNF mRNA in ALS mice.Compared with WT∶ *, 0.01<P<0.05; **, P<0.01; n=3
ALS是一种进行性和致命的神经退行性疾病[7],其发病机制包括谷氨酸兴奋性毒性、氧化应激、线粒体功能障碍、炎症及细胞凋亡等,但运动神经元进行性变性死亡的分子机制尚不清楚[8]。miRNA能在转录后水平上调控目的基因的表达,在神经系统中存在一组特有的miRNA参与中枢发育、神经元分化和突触塑形的过程。近年来发现,miRNAs与阿尔茨海默氏病(Alzheimer’s disease,AD)、帕金森病(Parkinson’s disease,PD)、亨廷顿病(Huntington’s disease,HD)等多种神经退行性疾病的发生发展有关[9,10]。miRNA-132在一些神经发育异常、精神性疾病及神经变性疾病中表达异常[11,12]。本实验通过原位杂交和qRT-PCR发现,与WT鼠相比,miRNA-132阳性细胞主要定位于脊髓前角,在ALS鼠脊髓组织表达量明显下调,表明miRNA-132在ALS发病中可能发挥重要作用。BDNF是神经营养因子家族的成员,对神经元的维持和存活、保持突触完整性和突触可塑性起重要作用[13]。研究表明,BDNF对AD、HD等神经退行性疾病神经元具有保护作用[14,15],但在ALS发病过程中作用尚不明确。本实验通过qRT-PCR、Western blot等技术检测发现,ALS鼠脊髓组织BDNF表达明显上调;通过免疫荧光双标记发现BDNF阳性细胞与β-tubulin Ⅲ标记的神经元共表达,其在ALS鼠脊髓前角神经元中的免疫阳性反应明显增强。我们认为BDNF表达增加可能是机体对神经元退变的一种保护性反应。在多种疾病中发现[16],miRNA-132能够靶向调控BDNF发挥作用,在ALS发病过程中miRNA-132是否通过靶向调控BDNF发挥作用尚不清楚,后期我们将通过细胞实验进一步验证miRNA-132、BDNF在ALS发病的作用及分子机制,为探讨ALS的发病机制奠定基础。

图3 ALS鼠中BDNF水平的Western blot检测。A,Western blot代表性结果;B,BDNF表达水平的统计学分析(与WT比较:0.01<P<0.05;n=3)Fig. 3 Western blot detection for expression level of BDNF protein in ALS mice. A, representative resulta of Western blot; B, statistical analysis for BDNF expression level (compared with WT∶ *, 0.01<P<0.05; n=3)

图4 免疫荧光双标记检测显示122d龄ALS鼠中BDNF表达增强。比例尺,50umFig. 4 Detection for BDNF expression in 122-day-old ALS mice by immunofluorescence double labeling. Scale bar, 50um
