雌激素受体α抑制剂MPP在小鼠囊胚形成和滋养层干细胞中影响YAP核定位
2019-04-22许颂华朱灵华刘玥王晓江钟玉环苏杨许丽旋王世鄂
许颂华 ,朱灵华,刘玥 ,王晓江,钟玉环,苏杨,许丽旋,王世鄂
(1干细胞工程与再生医学福建省高校重点实验室,福州 350108;2福建医科大学基础医学院人体解剖学与组织胚胎学系,福州 350108;3福建医科大学基础医学专业2012级本科班,福州 350108)
雌激素受体α(estrogen receptor α,ERα)是一种在生殖系统中具有重要作用的转录因子。我们的前期研究表明,ERα在小鼠植入前胚发育中发挥作用,其特异性抑制剂甲基-哌啶-吡唑(methyl-piperidino-pyrazole,MPP)可抑制小鼠囊胚形成[1]。成熟的囊胚包括内在的内细胞团(inner cell mass, ICM)和位于外层的滋养外胚层(trophectoderm, TE)。囊胚植入母体子宫后,ICM最终发育为胎儿个体,在体外分离培养则可形成胚胎干细胞(ESCs);TE参与构成胎盘,也可分离培养,形成滋养层干细胞(trophoblast stem cells,TSCs)。前期研究表明,MPP可影响TE关键因子Cdx2的表达[1],但其作用机制尚未明确。在小鼠囊胚形成期间,Hippo信号通路位于Cdx2上游[2],且该通路的关键因子YAP在肿瘤细胞中与ERα密切相关[3],但二者在囊胚形成期间的作用,以及对滋养层细胞的调控尚未见文献报道。本研究分别在小鼠桑葚胚和TSCs细胞中研究ERα抑制剂MPP对YAP的表达的影响。研究结果对进一步揭示ERα在囊胚植入、胎盘形成等方面的作用具有一定的意义。
材料与方法
1 实验动物
昆明(Kunming, KM)小鼠(雌鼠4~6w,雄鼠>8w)购自上海斯莱克公司(SCXK(沪)2012-0002),饲养3~5d,调节生理周期(光照周期07∶00-19∶00),使其适应环境[福建医科大学实验动物中心,使用许可证号:SYXK(闽)2016-0006]供实验处理。所有动物实验相关操作均符合福建医科大学实验动物福利伦理委员会相关规定(批号:2018-004)。
2 主要试剂
MPP,Tocris公司;KSOM培养液,Millipore公司;M2培养液,Sigma公司;孕马血清促性腺激素(PMSG),宁波激素制药二厂;人绒毛膜促性腺激素(hCG),Prospec公司;免疫染色固定液,碧云天公司;抗YAP鼠单克隆抗体,Abnova公司;抗E-cadherin兔多克隆抗体,Cell Signaling公司;抗Sox2鼠单克隆抗体,Santa Cruz公司;抗Cdx2鼠单克隆抗体,BioGenex公司;Alexa Fluor® 488标记驴抗鼠二抗、Alexa Fluor® 594 标记驴抗兔二抗,Life Technology公司;Quick-RNATMMicroPrep R1050试剂盒,Zymo公司;Reverse Transcription Kit试剂盒、dNTP Mix,Thermo公司;SYBR® Premix Ex TaqTM,Roche公司;PCR引物,上海生工;DMEM,Hyclone公司;RPMI-1640培养基、FBS,Gibco公司;FGF4,Peprotech公司;无钙和镁离子的PBS、胰蛋白酶,Invitrogen公司;肝素,Sigma公司。小鼠滋养层干细胞系获赠于厦门大学王海滨教授实验室。
3 主要仪器设备
水套式二氧化碳培养箱,Thermo公司;体视显微镜、荧光显微镜,Nikon公司;激光扫描共聚焦显微镜,Leica公司;PCR仪,Gene公司;Real Time-PCR仪,Thermo公司。
4 小鼠超排卵和受精
KM雌性小鼠腹腔注射10IU PMSG,46~48h后注射6IU hCG,随后与KM雄性小鼠1∶1合笼(♀KM×♂KM),次日清晨检查阴栓判断是否受精。
5 小鼠8-细胞胚的收集和体外培养
于hCG 注射后 64h,将有阴栓的雌鼠以颈椎脱臼法处死,打开腹腔,迅速分离并剪下输卵管和子宫,于室温 M2培养液中稍洗涤,用 M2培养液冲出输卵管中的8-细胞胚,在室温M2培养液中洗涤3次,再用37℃、5% CO2平衡好的KSOM液滴洗涤3次,将形态完好的8-细胞胚移至预孵育的培养液滴(分为对照组0μmol/L MPP和实验组5μmol/L MPP)中,置于37℃、5% CO2、饱和湿度的CO2培养箱中培养。实验重复3次以上,观察并记录各培养液滴中发育至桑葚胚及囊胚的情况。
6 小鼠滋养层干细胞培养与MPP处理
小鼠胚胎成纤维细胞(MEFs)制备:从孕鼠子宫中取出13-14d胎鼠,置于无钙、镁离子的PBS(CMF-PBS)中,并剪去四肢、头部、尾巴及内脏,再用无钙、镁离子的PBS过3遍。洗净后,0.25%的胰蛋白酶消化3min,并用移液枪反复吹打,促进组织消化。吸取消化液,转移至已添加10mL DMEM/10%FBS的100mm培养皿中,隔天传代:吸去培养液,并用CMF-PBS冲洗两次。加入2ml 0.25%胰酶-EDTA 37α消化3min左右并用移液枪温和吹打,再加入等体积DMEM/10% FBS终止消化。将细胞混悬液转移至15ml离心管中,200×g(1400r/min)离心3min。去除上清液,加入1ml DMEM/10% FBS重旋细胞(轻柔吹打),1∶2传代。丝裂霉素C(MMC)处理:待培养皿中MEFs汇合90%时,吸去培养液并添加含有10μg/ml MMC的DMEM/10% FBS(0.1mL 1mg/ml MMC),37℃孵育2h(不超过3h)。收集细胞,-80℃冻存,隔天转移到液氮罐。
MEF条件培养基(Mouse embryonic fibrolast conditioned medium,MEF-CM)制备:37℃水浴快速复苏一管MMC-MEFs细胞,并加入含有9ml DMEM/10% FBS的15ml离心管中,1400r/min离心3min。去除上清液,用10ml的TS培养液(不含FGF4和肝素)重旋细胞并接种在100-mm培养皿上。37℃孵育3d不更换培养液。收集培养液。4℃、2300×g(5000r/min)离心20min。收集上清液,用0.22μm玻璃纤维膜过滤至500 mL玻璃瓶中。以30~40 ml分装储存在-20℃。
小鼠滋养层干细胞培养与传代:复苏小鼠TSCs细 胞, 置 于 70CM + 1.5×F4H(37.5ng/ml FGF4+1.5μg/ml 肝素+ 70% MEF-CM)培养液中培养,当细胞汇合度达大约60%时,传代培养。隔2d后更换新鲜 TS+F4H培养液,随后每隔一天换液培养直至传代。
小鼠TSCs细胞MPP处理:将小鼠TSCs细胞培养于35mm培养皿中,当细胞汇合度达大约60%时,经消化、稀释,按1∶4种于24孔板,同时添加MPP过渡液,使液终浓度分别为0、2.5、5、10μmol/L,48h后收集细胞进行相关检测。
7 免疫荧光染色实验
分别收集各组小鼠桑葚胚(或TSCs细胞),用0.1% PVA-PBS连续清洗3次;4%多聚甲醛中室温固定1h;用0.1% PVA-PBS连续清洗3次,然后置于0.5% Triton X-100中,室温通透0.5h;用0.2% BSA连续清洗3次,然后置于0.2% BSA中,室温封闭1h;封闭结束后,置于一抗中4℃孵育过夜;次日,将细胞用PBST清洗3次,每次10min,然后置于二抗稀释液中(1∶1000稀释),室温避光孵育1h;用PBST分别清洗3次,每次10min,然后置于DAPI(1∶5000稀释)染液中,室温避光孵育1h;用PBST分别清洗3次,每次10min。阴性对照用PBS取代一抗。激光共聚焦显微镜或普通荧光显微镜观察。
8 Real Time-PCR实验
分别收集各组小鼠桑葚胚(或TSCs细胞),用DEPC处理过的0.3% PVP-PBS洗涤3次后,每40枚桑葚胚(或六孔板TSCs细胞)置于装有400μl RNA Lysis Buffer离心管中。根据Quick-RNATMMicroPrep R1050试剂盒说明书提供的方法提取总RNA。用NanoDrop ND-1000(NanoDrop, USA)检测RNA的浓度和纯度。根据Reverse Transcription Kit试剂盒说明书,使用PCR 仪合成cDNA。PCR引物序列信息列于表1(桑葚胚和TSCs细胞的Real Time-PCR实验分别采用H2afz和GAPDH基因为内参)。在Real Time-PCR 扩增仪上采用SYBR®PremixEx TaqTM进行扩增,反应条件设置为95°C,10min,1个循环,95°C,15s,40 个循环,60°C,1min,40 个循环。实验重复3次以上。

表1 引物序列Tab.1 Primer sets used in the present study
9 统计学分析
激光共聚焦扫描显微镜所得图片用SmtScape软件测定分析荧光强度;采用2-△△ct法处理 Real Time-PCR结果;利用SPSS17.0统计软件对实验数据进行统计分析,检验方差齐性后运用独立样本t检验进行组间比较,均以P<0.05为差异具有统计学意义。
结 果
1 YAP在小鼠早、中、末期桑葚胚中的定位分布
小鼠囊胚形成起始于桑葚胚期,因此检测YAP在这一阶段的动态定位变化,有助于揭示其功能。YAP在早期桑葚胚(hCG后72h)的卵裂球中均有分布,且细胞核着色深,细胞质着色浅。在中期桑葚胚(hCG后78h)的内层细胞中,细胞核不着色,细胞质着色浅;外层细胞中,细胞核着色深,细胞质着色浅。在后期桑葚胚(hCG后88h)的内层细胞中,细胞核不着色,细胞质着色变浅;外层细胞中,细胞核着色深,细胞质着色变浅(图1A)。

图1 YAP在桑葚胚期的阶段性定位以及MPP处理对其表达的影响。A,早、中、末期(分别对应hCG后72h、78h和88h)桑葚胚中的YAP定位,其中cross-section为扫描的断面之一,Z-series为多层扫描断面图像的叠加;B,5μmol/L MPP不同时间段处理对小鼠桑葚胚YAP表达的影响;C-E,分别为64-72h(C)、64-78h(D)、64-88h(E)5μmol/L MPP处理后的卵裂球细胞核或质中YAP荧光强度统计学分析;*,0.01<P<0.05;比例尺,25μmFig. 1 The phase-specific localization of YAP protein in the morula stage and the effect of MPP treatment on its expression. A, localization of YAP in early, middle, and late (corresponding to 72h, 78h, and 88h after hCG, respectively) morulae, where cross-section is one of the scanned sections, and z-series is a superposition of multi-layer scanned section images; B, effect of 5μmol/L MPP treatment in differrent time periods on the expression of YAP in mouse morula; C to E, showing the effects of 5μmol/L MPP treatment on nuclear or cytoplasmic YAP fluorescence intensity after different treatment intervals, namely 64-72h (C), 64-78h (D), 64-88h (E), respectively; *, 0.01<P< 0.05; scale bar, 25μm
2 MPP处理对小鼠桑葚胚YAP定位和mRNA表达的影响
我们已经证实5μmol/LMPP处理可抑制小鼠囊胚形成[1]。本研究经5μmol/L MPP处理8h后收集早期桑葚胚(hCG后72h),免疫荧光检测显示,YAP在所有卵裂球中都有分布,且与对照组相比没有显著差别(图1B、1C);5μmol/L MPP处理12h后收集中期桑葚胚(hCG后76h),实验组与对照组相比,细胞核或质内的YAP荧光强度强均无显著差别(图1B、1D);5μmol/L MPP处理24h后收集末期桑葚胚(hCG后88h),实验组的细胞核荧光强度比对照组明显降低,细胞质YAP荧光强度无显著变化(图1B、1E)。
小鼠桑葚胚经5μmol/L MPP体外培养24h后,与对照组比较,桑葚胚YAP mRNA表达水平无显著改变(图2)。

图2 MPP处理24h对桑葚胚中YAP mRNA表达的影响。于hCG后64h收集小鼠8-细胞胚,分别置于0μmol/L MPP与5μmol/L MPP中培养,hCG后88h收集桑葚胚,检测YAP mRNA表达水平变化Fig 2 Effect of MPP treatment for 24 h on YAP mRNA expression in morula. Mouse 8-cell embryos were harvested at 64h after hCG injection, and cultured in 0μmol/L MPP and 5μmol/L MPP, respectively. The morula was harvested at 88h after hCG injection, and the expression level of YAP mRNA was detected
3 MPP处理对小鼠TSCs细胞形态的影响
小鼠TSCs细胞来源于3.5d囊胚的TE细胞(图3A)。2.5μmol/L MPP处理组与对照组相比,细胞在形态上无明显改变;5μmol/L MPP处理导致TSCs克隆团出现叠加在单层细胞上的细胞团块;10μmol/L MPP处理组TSCs细胞克隆团明显减少,呈稀疏团块状分布(图3B)。前期研究表明,去除药物作用后,5μmol/L MPP对小鼠桑葚胚的抑制作用可被逆转,而10μmol/L MPP的影响不可逆[1],为了获得足够数量的TSCs细胞,后续研究将使用5μmol/L MPP处理作为实验组。
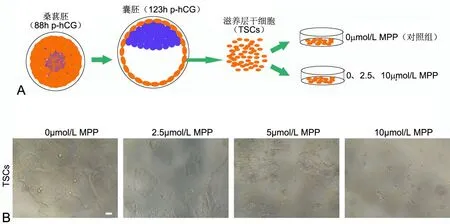
图3 MPP处理对小鼠TSCs细胞形态的影响。A,小鼠TSCs细胞来源以及实验分组示意图;B,不同浓度MPP处理48h对小鼠TSCs形态的影响;比例尺,50μmFig 3 Effect of MPP treatment on cell morphology of mouse TSCs. A, schematic for source of mouse TSCs and experimental groupings; B, effects of different concentrations of MPP treatment for 48h on the morphology of mouse TSCs; scale bar, 50μm.
4 MPP对小鼠TSCs中Sox2、YAP和Cdx2 mRNA表达的影响
经5μmol/L MPP处理48h后,小鼠TSCs细胞中Sox2 mRNA表达水平显著升高,YAP与Cdx2的mRNA表达水平无显著变化(图4)。

图4 MPP处理对小鼠TSCs细胞相关基因表达的影响。小鼠TSCs细胞经0或5μmol/L MPP处理48h后检测Sox2、YAP和Cdx2 mRNA表达水平;*,0.01<P<0.05Fig 4 Effects of MPP treatment on the expression of mouse TSCs-associated genes. The expression levels of Sox2, YAP and Cdx2 mRNA were detected in mouse TSCs cells treated with 0 or 5 μmol/L MPP for 48h; *,0.01<P<0.05
5 MPP处理对小鼠TSCs中E-cadherin和YAP定位的影响
对照组E-Cadherin表达于TSCs细胞表面,YAP核内定位比较明显。经5μmol/L MPP处理后的TSCs细胞中,已分化细胞(图5)的E-cadherin不表达,YAP仍定位于细胞核内;在实验组较大的克隆团上可见叠加生长的细胞团块(图5),此处E-cadherin不表达,YAP核内定位也不明显(图5)。
6 MPP处理对小鼠TSCs中Sox2和Cdx2定位的影响
对照组Sox2强阳性的细胞表达不均匀,主要位于克隆团外周的细胞,内部细胞大多为弱阳性;而5μmol/L MPP实验组细胞Sox2强阳性的细胞则更加均匀和密集地分布于中部和外围细胞核内(图6A)。与此相类似,经MPP处理后,Cdx2强阳性细胞的表达也更加均匀和密集(图6B)。
讨 论
成功的受孕过程至少包括两方面的要素:形成具有完整功能的囊胚和形成子宫对囊胚的可接受状态,但二者的发生机制仍未完全明确。在小鼠模型中,8-/16-细胞胚卵裂球表面开始致密化,并在桑葚胚末期吸收水分,使卵裂球内部扩大为囊腔的过程称为囊胚形成,标志第一次细胞系分化的完成:形成内细胞团(ICM)和滋养外胚层(TE)。在正常生理条件下,TE将侵入子宫内膜并最终发育为胎盘。研究TE的分化以及多能性的维持,对于深入理解囊胚形成和植入机制均有重要意义。已有研究表明,Cdx2、Pou5f1、Nanog、Gata3等因子在囊胚形成期间都有重要作用[4],发掘更多参与其中的关键因子是国内外研究的一大趋势。

图5 MPP处理48h对MPP处理对小鼠TSCs中E-cadherin和YAP蛋白定位的影响。细箭头,分化的TSCs细胞;粗箭头,细胞团块;比例尺,50μmFig 5 Effect of MPP treatment for 48h on the localization of E-cadherin and YAP in mouse TSCs. Thin arrows, show the differentiated TSCs; thick arrows, show the cell clumps; scale bar, 50μm

图6 MPP处理48h对小鼠TSCs中Sox2和Cdx2蛋白定位的影响。最后一列图像展示用Nikon荧光显微镜相机自带的Linescan软件对图中黄色线段区的荧光强度进行分析的结果;细箭头,克隆团外围细胞荧光强度;粗箭头,部分中部细胞荧光强度;比例尺,50μmFig 6 Effects of MPP treatment for 48 h on Sox2 and Cdx2 protein localization in mouse TSCs. Images of the last panel show the results of fluorescence intensity analysis of the yellow line segment by the Linescan software from the Nikon fluorescence microscope camera; thin arrows, show the fluorescence intensity of the peripheral cells of the clone; thick arrows, show the fluorescence intensity of the middle cells; scale bar, 50μm
Yu等已报道Hippo信号通路关键因子YAP蛋白在GV卵、1-细胞胚、2-细胞胚、3/4-细胞胚、8-细胞胚、桑葚胚、囊胚中的分布变化,发现YAP核定位在桑葚胚期仅限于外层细胞,在囊胚阶段定位于TE细胞[5]。本研究则更加细化地研究了YAP在桑葚胚前、中、末期的动态变化,发现在中期(约hCG后78h)桑葚胚阶段以后才出现内层细胞YAP核定位消失的现象,为进一步的药物处理实验提供时间依据。这些结果也提示YAP在囊胚形成期间特异性地参与TE的分化。
进一步研究发现,经ERα特异性抑制剂MPP处理24h后YAP核内表达水平降低,但其mRNA表达水平无显著变化,提示MPP对YAP表达的影响并非通过影响其转录水平。YAP受到多个上游因子的调控,在受级联调控磷酸化后,磷酸化的YAP与细胞质中的14-3-3蛋白结合,抑制YAP的促增殖和抗凋亡活性,从而促进细胞凋亡;而没有被磷酸化的YAP则进入细胞核,与核内TEAD4结合,激活下游因子表达[2]。MPP对YAP已知上游因子的调控作用有待进一步研究发现。
滋养层干细胞系(TSCs)来源于TE细胞,被认为是研究胎盘的理想模型,另有研究表明,TSCs继承了大部分TE关键表观遗传学标记[6],提示其也可用于分析TE的形成和功能维持机制。已有研究表明,Eomes、Esrrb、Sox2、Elf5、Cdx2等因子[7-10]对小鼠TSCs细胞的干性维持具有重要作用,ERα和Yap在其中的作用尚未明确。本研究发现,经MPP处理后,小鼠TSCs细胞出现较多细胞团块。单层贴壁生长的细胞若汇合、接触则出现正常的“接触抑制”而停止生长,但若Hippo-YAP信号受到影响则无法抑制细胞生长,E-cadherin等上皮极性因子的表达受抑制,出现的叠层的细胞团[11]。这些结果与本研究观察到的经MPP处理后细胞团块中YAP核定位不明显、E-cadherin不表达的结果相一致,提示ERα在TSCs中可能通过调控YAP定位从而发挥一定的作用。而经MPP处理后TSCs细胞中的Yap mRNA表达水平也未出现显著变化,与桑葚胚阶段的表现相类似。
为了进一步探讨ERα的作用机制,我们检测了经MPP处理后Sox2和Cdx2的表达。结果表明,MPP处理提高了Sox2 mRNA的表达水平,但不影响Cdx2 mRNA的表达水平。Sox2是维持TSCs干性的关键因子[12],所以MPP可能影响了部分TSCs细胞的干性。免疫荧光结果显示,对照组Sox2和Cdx2蛋白强阳性细胞均主要位于克隆团的外围,而经MPP处理后阳性细胞向克隆团中部聚集。提示细胞干性的变化可能与TSCs细胞团块的形成,以及YAP、E-cadherin的表达变化有关。
上述结果综合提示,ERα在小鼠囊胚形成和TSCs细胞性状维持中可能具有一定的作用,并影响到YAP的定位分布。采用STRING分析可知,在桑葚胚和TSCs细胞中ERα可能通过不同的信号通路调控Yap表达(图7),具体机制有待进一步实验验证。

图7 ERα与YAP相关信号通路STRING分析Fig. 7 STRING analysis of ERα and Yap related signaling pathways
