培养程序及培养基成分对茄子优选植株花药培养的影响
2019-04-22崔群香朱海佳陈丹阳刘方娇
王 畅,崔群香,朱海佳,周 祯,陈丹阳,汪 辉,刘方娇
(金陵科技学院,江苏 南京 211169)
茄子(Solanum melongenaL.),茄科茄属1年生草本植物,我国茄子栽培面积占世界总面积的52.2%[1],其嫩果具有较高的营养和保健价值[2]。研究证明茄子可采用花药培养,花粉细胞能够通过胚状体发生途径产生再生植株[3-4],甚至能够产生自发加倍的双单倍体(DH)植株,这为快速创制茄子新种质提供了一条高效途径。但目前茄子花药培养体系尚未完善,存在污染率高、出胚率以及胚胎成苗率低等问题,且诸多因素如消毒技术、培养基成分、基因型等都会影响上述问题。因此,从上述影响因素入手,筛选最佳消毒方法、调整培养基成分,优化茄子花药培养程序是花药培养技术应用于育种实践时首先需要解决的问题。
采用品种间聚合杂交或多父本花粉授粉等方式,扩大花药供体的遗传基础,才能更有效地创制出聚合多种优良性状的茄子新种质。本试验的目的就是在解决了花药初代培养污染率高的问题的基础上,设计并配制诱导培养基、分化培养基和壮胚培养基等,对几个茄子商品种的聚合杂交后代进行花药培养,试验培养基成分以及培养程序对胚状体诱导率和正常生长的作用,以期利用花药培养结合聚合杂交技术,快速获得优良茄子新种质。
1 材料和方法
试验于2016年12月—2018年6月于金陵科技学院园艺试验站进行。于2016年12月—2017年5月进行商品种栽培和聚合杂交,种果于2017年7月采收,杂种于2017年7月底播种,优良杂交后代选择于2017年10—11月进行,花药培养于2017年8月—2018年6月进行。
1.1 试验材料
1.1.1 花药
选用果实形状符合长江流域市场消费习惯的40个紫长茄商品种,2016年冬季育苗,春季定植在金陵科技学院园艺试验站,并在开花后采集40个品种的混合花粉,对所有品种的茄花进行授粉,每个品种至少保证坐住1个果实,以获得聚合杂交的后代。从聚合杂交后代中,筛选出以自身表现好的编号为16(鄂优二号)、22(农百万—黑帅)、35(迎春一号)、36(鄂优春韵)的4个商品种为母本的综合性状优良的单株若干,采集所有入选茄子植株上的适宜花蕾作为试验材料用于花药培养。植株筛选的标准是果皮紫色亮丽、果实形状好、果长28 cm以上、果径3.5 cm以上、单株商品果数超过10个、果实发育快。
1.1.2 培养基
试验设计了诱导培养基、分化培养基、成熟培养基和生根培养基,各培养基具体成分及含量见表1、表2。
1.1.3 仪器
智能培养箱(宁波赛福实验仪器有限公司生产的PRX-1000 C型人工气候箱)。
1.2 试验方法
采集抱合花瓣顶端距离萼片裂口±2 mm的花蕾,4 ℃低温下处理2 d后进行表面消毒和接种。消毒前撕去花蕾的萼裂片但保留萼筒,放入无菌三角瓶中,先用75%酒精消毒2 min,倒掉酒精后,加入1滴吐温-80,然后加入6.5%的次氯酸钠,摇动10~15 min后倒掉,并用无菌水冲洗花蕾3~5次,无菌纸吸干水分备用。
1.2.1 2种培养基组合对茄子花药培养胚状体成苗的影响
将表面消毒过的花蕾,放在无菌滤纸上剥取花药,接种到直径6 cm,装有15 mL诱导培养基的玻璃培养皿中,每种诱导培养基接种10皿,每皿接种20~30个花药(大约4~5个花蕾);36 ℃黑暗条件下热处理6 d后转至25 ℃光照培养。
试验设计了2种诱导培养基、1种分化培养基和2种胚成熟培养基,组成了2种培养基组合进行茄子花药培养。组合1:花药→诱导培养基1(36 ℃黑暗培养6 d,25 ℃光暗培养9 d)15 d→胚分化培养基20~40 d→胚状体成熟培养基1(无激素)中20 d→胚状体生根培养基;组合2:花药→诱导培养基2(36 ℃黑暗培养6 d,25 ℃光暗培养9 d)15 d→胚分化培养基20~40 d→胚状体成熟培养基2(降低激素浓度)中20 d→胚状体生根培养基。当生根的胚状体形成具有2~3片真叶的植株时进行炼苗移栽,成活的植株移栽到土壤中或大花盆中直至开花结果。
除热处理为高温黑暗条件外,其余培养过程的培养条件一致,均为25 ℃,16 h光照,光照强度调节至最高。
分化培养结束时,统计其中花药产生胚状体的培养皿百分率、出胚的花药百分率(出胚的花药百分率=每组合出胚花药总数/接种花药总数×100%),观察并记录各培养过程中胚状体产生、发育和生根成苗状况,以及最终移栽成活植株情况。
1.2.2 诱导培养基和分化培养基成分对胚状体诱导和发育的影响
为提高胚状体诱导频率和成苗率,根据1.2.1培养中胚状体诱导和发育的结果,调整培养基的配方(表2):为消除1.2.1中基本培养基对诱导结果的影响,诱导培养基采用NLN基本培养基,但不添加丝氨酸、谷胱甘肽和谷氨酰胺等3种固体有机物,仅对蔗糖或葡萄糖以及聚乙二醇的浓度进行了调整,设计了G1、G2、G3、S1、S2和S3等6种诱导培养基;为了减轻胚状体愈伤化和水渍化程度,在统一采用NLN培养基的基础上,降低分化培养基中的细胞分裂素的浓度,设制了B2、K1和K2等3种分化培养基;分化培养基上产生的胚状体及其花药随机转入胚成熟培养基1或2;成熟胚状体转入生根培养基。
每种诱导培养基至少试验3次,每次试验至少接种10皿,每皿接种4~5个花蕾的花药。每种诱导培养基的花药随机转入3种不同的分化培养基,每种分化培养基至少接种3皿,至少3次重复试验。分化培养结束后统计每次试验6种不同诱导培养基或3种不同分化培养基中接种花药的出胚百分率(出胚百分率=每种培养基中出胚花药总数/接种花药总数×100%),排除培养过程中的花药或培养基污染等因素,保证每种配方获得至少2次重复试验的数据,并利用Excel软件进行包含2次重复的单因素方差分析。
2 结果与分析
2.1 培养基组合对茄子胚状体诱导和成苗的影响
热激结束后,大多数花药颜色由黄绿色变为棕褐色,50%以上的花药膨大,少量花药保持原来大小。在诱导培养基1中诱导培养的花药,转入分化培养基15 d后,其中2个培养皿中的部分花药产生了形态比较正常的胚状体(图1-1),甚至有个别胚状体不仅发育出侧根,而且产生了真叶,但胚状体数量较少;而在诱导培养基2中诱导培养的花药,则在转入分化培养基17 d后,1个培养皿中的部分花药才出现胚状体,胚状体数量多,但发育阶段较晚,多数处于心形胚期或之前,少量胚状体有胚根产生,但胚轴膨大肿胀,没有发育出叶片(图1-2)。同一花药或不同花药诱导产生的胚状体都存在发育速度不同、发育阶段不一致的现象(图1-3)。
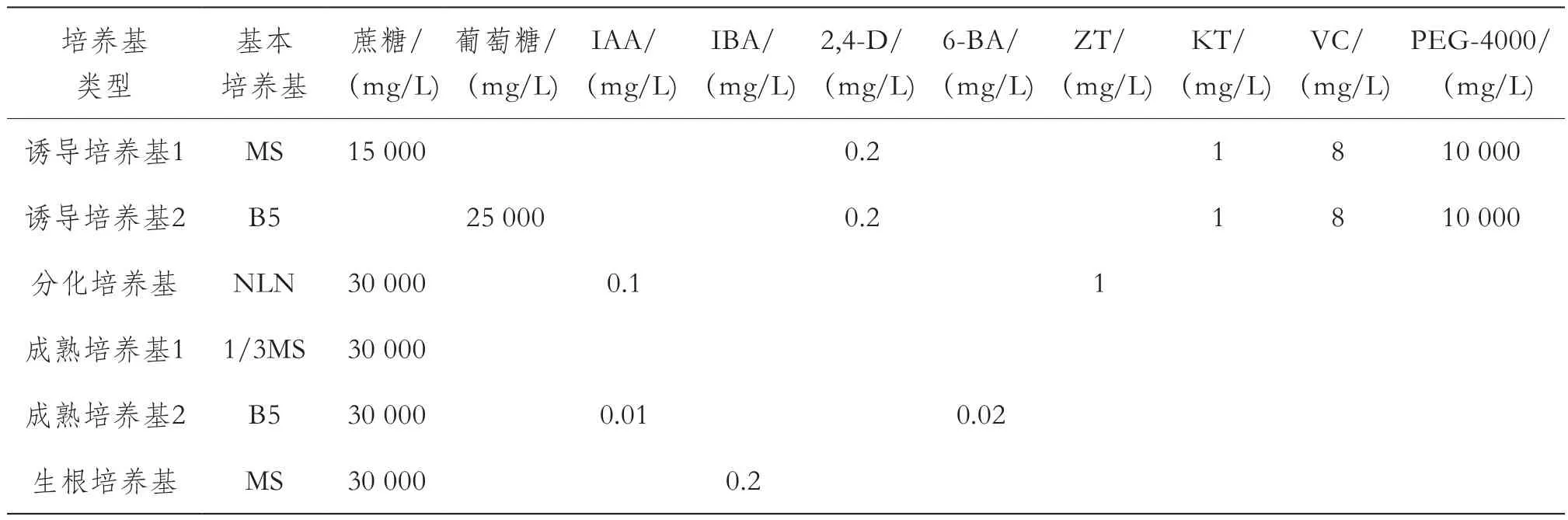
表1 不同培养基的成分及含量
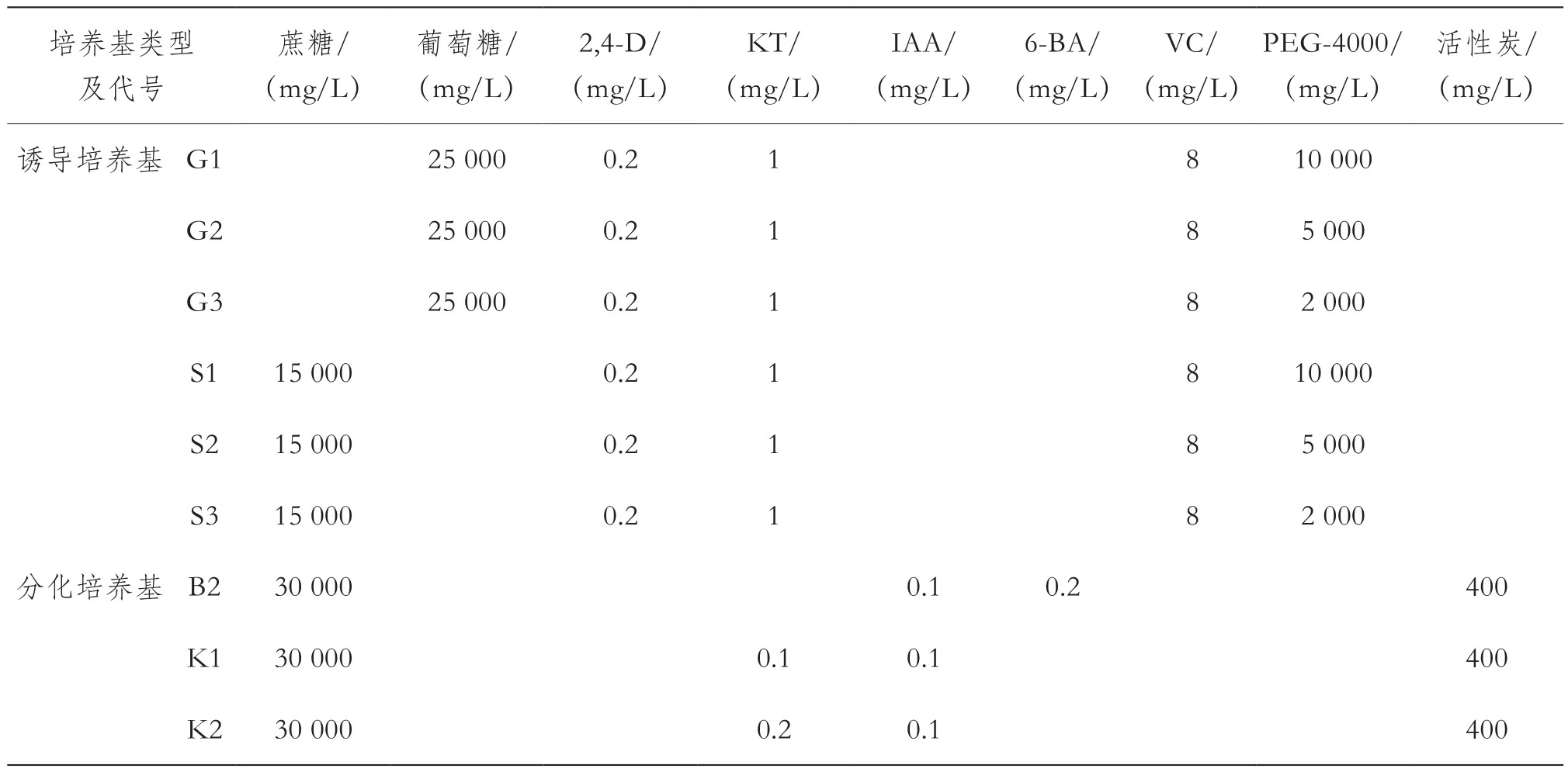
表2 调整后各种培养基的成分及含量
分化培养基上产生的胚状体,大部分胚轴肿胀,转入胚成熟培养基1后胚状体容易褐变死亡;转入胚成熟培养基2中的幼嫩胚状体的胚轴甚至愈伤化,最终无法长成能够移栽成活的植株。在分化培养基上即使产生真叶和胚根的成熟胚状体,在无激素的胚成熟培养基1中也多数褐化死亡或生长发育停滞,只有及时转入生根培养基后,才诱导少量形态正常的胚状体继续发育,并最终移栽成活。
由表3可知,1.85%~3.33%的接种花药被诱导产生了胚状体,其中含蔗糖的诱导培养基1中的花药产生胚状体总数少但成熟胚状体数量多,胚状体发育快,最终成苗率高(28.6%);而含葡萄糖的诱导培养基2中的花药产生的胚状体数量多,但发育速度慢,最终成苗率低(3.3%);因此,提高出胚花药百分率和胚状体成苗率,是茄子花药培养能够应用于茄子育种实践的关键。
追踪观察发现,成活苗的顶芽往往多个并生,只有除去多余的顶芽,保留的顶芽才能进一步发育至开花坐果,说明这类植株来源的胚状体,可能是多个细胞起源的。随后试验中发现,单一胚状体发育成的植株,存在分株或分支现象(图2),甚至在分株性状上存在差异(图2-2),与前述胚状体多细胞起源的推测相符。图2-2显示,1个胚状体发育来的植株存在2个分株,2个分株在茎叶颜色方面存在差异,且2个分株都包含2个或3个分枝。据此推断,胚状体多细胞起源,每个分株可能来源于不同的花粉细胞,且各分株中的分枝可能来源于2细胞或3细胞雄配子体中的单倍体细胞。
分析茄子花药培养胚状体诱导和发育的过程,并根据培养基成分推断:培养基组合1(程序1)更有利于茄子花药培养产生移栽成活的再生植株;含葡萄糖的起始培养基更有利于胚状体的诱导但不利于胚状体成熟;含蔗糖的起始培养基尽管出胚花药频率低,但有利于胚状体成熟;胚状体形态不正常可能与培养基中植物生长调节剂浓度过高或种类不合适有关。
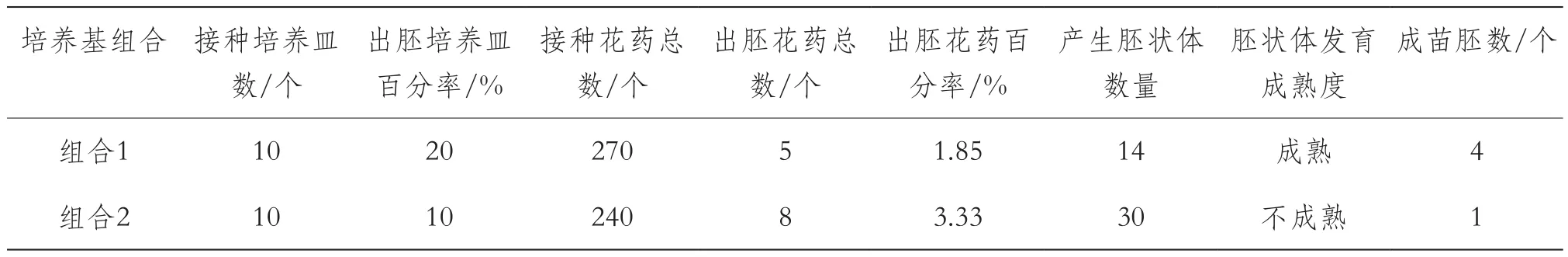
表3 诱导培养基及其与分化和胚成熟培养基组合对茄子花药胚状体诱导和发育的影响
2.2 诱导培养基和分化培养基成分对胚状体诱导和发育的影响
6种诱导培养基以及3种分化培养基对花药出胚率的作用见表4,由表4可见培养基成分调整后,茄子花药出胚百分率从原来最高3.33%(表3),提高到最低8.1%,最高达到了12.3%,各培养基间差异不显著,表现较为一致(表4);以葡萄糖为碳源的诱导培养基,茄子花药出胚率略高于以蔗糖为碳源的培养基;PEG浓度为10 g/L时,出胚花药最多;G1、B2分别是出胚花药百分率最高的诱导培养基和分化培养基。试验中还发现,每个花药产生的胚状体数量显著增加,平均达到5个以上。

图1 茄子胚状体诱导和植株再生成苗情况

图2 单个胚状体发育的植株

表4 不同培养基成分对花药胚胎诱导的影响
3 结论与讨论
花药培养的程序对胚胎发育有重要的影响。目前茄子花药基本沿用Dumas de Vaulx和Chambonnet于1982年建立的程序[5-6],即花药接种于培养皿中的诱导培养基中,在35 ℃黑暗中培养8 d,然后在12 h/12 h光周期和25 ℃中继续培养4 d,第12天将花药转接至R1分化培养基中培养,每20 d更新1次培养基,直至从花药中产生胚胎,将胚胎分离并在V3培养基中培养成小植株。本试验沿用该程序并适当调整,推迟胚胎剥离花药的时间,建立了优化的培养程序,减轻了胚状体的褐化,促使更多的胚状体发育成植株。鉴于发育阶段较早的胚状体如果脱离了花药母体,在随后培养时难以被诱导发育成苗,因此本试验所建立的培养程序还需要补充或者进一步优化。
聚乙二醇是一种渗透调节剂,能够促进茄子小孢子发育成胚状体[4],Patricia Corral-Martínez等[7]在进行茄子游离小孢子培养时证实:是PEG而不是甘露醇,能显著增加小孢子胚胎发生的诱导。本试验也证实,茄子花药初代培养的诱导培养基中添加2~10 g/L的聚乙二醇,能够减轻胚状体的水渍化,大大提高产生胚状体的花药频率,出胚花药百分率为8.1%~12.3%,考虑到每茄子花蕾中的花药数至少5个,则出胚花蕾百分率达到40%~60%;而在后期分化培养基中添加聚乙二醇则不利于胚状体诱导。
诱导培养基中添加蔗糖或葡萄糖,花药胚状体诱导率和发育阶段会存在一定的差异。其中添加葡萄糖时胚状体诱导数量多,而且早期胚胎多,胚胎可确定来源于花粉细胞;而添加蔗糖时,也产生较多的子叶期以前的未成熟胚胎。未成熟的早期胚胎直接转接至培养基中褐变严重,分裂素浓度较高的培养基中胚状体胚轴部位膨大愈伤化,胚状体难以成苗。因此,如何促使早期胚状体发育成熟,就成为影响花药育种的限制因素之一。
本试验通过降低分化培养基中激素浓度,促进了胚状体成苗,但成苗率仍旧很低,Y XING等[8]在进行茄子子叶培养时发现蔗糖浓度影响愈伤组织的产生,较低浓度蔗糖能够抑制愈伤组织形成而有利于不定芽的产生,蔗糖浓度对于茄子花药产生的幼胚发育是否也存在类似的影响,值得进一步研究;幼胚下胚轴愈伤化也影响花粉胚进一步发育成苗,多次调整培养基中植物生长调节剂浓度,均未能诱导这种胚胎继续发育。而茄子下胚轴和子叶培养都有很多成功的报道,能否从形态不正常的胚胎分离出下胚轴和顶芽,诱导其重新通过器官发生途径产生植株,有待进一步研究。
茄子花药培养产生的胚状体,有单倍体、二倍体和多倍体等不同倍性差异,自交结实的二倍体植株,经后代性状稳定性判断为单倍体花粉细胞起源,结合胚状体由脱离花药的细胞产生的现象,可推断本实验室建立起来的茄子花药培养程序,诱导出的胚状体主要是花粉细胞起源的。本试验发现,单个胚状体发育来的植株,存在分株或分枝现象,根据分枝或分株的表现,推断胚状体可能是多细胞起源,至于胚状体是不同的花粉细胞融合产生,还是同一配子体中的营养细胞和生殖细胞融合产生,尚需要将各个分枝或分株建成单株,并得到自交系,根据自交后代性状表现,结合细胞学鉴定,加以确定。
茄子花药培养技术要成功应用于育种实践,重点需要解决3个问题:一是提高胚状体诱导和发育成植株的频率,二是确保胚状体是单倍体细胞来源,三是单倍体加倍技术。单倍体加倍技术已经取得成功[9],本研究将花蕾胚状体诱导频率提高到接近50%,并且获得了双单倍体(DH)株系,今后研究重点是确保胚状体单倍体细胞起源,以提高茄子单倍体诱导技术应用于育种实践的可靠性,大幅度缩短自交系选育的年限,提高茄子杂交品种选育的效率。
综合上述研究结果,茄子花药培养优化的培养程序调整为:花药→诱导培养基S1培养15 d(36 ℃黑暗条件下培养6 d,25℃光照16 h黑暗8 h培养9 d)→分化培养基B2培养20 d→胚成熟培养基培养20 d→出胚花药生根培养20 d→萌发胚胎生根培养基成苗→炼苗移栽。利用该程序,能够多次重复试验结果,并扩大了茄子花药培养的基因型反应范围。
