免疫增强型肠内营养对中国人群胃癌根治术后免疫功能影响的Meta分析
2019-04-22甘胜红柯泽文李永
甘胜红 柯泽文 李永
作者单位:438400 红安 湖北省黄冈市红安县人民医院
胃癌是常见的消化系统恶性肿瘤,手术为重要的治疗手段,但术后易发生严重并发症,常表现为低营养状态、严重炎症反应、低免疫状态等[1]。多项研究表明早期肠内营养制剂供应能提高患者氮含量、热量、膳食纤维摄入,促进肠道蠕动,降低炎症反应程度[2-3],但能否改善患者术后免疫功能,目前仍存争议。免疫增强型营养制剂富含精氨酸、谷氨酰胺、ω-3脂肪酸,有些制剂含有核苷酸(RNA),理论上能够提高术后患者的免疫功能[4]。目前国内外关于胃癌根治术后早期肠内营养供给的研究较成熟,但关于免疫增强型肠内营养制剂与普通肠内营养制剂对胃癌根治术后患者免疫功能影响的研究不多,其中对CD8、CD4水平的影响仍有争议[5-6],循证医学证据较少。另外,鉴于我国人群体质与国外此类患者体质的差异性,本研究对象仅选择我国人群,系统性评价免疫增强型肠内营养制剂对胃癌根治术后患者免疫功能的影响,以期为将来的研究和临床实践提供依据。
1 方法
1.1 纳入标准
1.1.1 研究类型 临床随机对照试验(randomized controlled trial,RCT),语种为中文及英文,第一作者国籍且报道病例国籍均为中国。分配隐藏或盲法不限,纳入文献均为全文文献。
1.1.2 研究对象 经病理学检查确诊并行胃癌根治术的患者,术式包括全胃切除术、近端切除术及远端切除术等,一般情况良好,无手术禁忌证。排除非肿瘤性疾病行胃切除术、心肺肝肾功能差、合并严重内分泌及代谢疾病、合并其他系统肿瘤、术前已接受放化疗、术前行免疫增强治疗、免疫功能性疾病等患者。
1.1.3 干预措施 试验组采用免疫增强型肠内营养制剂,对照组采用常规肠内营养制剂。两组其余一般治疗措施如补液、抗炎、引流等一致。
1.1.4 结局指标 细胞免疫功能指标:术后1 d、术后 7~10 d淋巴细胞亚群(CD3、CD4、CD8)、CD4/CD8比值以及自然杀伤细胞(NK)水平;体液性免疫功能指标:术后第 1 d、术后 7~10 d免疫球蛋白 A(IgA)、免疫球蛋白M(IgM)以及免疫球蛋白G(IgG)水平。
1.2 排除标准
非临床性试验研究、病例对照研究、综述、非RCT试验以及数据缺失重复发表等研究,无法提取数据或进行合并分析进行描述性分析。
1.3 文献检索策略
计算机检索中国知网(CNKI)、万方医学网、维普医学网、中国生物医学网、PubMed、EMBASE等数据库,搜集中国人群中胃癌根治术后患者采用免疫增强型肠内营养制剂辅助治疗对免疫功能影响的相关临床随机对照研究,检索期限为各数据库建库至2018年7月。采用主题词与自由词相结合的方法检索,同时手工检索相关期刊和书籍,检索灰色文献;追溯纳入研究的参考文献,以补充获取相关文献。中文检索词包括胃癌、进展期胃癌、根治术、根治手术、免疫肠内营养、免疫增强型肠内营养等;英文检索词包括gastric cancer、advanced gastric cancer、radical resection、radical surgery、immuno-enteral nutrition、immuneenhanced enteral nutrition等。
1.4 文献筛选及资料提取
由2名研究者独立筛选文献、提取资料,若有分歧,则由第3名研究者参与讨论并协商解决。最终纳入文献资料提取主要内容包括以下方面:⑴纳入文献的基本信息,如第一作者姓名、发表时间、样本量、分组、年龄、性别比等。⑵干预措施,如疾病诊断、手术方式、免疫增强型肠内营养制剂主要成分、对照组肠内营养制剂、各组开始肠内营养时间、术后血清样本检测回报时间等。⑶结局指标,包括细胞免疫指标CD3、CD4、CD8、CD4/CD8比值、NK;体液免疫指标IgA、IgM、IgG。
1.5 文献质量评价
采用Cochrane Handbook 5.1文献质量评价手册对纳入文献进行质量评价,条目包括随机方法、盲法、分配隐藏方案、结果数据完整性、选择性报告研究结果、其他偏倚来源等6个方面。各评价条目中若均评定为低风险则评为A级,存在1条或多条中度风险或风险等级不详则评定为B级,如存在1条或多条高风险等级则评定为C级,B级及以上等级说明纳入文献质量较好。由2名研究者独立进行文献质量评价,交叉核对,若意见不一致则请第三方裁决。
1.6 统计学方法
采用RevMan 5.3软件录入及分析数据,用均数差(MD)表示最终合并效应量,提取各指标合并效应量95%可信区间(CI)及系统性评价异质性(I2),异质性检验采用χ2检验。若I2<75%,P>0.05则认为研究结果异质性可以接受,采用固定效应模型;若I2>75%,P<0.05认为研究结果间存在异质性,采用随机效应模型。以P<0.05为合并分析差异有统计学意义;分析前检查基本信息及临床信息是否存在偏倚,或进行敏感性分析。研究文献≥9篇时采用漏斗图评估纳入文献发表偏倚。
2 结果
2.1 文献检索结果
初步检索共获得文献320篇,其中中文数据库共检索文献48篇,外文数据库共检索文献272篇,经初次筛选排除重复文献154篇,非相关性文献102篇;再次筛选排除国籍不符合49篇,非RCT研究5篇;最终共纳入文献10篇[5-14],其中英文文献2篇,中文文献8篇。纳入的10篇文献共534例患者,其中采用免疫增强型肠内营养制剂(试验组)283例,常规肠内营养制剂(对照组)251例,纳入文献基本特征见表1。

表1 纳入文献的基本特征Tab.1 Basic features of the included literature
2.2 文献质量评价
对10篇纳入文献进行质量评价,所有纳入文献数据均完整,无其他偏倚来源,其中2篇文献交代具体随机分配方案,所有文献均未指出盲法及分配隐藏方案。按照Cochrane Handbook 5.1文献质量评价手册评价纳入文献质量等级均为B级,无高风险文献纳入分析,见图1。

图1 纳入研究的偏倚风险评价图Fig.1 Bias risk assessment chart included in the study
2.3 细胞免疫指标Meta分析结果
2.3.1 CD3 共 4 篇文献[8-10,14]报道术后 1 d CD3 水平,试验组和对照组各96例,经异质性检验,文献间异质性较小(I2=22%,P=0.28),采用固定效应模型进行合并分析,结果显示术后1 d试验组患者CD3水平低于对照组(MD=-2.06,95%CI:-3.68~-0.43,P=0.01),见图 2。5 篇文献[8-11,14]报道术后 7~10 d CD3水平,纳入135例患者,经异质性检验,各文献间存在异质性(I2=92%,P<0.1),采用随机效应模型分析,结果显示试验组CD3水平高于对照组(MD=6.74,95%CI:1.36~12.12,P<0.01)。纳入文献的临床异质性及一般资料异质性均未见明显异常,故行敏感性分析,排除文献[9]后纳入 4 篇文献[8,10-11,14],经异质性检验,文献间异质性较小(I2=0,P=0.28),采用固定效应模型分析,结果显示试验组CD3含量高于对照组(MD=4.17,95%CI:2.39~5.94,P<0.001),见图 3。
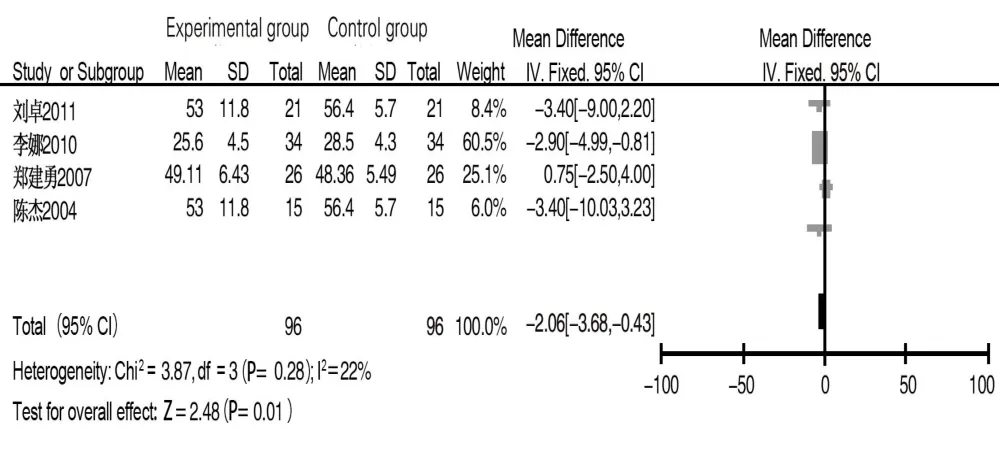
图2 试验组与对照组术后1 d CD3水平比较的Meta分析Fig.2 Meta-analysis of CD3 levels between experimental group and control group on the first day after surgery
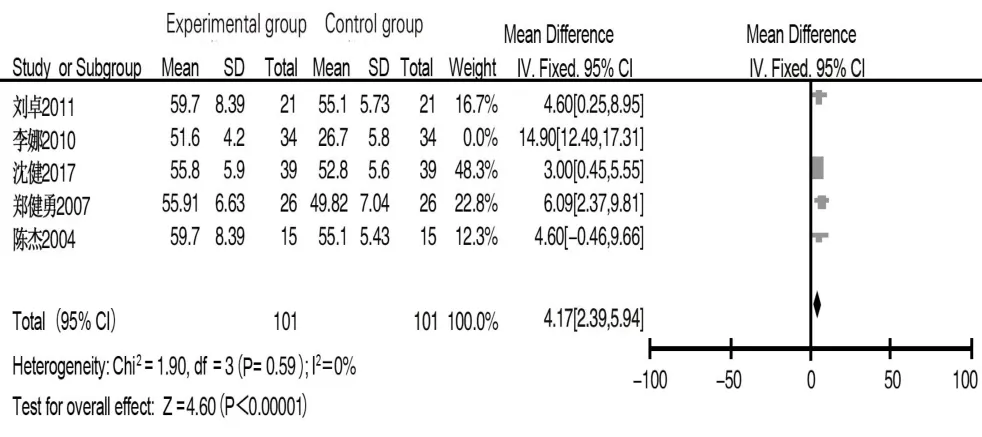
图3 试验组与对照组术后7~10 d CD3水平比较的Meta分析Fig.3 Meta-analysis of CD3 levels between experimental group and control group on 7 to 10 days after surgery
2.3.2 CD4 共 8 篇文献[5-6,8-10,12-14]报道术后第 1 天CD4水平,经异质性检验,各文献间异质性较小(I2=0,P>0.1),采用固定效应模型分析,结果显示两组差异无统计学意义(MD=0.47,95%CI:-0.60~1.54,P=0.39)。9 篇文献[5-6,8-14]报道术后 7~10 d CD4 水平,经异质性检验,各文献间存在异质性(I2=79%,P<0.1),复习临床异质性无特殊,敏感性分析提示异质性稳定,选择随机效应模型进行合并分析,结果显示试验组CD4水平高于对照组(MD=5.93,95%CI:3.68~8.19,P<0.001),漏斗图提示存在一定发表偏倚,见图 4、图 5。
2.3.3 CD8 共 7 篇文献[5-6,8,10,12-14]报道术后 1 d CD8水平,各文献间异质性较小(I2=0,P=0.27),采用固定效应模型分析,结果显示两组CD8水平差异无统计学意义(MD=-0.46,95%CI:-1.64~0.72,P=0.45);同 7 篇文献[5-6,8,10,12-14]报道术后 7~10 d CD8 水平,各文献间存在异质性(I2=96%,P<0.05),采用随机效应模型分析,结果显示两组差异无统计学意义(MD=2.00,95%CI:-2.87~6.88,P=0.42)。排除文献[12]后各文献间异质性较小(I2=22%,P=0.27),采用固定效应模型分析,结果显示两组差异无统计学意义(MD=0.20,95%CI:-0.79~1.20),P=0.69),见图 6。
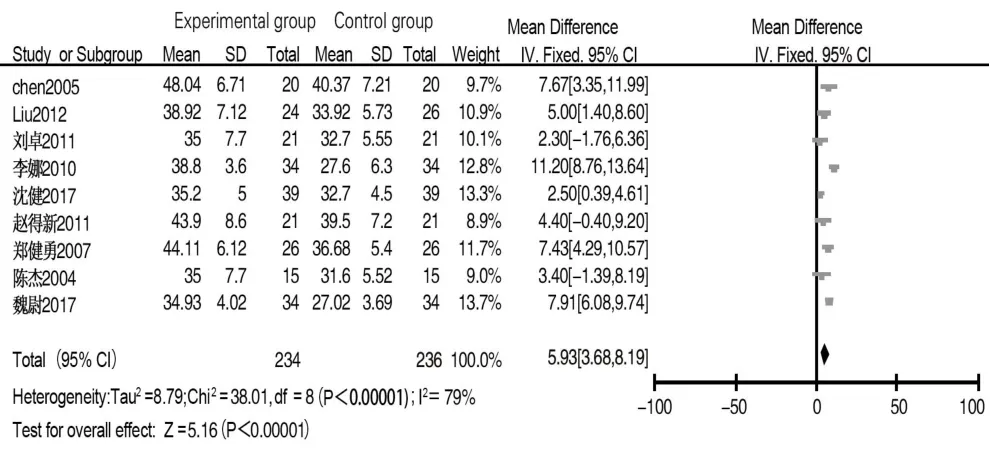
图4 试验组与对照组术后7~10 d CD4水平比较的Meta分析Fig.4 Meta-analysis of CD4 levels between experimental group and control group on 7 to 10 days after surgery
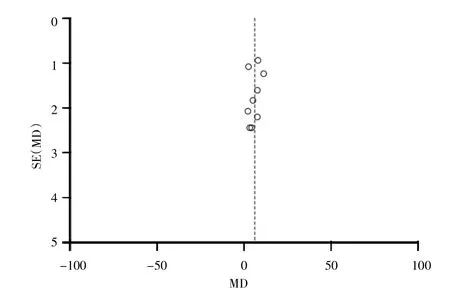
图5 术后7~10 d CD4水平敏感性分析漏斗图Fig.5 Sensitivity analysis funnel chart of CD4 level on 7 to 10 days after surgery
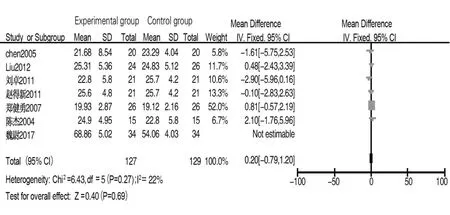
图6 试验组与对照组术后7~10 d CD8水平比较的Meta分析Fig.6 Meta-analysis of CD8 levels between experimental group and control group on 7 to 10 days after surgery
2.3.4 CD4/CD8 共 7 篇文献[5,8-10,12-14]报道术后 1 d CD4/CD8水平,各文献间异质性较小(I2=0%,P>0.1),采用固定效应模型分析,结果显示两组差异无统计学意义(MD=0.03,95%CI:-0.05~0.12,P=0.45)。同 7 篇文献报道术后7~10 d CD4/CD8水平,各文献间存在异质性(I2=73%,P<0.05),采用随机效应模型分析,试验组 CD4/CD8水平高于对照组(MD=0.53,95%CI:0.33~0.73,P<0.001)。排除文献[10]后各文献间异质性较小(I2=48%,P=0.09),采用固定效应模型分析,结果显示试验组CD4/CD8水平仍高于对照组(MD=0.40,95%CI:0.31~0.50,P<0.001),见图 7。
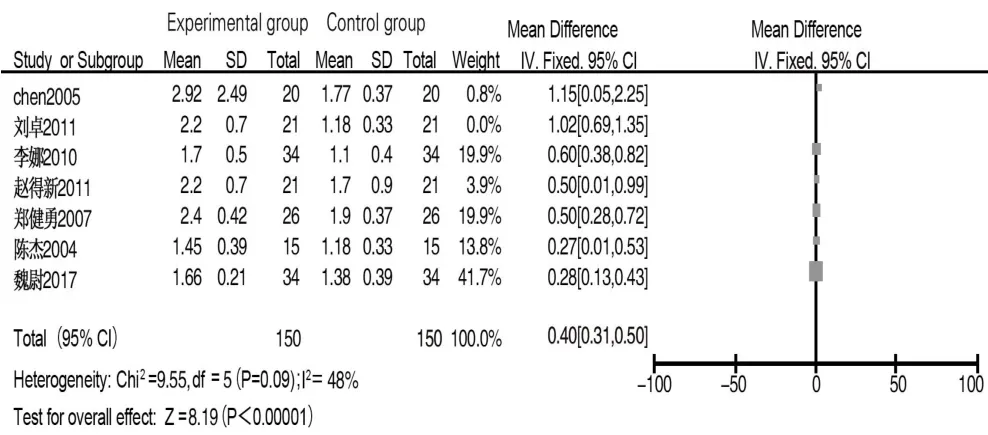
图7 试验组和对照组术后7~10 d CD4/CD8值比较的Meta分析Fig.7 Meta-analysis of CD4/CD8 levels between experimental group and control group on 7 to 10 days after surgery
2.3.5 NK 共 3 篇文献[6,8,10]报道术后 1 d NK 细胞含量,经异质性检验,各文献间异质性较小(I2=48%,P=0.15),采用固定效应模型分析,结果显示两组间NK 含量无统计学差异(MD=-0.23,95%CI:-1.62~1.16,P=0.75)。术后7~10 d NK细胞含量各文献异质性亦较小(I2=0,P=0.69),采用固定效应模型分析,结果显示试验组NK细胞含量高于对照组(MD=1.40,95%CI:0.05~2.76,P<0.05),见图 8。

图8 试验组与对照组术后7~10 d NK细胞含量比较的Meta分析Fig.8 Meta-analysis of NK cell levels between experimental group and control group on 7 to 10 days after surgery
2.4 体液免疫指标Meta分析结果
2.4.1 IgA 共 6 篇文献[5,8-10,13-14]报道术后 1 d IgA含量,各文献间异质性较小(I2=0,P=0.90),采用固定效应模型分析,结果显示两组差异无统计学意义(MD=-0.01,95%CI:-0.15~0.14,P=0.90)。共 8 篇文献[5,7-11,13-14]报道术后 7~10 d IgA 含量,各文献间存在异质性(I2=54%,P=0.03),采用固定效应模型分析,结果显示试验组IgA含量高于对照组(MD=0.33,95%CI:0.24~0.41,P<0.001)。排除文献[9]后发现各文献间异质性较小(I2=0,P=0.49),采用固定效应模型分析,结果显示试验组IgA含量高于对照组(MD=0.29,95%CI:0.20~0.38,P<0.001),见图 9。
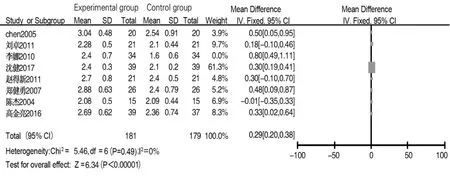
图9 试验组与对照组术后7~10 d IgA含量比较的Meta分析Fig.9 Meta-analysis of IgA levels between experimental group and control group on 7 to 10 days after surgery
2.4.2 IgM 共 8 篇文献[5-6,8-10,12-14]报道术后 1 d IgM含量,各文献间异质性较小(I2=0,P=0.48),采用固定效应模型分析,结果显示两组差异无统计学意义(MD=-0.03,95%CI:-0.09~0.03,P=0.27)。共 10 篇文献[5-14]报道术后7~10 d IgM含量,各文献间存在异质性(I2=74%,P<0.01),采用随机效应模型分析,结果显示试验组IgM含量高于对照组(MD=0.21,95%CI:0.14~0.27,P<0.001)。经检查临床异质性为年龄导致,以年龄≥70岁和<70岁进行亚组分析,其中年龄≥70岁纳入文献 2篇[9,12],文献间异质性较小(I2=0%,P=0.34),采用固定效应模型分析,结果显示试验组IgM 含量高于对照组(MD=0.80,95%CI:0.57~1.02,P<0.001);年龄<70 岁纳入文献 8 篇[5-8,10-11,13-14],文献间异质性亦较小(I2=0,P=0.69),采用固定应模型分析,结果显示试验组IgM含量高于对照组(MD=0.15,95%CI:0.08~0.22,P<0.001),见图 10;漏斗图提示两亚组纳入文献发表偏倚较小,见图11。
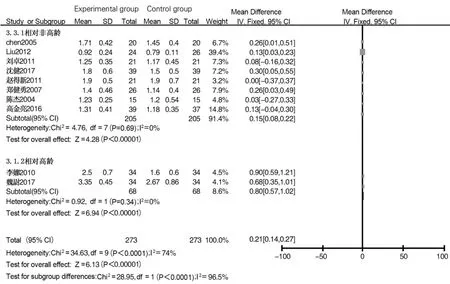
图10 ≥70岁和<70岁组术后7~10 d IgM含量比较的Meta分析Fig.10 Meta-analysis of IgA levels between≥70 years old group and<70 years old group on 7 to 10 days after surgery
2.4.3 IgG 共8篇文献[5-6,8-10,12-14]报道术后 1 d IgG 含量,各文献间异质性较小(I2=0%,P=0.98),采用固定效应模型分析,结果显示两组差异无统计学意义(MD=0.09,95%CI:-0.23~0.42,P=0.58)。共 10 篇文献[5-14]报道术后7~10 d IgG含量,各文献间存在异质性(I2=79%,P<0.01),采用随机效应模型分析,结果显示试验组IgG含量高于对照组(MD=1.91,95%CI:1.11~2.72,P<0.001),漏斗图提示纳入文献存在一定发表偏倚。检查临床异质性无特殊,经敏感性分析后排除文献[9],发现各文献间存在异质性(I2=63%,P<0.05),采用随机效应模型分析,结果显示试验组IgG 含量高于对照组(MD=1.57,95%CI:0.94~2.19,P<0.001),图12;漏斗图显示发表偏倚明显改善,见图13。
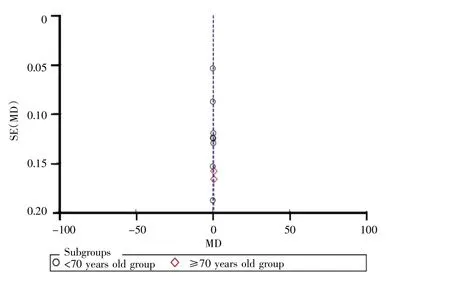
图11 术后7~10 d IgG含量比较的漏斗图Fig.11 Funnel plot of IgM content comparison on 7 to 10 days after surgery
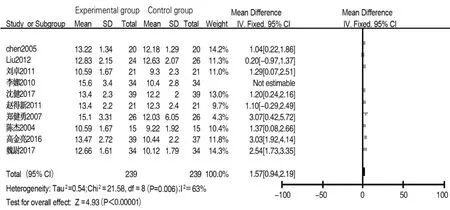
图12 试验组与对照组术后7~10 d IgG含量比较的Meta分析Fig.12 Meta-analysis of IgG levels between experimental group and control group on 7 to 10 days after surgery

图13 IgG术后7~10 d IgG含量比较的漏斗图Fig.13 Funnel plot of IgG content comparison on 7 to 10 days after surgery
3 讨论
胃癌根治术后患者及时恢复免疫功能和营养对生活质量及预后有重要影响。研究发现免疫增强型肠内营养制剂支持对患者免疫功能恢复有较好作用,利于术后恢复,尤其对危重症患者治疗有重要的辅助作用[15]。本研究纳入文献中所使用的免疫增强型肠内营养制剂含有ω-3脂肪酸、维生素A、维生素C和维生素E,具有增强免疫功能作用[16],同时ω-3脂肪酸还有抗炎及抗肿瘤作用[17]。目前已有关于胃肠道恶性肿瘤患者术后使用免疫增强型肠内营养制剂的循证医学研究,但纳入研究癌种较多,大部分为结直肠癌、胰腺癌,且分析指标均主要集中于术后感染率、住院时间、炎症反应等[17-21]。本研究就胃癌根治术后患者采用免疫增强型肠内营养制剂支持对其免疫功能的影响进行Meta分析,研究对象选择中国人群,共纳入10篇文献,经评价纳入文献总体质量均为B级,说明本研究分析结果具有代表性,同时遵循循证医学研究公平、公正、公开的第三方评价精神,避免选择性报道而增加分析偏倚性。
本研究主要从细胞免疫及体液免疫两方面进行系统性评价。在抗肿瘤作用中,T淋巴细胞有重要作用,其数量和功能异常可使肿瘤逃逸于宿主免疫系统监控。CD3在成熟的T淋巴细胞表面均可表达,是反映细胞免疫功能的重要指标[22]。CD4/CD8比值是机体免疫功能的重要体现,CD4细胞能调整效应细胞而产生明显的抗肿瘤作用,而CD8细胞能直接对肿瘤细胞产生杀伤作用[23],故CD4/CD8比值提高提示患者免疫功能增强。NK细胞又称为自然杀伤细胞,无需肿瘤致敏原作用就能发挥抗肿瘤作用,此外还能分泌一些细胞因子达到抗肿瘤作用[24]。有研究报道胃癌根治术后患者T淋巴细胞功能2周内明显受抑制[25],本研究细胞免疫功能Meta分析结果显示,术后1 d大部分细胞免疫指标两组均无明显差异,可能与治疗时间短,手术打击后免疫系统仍处于恢复状态有关。但发现对照组CD3水平于术后1 d高于试验组,与部分纳入文献结果不一致,分析原因可能与纳入研究较少有关。进一步分析术后7~10 d发现试验组CD3、CD4、CD4/CD8比值、NK细胞水平均高于对照组,提示免疫增强型肠内营养制剂治疗后患者细胞免疫功能得到明显提高,与国内相关研究结论一致[26]。但术后7~10 d CD8水平两组间差异不大,原因不明,仍需后续研究加以证实。
体液免疫主要由B淋巴细胞介导,常与致敏原接触后产生相应的抗体,一般分为IgA、IgM、IgG、IgD、IgE 5种。研究表明IgA具有抗体依赖性细胞介导的细胞毒性作用,在抗感染、抗肿瘤中有较好的应用前景[27]。IgM作为感染后最先体现的体液免疫抗体,在抗感染及抗肿瘤中均可发挥重要作用。IgG是含量最多的体液免疫抗体,也是体液免疫中发挥免疫功能最重要的指标,有免疫监控、抗肿瘤作用[28]。体液免疫功能可反映B淋巴细胞功能,各种免疫球蛋白之间相互联系且具有不同作用[29]。研究表明尽早开始营养治疗是改善肿瘤患者预后的重要保护因素[30]。本研究体液免疫功能Meta分析结果显示,术后1 d两组各项体液免疫功能指标未见明显差异,可能与治疗时间较短有关。而术后7~10 d试验组IgA、IgM、IgG水平均高于对照组,其中分析术后7~10 d两组IgM含量时发现纳入文献异质性较高,经寻找临床异质性发现其中2篇文献[9,12]患者纳入的年龄偏高,故对年龄行亚组分析,结果各亚组异质性改善明显,免疫增强型肠内营养制剂治疗后7~10 d试验组IgM含量高于对照组,提示免疫增强型肠内营养制剂治疗数天后可改善患者的体液免疫功能。
本研究结果发现,胃癌根治术后及时加用免疫增强型肠内营养制剂治疗能提高患者免疫功能,其治疗效果术后1 d不明显,治疗数天后效果较好。但本次研究由于纳入文献数量和质量限制,尤其部分纳入文献一般资料信息描述不规范、样本量较小、盲法及隐藏方案未具体阐述可能影响文献偏倚风险等局限性,今后仍需开展多中心、大样本的随机临床对照试验,进一步评价其在胃癌患者术后免疫功能中的疗效。
