HSP27在食管鳞状细胞癌KYSE150细胞中的功能
2019-04-18郑树涛申铜雪韩秀娟卢晓梅
张 潇, 刘 涛, 郑树涛, 刘 清, 申铜雪, 马 蓉, 韩秀娟, 卢晓梅
(新疆医科大学1临床医学研究院, 2健康管理学院, 乌鲁木齐 830011)
食管癌(esophageal cancer,EC)来源于上皮细胞的恶性肿瘤,以食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC)为主,是世界范围内最常见的上消化道恶性肿瘤之一,其发病率和死亡率分别位列第8位和第6位[1-4]。由于食管癌早期缺乏特异的临床症状及有效的诊断手段等,患者就诊时大多是中晚期[5]。虽然近年来食管癌的诊断及治疗取得了显著进步,ESCC仍然长期预后不良,因此,分子病理学研究尤为重要。热休克蛋白质27(HSP27)是热休克蛋白家族(HSPs)中小分子热休克蛋白质的重要成员之一,分子量27 KD,其基因编码区的同源性在不同物种之间保持高度保守性,在调节肿瘤细胞的增殖、侵袭及转移中发挥关键作用[6-8]。本研究应用细胞功能实验检测HSP27不同表达对食管鳞癌细胞的增殖、侵袭及转移能力的影响,探讨HSP27对食管癌恶性表型的调控。
1 材料与方法
1.1材料食管癌细胞系Eca9706购自武汉大学细胞库,KYSE30、KYSE150、KYSE510和TE-1由中国医学科学院国家重点实验室馈赠。慢病毒由上海吉凯公司包被。HSP27抗体和GAPDH内参抗体购自Abcam公司。Western blot二抗试剂盒、二甲基亚砜(DMSO)、四甲基偶氮唑盐MTT、结晶紫购自美国Invitrogen公司。RIPA裂解液、BCA试剂盒购自美国Thermo公司。RPMI-1640培养基、胎牛血清(FBS)、0.25%胰蛋白酶、青-链霉素、PBS购自美国Gibco公司。Transwell的24孔板购自BD公司。
1.2方法
1.2.1 细胞培养 5种食管癌细胞系(KYSE30、KYSE150、KYSE510、TE-1、Eca9706)均由含10%胎牛血清(FBS)、1%青-链霉素的RPMI-1640培养基提供营养,在5%CO2、37℃条件下培养。所有实验均在细胞对数生长期进行。
1.2.2 蛋白质免疫印迹实验Western blot PBS清洗细胞2遍,0.25%胰蛋白酶消化细胞,离心留取细胞沉淀,用RIPA裂解液提取细胞总蛋白(冰上操作),BCA试剂盒测定蛋白浓度,以上样量30 μg/孔、上样体积20 μL/孔的标准计算上样体系,浓度12%PAGE胶电泳分离蛋白,转膜(PVDF膜),0.5%脱脂奶粉封闭,一抗(1∶1 000)4℃过夜,荧光二抗(1∶10 000)室温孵育2 h,扫描结果,采集图像,Image Pro软件分析结果。
1.2.3 慢病毒转染和流式分选细胞 挑选HSP27表达量最高的KYSE150细胞系进行慢病毒转染,敲低HSP27的表达。六孔板接种细胞(2×105个/孔),按照MOI=10稀释病毒浓度为1×108TU/mL,按比例加入各转染体系,5%CO2、37℃条件下孵育18 h后,更换成常规培养基培养。待细胞长满后,消化,离心,500 μL PBS重悬细胞沉淀,过滤,上流式细胞仪(flowcytometer,FCM)分选细胞,接种到培养瓶中培养待后续实验。
1.2.4 MTT细胞增殖实验 96孔板按细胞数量5000个/孔的量接种细胞,细胞用无血清1640培养基培养,将细胞共分5组,分别为Empty vector 组,Negative control组,shRNA-HSP27-1组,shRNA-HSP27-2组,shRNA-HSP27-3组,检测时间点:0、24、48、72、96 h,每组每个检测时间点设5个复孔,按20 μL/孔加入MTT(5 mg/mL),避光培养4 h,弃去液体,DMSO按135 μL/孔加入,避光摇床混匀10 min,酶标仪测A490 nm处的吸光度值,分析结果。
1.2.5 Transwell细胞侵袭实验 Transwell小室铺胶(matrigel胶:1640培养基=1∶8)60 μL/孔,37℃放置1 h, 4℃冰箱过夜待用。接种细胞前,37℃条件下1640培养基水化基底膜30 min,上室加入细胞(1×105个/孔),细胞用无血清1640培养基培养,按“1.2.4”项分为5组,Transwell小室按500 μL/孔量加入含30%FBS的1640培养基,37℃孵育48 h,弃去培养基,PBS洗2遍,多聚甲醛600 μL/孔,4℃固定30 min,室温晾干,5%结晶紫染色5 min,蒸馏水洗3次,棉签擦拭上室,镜下观察,采集图像,用Image J软件分析结果。
1.2.6 细胞划痕实验 6孔板按细胞数量1×106个/孔铺板,用含2.5%胎牛血清的1640培养基培养细胞,在每孔中用10μL枪头划3条平行线,分别在划痕0、24、48、72 h观察并采集图像,用Image J软件分析结果。

2 结果
2.1HSP27在不同食管鳞状细胞癌细胞系中的本底表达情况Western blot实验检测5种食管癌细胞系中HSP27的本底表达情况,结果显示,KYSE150含量最高,其次分别:KYSE510、KYSE30、Eca9706、TE-1(图1)。因此选择HSP27表达量最高的KYSE150细胞系进行后续实验。
2.2慢病毒转染成功敲低了HSP27在KYSE150中的表达慢病毒转染KYSE150细胞系经流式分选之后转染率达100%(图2)。用Western blot实验验证敲低效果,结果显示HSP27的表达量明显下调(图3),与Empty vector 组和Negative control组相比,差异具有统计学意义(P<0.05),证实慢病毒转染成功敲低了HSP27在KYSE150中的表达。
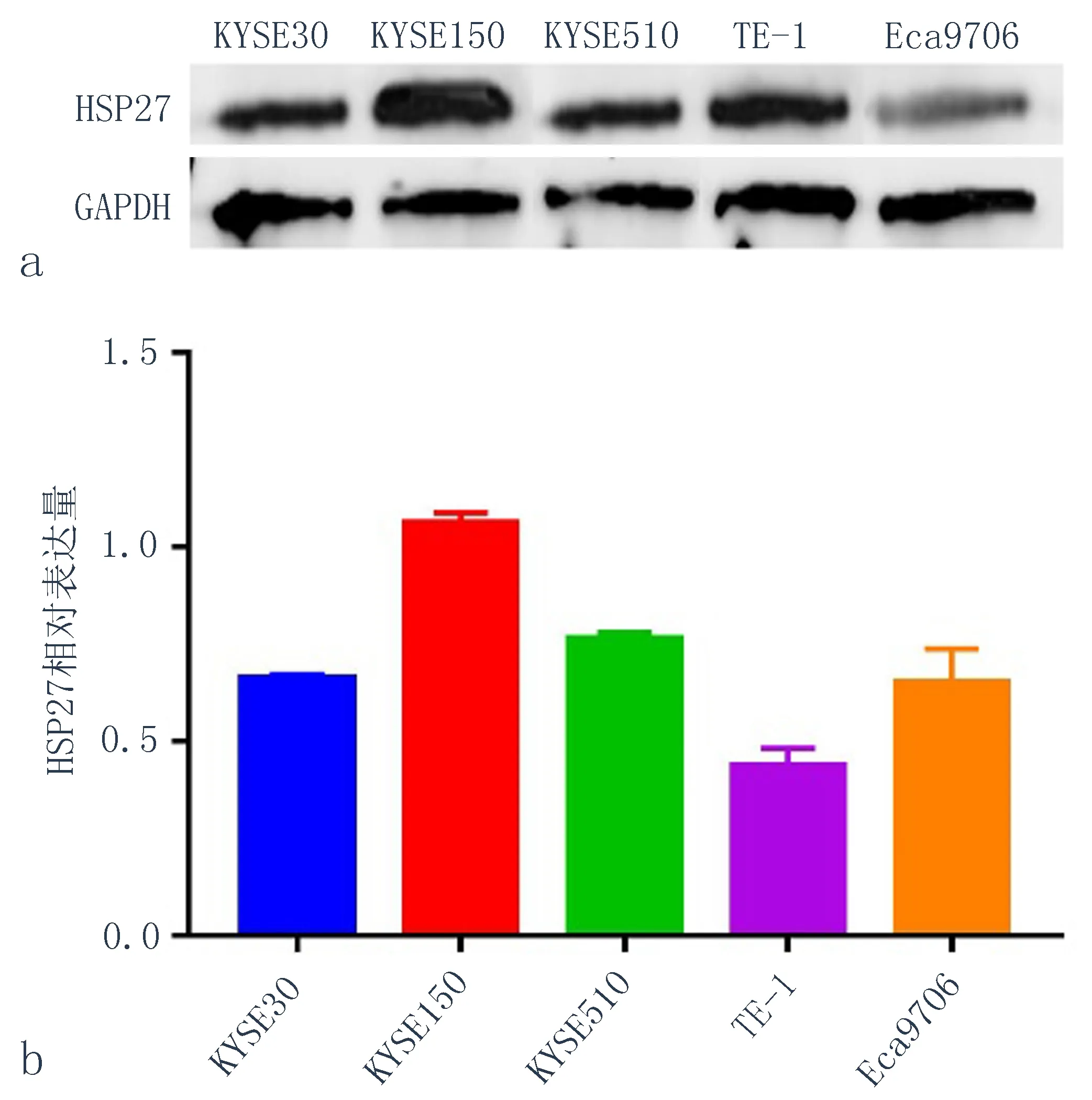
图1 HSP27在5种食管癌细胞系中的表达水平
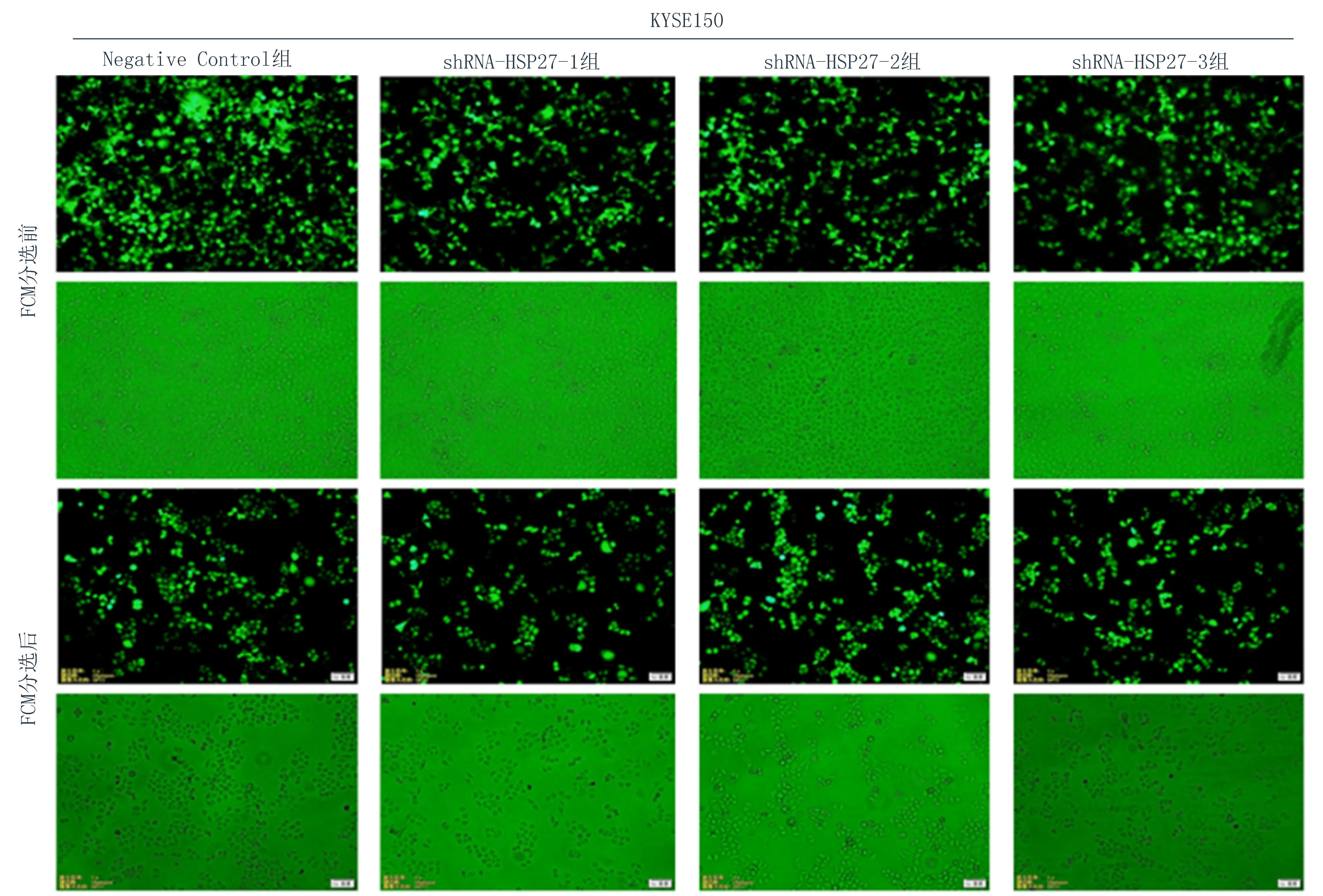
图2 慢病毒包装HSP27干扰载体转染KYSE150细胞系后荧光结果(放大倍数×100)
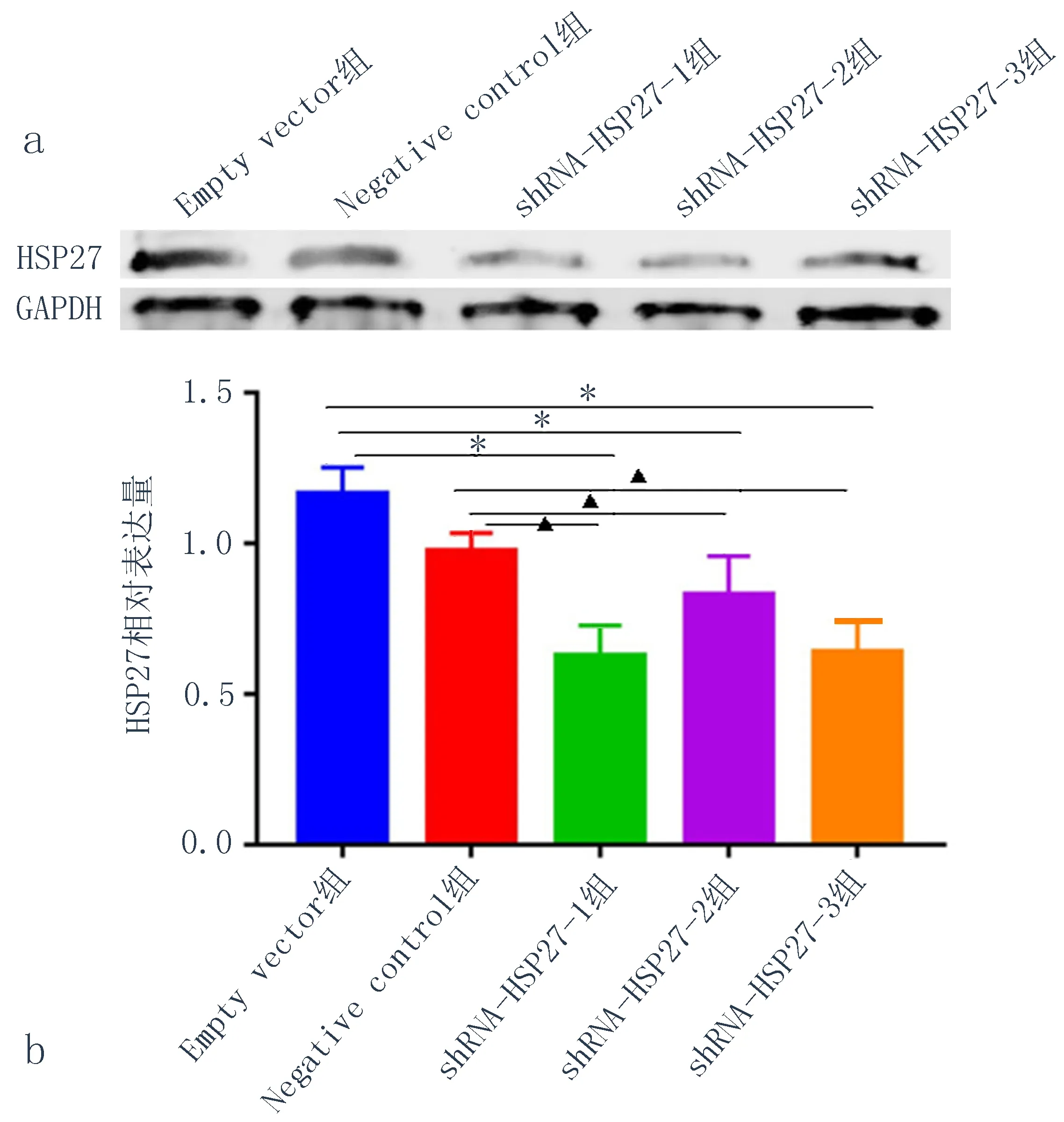
图3 KYSE150转染shRNA-HSP27后各组HSP27表达水平
注: a:HSP27敲低后表达量; b:HSP27敲低后相对表达量, 与Empty vector组比较,*P<0.05;与Negative control组比较,▲P<0.05。
2.3敲低HSP27表达后抑制KYSE150细胞的增殖能力转染慢病毒的3个实验组中细胞增殖能力受到抑制(图4),在细胞生长72 h和96 h抑制作用最明显,与Empty vector 组和Negative control组相比,差异有统计学意义(P<0.05),说明敲低HSP27抑制了KYSE150细胞的增殖。
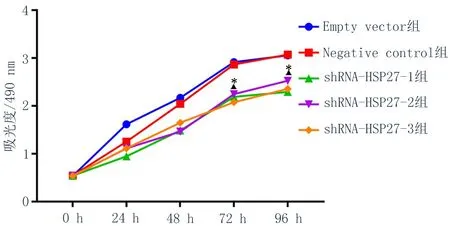
图4 KYSE150转染shRNA-HSP27后细胞增殖能力
注: 与Empty vector组比较,*P<0.05; 与Negative control组比较,▲P<0.05。
2.4敲低HSP27表达后抑制KYSE150细胞的侵袭能力慢病毒转染敲低HSP27的3组KYSE150细胞系中细胞的侵袭能力明显下降(图5),结果可见与Empty vector 组和Negative control组相比,shRNA-HSP27-1、shRNA-HSP27-2、shRNA-HSP27-3这3组中侵袭到下室中的细胞数量明显减少(P<0.05),提示HSP27下调可以减弱KYSE150细胞的侵袭能力。
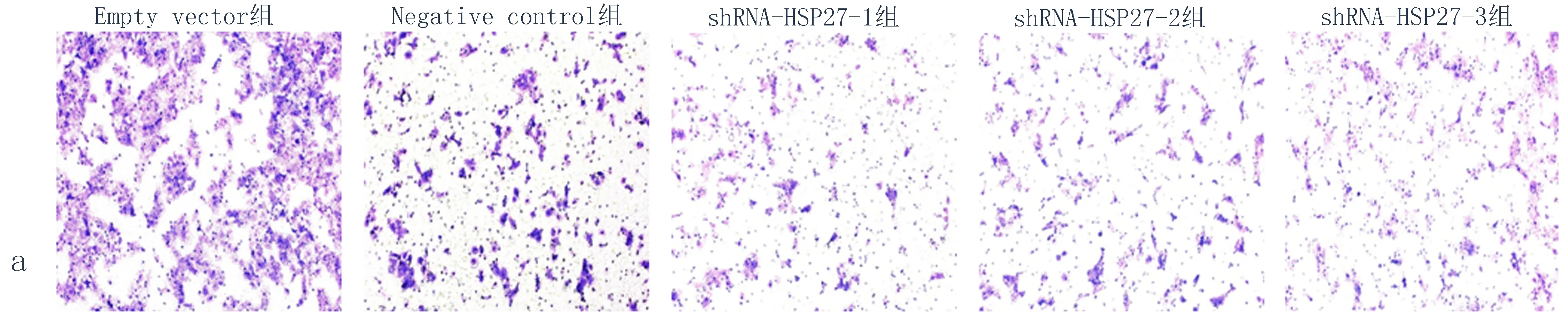
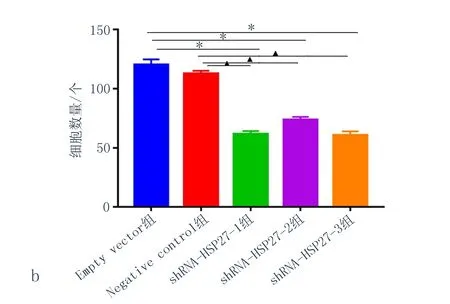
图5 KYSE150转染shRNA-HSP27后细胞侵袭能力
注: a: 结晶紫染色图,×100; b:穿基质胶进入下室的细胞个数统计分析图, 与Empty vector组比较,*P<0.05; 与Negative control组比较,▲P<0.05。
2.5敲低HSP27表达后抑制KYSE150细胞的迁移能力与Empty vector 组和Negative control组相比,HSP27表达下调的3组中划痕宽度较宽(图6),尤其在48 h和72 h时对比最为明显,差异具有统计学意义(P<0.05),说明敲低HSP27可以抑制KYSE150细胞的迁移能力。

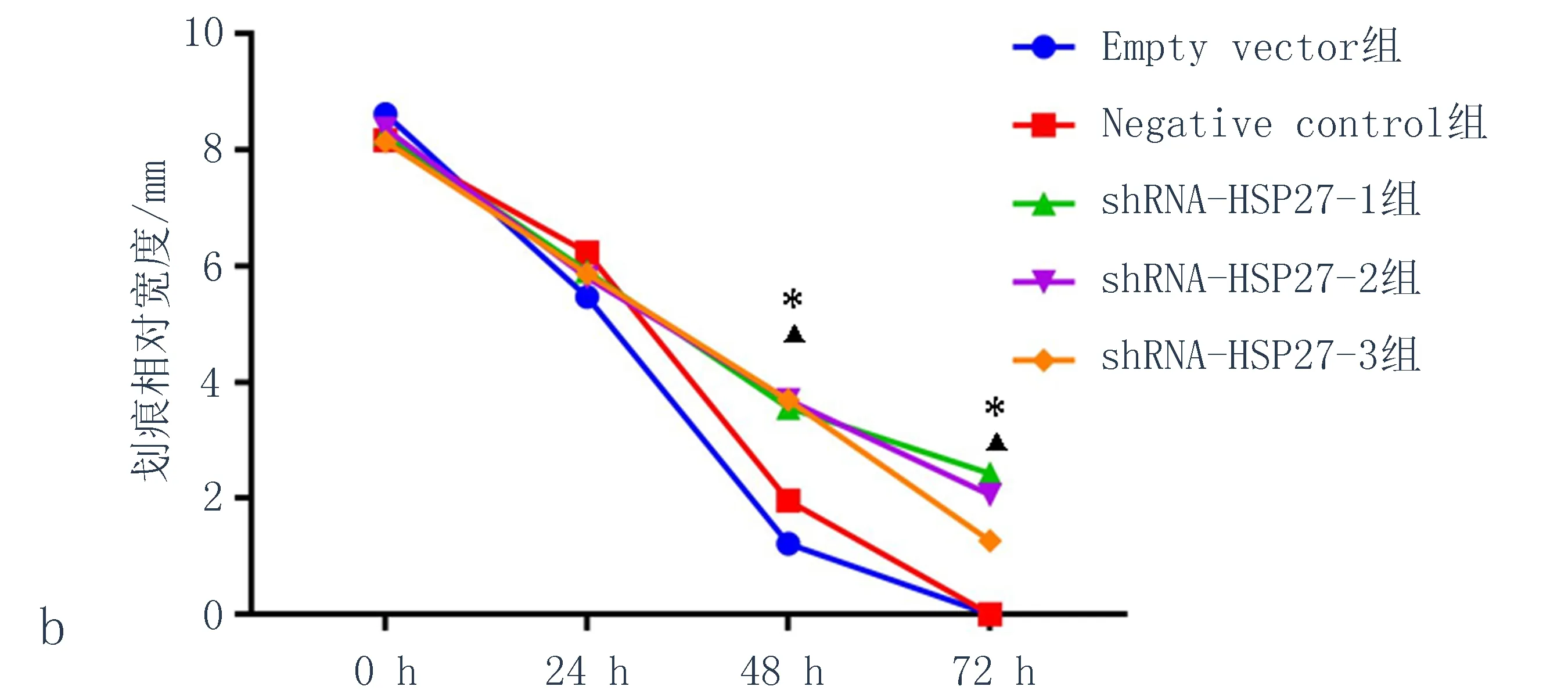
图6 KYSE150转染shRNA-HSP27后细胞迁移能力
注: a: 划痕图片, ×100; b: 划痕相对宽度统计分析图, 与Empty vector组比较,*P<0.05, 与Negative control组比较,▲P<0.05。
3 讨论
HSPs家族是在生物界中广泛存在的一类高度保守的热应激蛋白质[9-10]。当机体处于应激条件下,就会激发合成热休克蛋白,作为分子伴侣以防止蛋白质聚集,对抗细胞死亡,从而调节细胞的生存和死亡的平衡[11]。HSP27作为HSPs家族中的成员之一是肿瘤细胞侵袭转移的主要调控因子之一[12]。Ye等[13]研究发现在神经胶质瘤中,HSP27激活葡萄糖-6-磷酸脱氢酶(G6PD)以维持神经胶质瘤细胞中的NADPH和戊糖生成,保护细胞免受氧化和DNA损伤应激。Hung等[14]研究揭示了HSP27高表达的肝细胞癌患者常出现不良预后且较易发生转移。Ge等[15]发现HSP27和SUMO2/3相互作用,共同促进肝癌细胞增殖和侵袭。综上所述,HSP27在肿瘤发生发展中起着积极的作用,但在食管癌中鲜少出现报道,具体机制有待深入研究。
本研究应用分子生物学技术检测了食管鳞状细胞癌中HSP27蛋白表达水平,同时探究其对食管鳞状细胞癌细胞系KYSE150的恶性表型的影响,结果显示,HSP27在食管鳞状细胞癌各细胞系中均显著高表达,敲低HSP27后,KYSE150细胞增殖、侵袭和迁移能力受到抑制,提示HSP27可促进食管鳞状细胞癌细胞增殖、侵袭和迁移,该研究结果为深入研究HSP27在食管鳞状细胞癌中的调控机制以及食管癌临床分子靶向治疗提供了可参考依据。
