PTEN通过抑制PI3K/AKT-mTOR通路增强卡博替尼抗肿瘤作用
2019-04-18肖志中陈旭义王振国张景童
肖志中,韩 光,周 娟,陈旭义,王振国,张景童,刘 洋
(1.中国人民武装警察部队特色医学中心 泌尿外科,天津 300162;2.中国人民武装警察部队特色医学中心 脑科中心,天津 300162;3.中国人民武装警察部队特色医学中心 医教部,天津 300162;4.中国人民武装警察部队后勤学院 二大队,天津 300309;5.上海市第四人民医院 神经内科,上海 200000)
肾细胞癌(renal cell carcinoma,RCC)占成人恶性疾病的2%~3%,是男性常见肿瘤的第7位,女性常见肿瘤的第10位[1],且RCC的发病率会随人口年龄的增长而进一步上升[2]。目前,世界卫生组织将RCC分为透明细胞癌、乳头状细胞癌以及嫌色细胞癌。其中,75%~90%为透明状细胞癌,10%~15%为乳头状细胞癌,4%~5%为嫌色细胞癌[3]。定位于染色体10q23上的PTEN基因可以抑制多部位癌细胞的增殖[4]。PTEN可以介导蛋白的磷酸化作用,3,4,5-三磷酸脂酸肌醇(phosphatidylinositol-3 kinase,PIP3)是PTEN的最常见的底物。PIP3是细胞内信号通路的第二信使,D3位点上被PTEN磷酸化后可以直接抑制PI3K的活性,参与PI3K/AKT信号通路的负性调节[5]。PIP3/PI3K-AKT信号通路主要调节细胞的新陈代谢、细胞增殖和细胞迁移,并且在肿瘤的发生发展过程中有着至关重要的作用。肿瘤的发生,通常会引起PTEN的功能紊乱、变异或者沉默,造成PI3K/AKT信号通路的活化。先前的研究中发现,肿瘤产生的药物耐受性,也很可能是因为PTEN的功能紊乱而导致的[6],PTEN的功能紊乱同时也会显著提高肿瘤入侵和迁移能力。本实验就卡博替尼对肾透明细胞癌的治疗作用进行了探索,为卡博替尼的临床应用提供了一定的实验依据。
1 材料与方法
1.1 试剂 RPMI-1640(80002)、胎牛血清(FBS)(10100147)、高糖DMEM培养基(H-DMEM)(11995065)、GultaMax(25030081)购自Gibco公司;盘尼西林-链霉素混合试剂(P1400)、MTT试剂盒(M1020)购自索莱宝生物科技公司;EcoRI(R0101L)、XhoI(R0146L)购自NEB公司;Hieff Trans脂质体核酸转染试剂(40802ES01)、G418购自翊圣生物公司;Cabozantinib(S1119)、SF1670(S7310)购自Selleck公司;动物组织/细胞RNA提取试剂盒(CW0584)、HiFi-Script cDNA第一链合成试剂盒(CW2569)、Super TaqMan一步法荧光定量PCR试剂盒(CW2695)购自康为世纪公司;SUCLG2(ab187996)、ACO2(ab110321)、p53(ab26)、Bcl-2(ab692)、BAX (ab182733)、增殖细胞核抗原(PCNA)(ab29)、AKT(ab8805)、p-AKT(ab38449)、mTOR(ab2732)、p-mTOR(ab109268)抗体购自Acam公司;786-O细胞(TCHu186)购自中科院上海典藏细胞库。
1.2 载体构建 通过聚合酶链反应获得PTEN的cDNA,所用引物序列为:上游引物5’-CGGAATTCGGATGTCCCGAAAGCAGG-3’;下游引物:5’-CCGCTCGAGTCAGATGTTGAGCGG-3’。PCR产物和pCDA3.1 -3×Flag载体用EcoRI和XhoI进行双酶切,酶切后的引物片段及载体进行过夜连接以构建pCDA3.1 -3×Flag-PTEN过表达质粒。按照Hieff Trans脂质体核酸转染试剂说明书,将pCDA3.1 -3×Flag-PTEN过表达质粒载体及空白质粒转入786-O细胞,通过1 000 μg/mL的G418筛选稳定表达的786-O细胞。
1.3 细胞培养和分组 于37 ℃,5% CO2环境下使用含10%胎牛血清的RPMI-1640培养基培养786-O细胞。将786-O细胞分为6组:对照组(NC),卡博替尼处理组(NC+C),PTEN抑制剂组(PI),卡博替尼处理合并PTEN抑制剂组(PI+C),PTEN过表达组(PO)以及卡博替尼合并PTEN过表达组(PO+C)组。分别用5 μM,10 μM和20 μM卡博替尼处理NC+C、PI+C和PO+C细胞24 h,筛选合适浓度的卡博替尼在后续实验中对细胞进行处理,实验前使用无菌PBS清洗,移除残留的卡博替尼。
1.4 MTT实验检测各组细胞存活率 参照之前的研究进行MTT实验[7]。细胞接种于96孔板上,每孔接种密度控制在1×104左右。当细胞融合度达到80%~85%时,在培养基中加入不同浓度的卡博替尼。加药24 h后,使用无菌的PBS清洗细胞去除多余的卡博替尼。加入MTT使其终浓度为5 mg/mL,继续孵育4 h。孵育结束后,终止培养,加入DMSO,选择560 nm波长,在全波长酶标仪上测定各孔光吸收值,每组各做3个复孔计算细胞生存率。细胞生存率=(1-加药组OD值/对照组OD值)×100%。
1.5 RNA提取和反转录 按照动物组织/细胞RNA提取试剂盒说明书进行RNA提取实验。细胞裂解后在室温下静置孵育5 min,随后在12 000 rpm离心5 min。向溶液中加入乙醇,并将混合物转移至吸附柱,12 000 rpm离心1 min,使RNA与吸附柱结合。清洗缓冲液清洗吸附柱后,用无RNA酶水洗脱RNA。洗脱后得到的溶液用ND-2000分光光度计测量RNA的浓度。取相同量的RNA进行反转录实验。按照反转录试剂盒说明书配制反应混合物,混合物于42 ℃反应15 min,随后与85 ℃反应5 min,即得到cDNA。
1.6 实时荧光定量PCR(qPCR)检测p53、BAX和Bcl-2基因的表达量 qPCR反应条件如下:预变性95 ℃,30 s;变性95 ℃,5 s;退火55 ℃,30 s以及延伸72 ℃,30 s,进行40个循环。循环阈值(CT)根据扩增后的荧光信号进行计算设置。2-ΔΔCt方法计算基因的相对表达量[8]。GAPDH作为内参,并以GAPDH为标准,对目的基因表达进行定量。每组实验均独立重复3次,扩增引物序列见表1。
表1引物序列

基因名引物名称引物扩增长度BCL-2上游引物5’-CGACGACTTCTCCCGCCGCTACCGC-3’415bp下游引物5’-CCGCATGCTGGGGCCGTACAGTTCC-3’BAX上游引物5’- TGCAGAGGATGATTGCTGAC-3’316bp下游引物5’-GAGGACTCCAGCCACAAAGA-3’p53上游引物5’-TCCTCCCCAACATCTTATCC-3’501bp下游引物5’-GCACAAACACGAACCTCAAA-3’GAPDH上游引物5’-CGGATTTGGTCGTATTGGG-3’283bp下游引物5’-TGCTGGAAGATGGTGATGGGATT-3’
1.7 Western blot检测PI3K/AKT/mTOR信号通路、凋亡相关蛋白和三羧酸循环关键酶的表达量 蛋白提取前,用预冷的PBS清洗每组的细胞样品,随后使用RIPA裂解缓冲液裂解细胞。裂解后样品于12 000 rpm离心10 min,收集上清,并通过BCA实验确定蛋白样品浓度。每组取相同量的蛋白进行SDS-PAGE电泳,电泳结束后,用半干法将蛋白样品转移至0.22 μm的硝酸纤维素膜上。5%脱脂牛奶室温封闭1 h, SUCLG2、ACO2、p53、Bcl-2、BAX、PCNA、AKT、p-AKT、mTOR、p-mTOR一抗(1∶1 000稀释)于4℃孵育过夜。孵育结束后,与室温下羊抗兔二抗(1∶5 000)孵育1 h。ECL发光法检测目的蛋白的表达,Scion Image软件对条带的灰度值进行分析。GAPDH作为内参对目的蛋白进行均一化处理。

2 结果
2.1 卡博替尼对786-O细胞增殖的影响 MTT实验结果显示,卡博替尼抑制786-O细胞的增殖,并呈现剂量相关的影响(见图1)。加药5 μM卡博替尼24 h后,细胞生存率为(90.3±4.86)%,在10 mg/mL卡博替尼实验组,细胞生存率为(73.60±3.12)%,在20 μM卡博替尼实验组中,生存率降为(52.4±2.1)%。通过实验数据,可得在加药浓度为10 μM和20 μM实验组中,卡博替尼显著地抑制了786-O细胞的生存率(P<0.05)。因此,我们拟定使用10 μM卡博替尼进行后续实验,在此浓度下卡博替尼在抑制786-O细胞生存率同时多数细胞依然可以存活。
2.2 AKT/mTOR信号通路中分子表达水平 各组中p-AKT/AKT和p-mTOR/mTOR的比值如图2所示。NC+C组及PI+C组与其对应的对照组相比,其p-AKT/AKT比值并无显著差异。PO+C组与对照组及PO组相比其p-AKT/AKT比值显著降低(P<0.05)。p-mTOR/mTOR在各组中的比值呈现出于p-AKT/AKT类似的变化趋势。卡博替尼处理后,各组p-mTOR/mTOR表达量均出现下降。与PI组相比,PI+C组中p-mTOR/mTOR比值显著降低(P<0.05)。而PO+C组中p-mTOR/mTOR的比值对比NC组显著降低(P<0.05)。

MTT实验显示卡博替尼对于786-O细胞增殖的影响,并呈现剂量依赖效应(n=3)。*:与相应对照组相比P<0.05;#:与NC组相比P<0.05。图1 卡博替尼对于786-O细胞增殖的影响

A:Western blotting检测AKT,p-AKT,mTOR和p-mTOR的表达水平; B:细胞内p-mTOR/mTOR比值的定量分析;GAPDH作为Western blotting分析的内参(n=3);C:细胞内比值的定量分析。*:与相应对照组相比P<0.05;#:与NC组相比P<0.05。图2 卡博替尼对于AKT/mTOR信号通路的影响
2.3 凋亡相关分子表达的变化 如图3所示,对比NC组,在NC+C组中p53的表达量略有下降,但无统计学差异。PI组中p53的表达与NC组相比显著降低(P<0.05),PI+C组中p53的表达与PI组相比显著增加而与NC组相比显著降低(P<0.05)。PO组及PO+C组中p53表达与NC组相比无明显改变。此外,卡博替尼处理会增加BAX的表达量,PI+C组及PO+C组中,与对应的对照组相比出现显著增加(P<0.05)。与NC组相比,PI及PI+C组中BAX的表达量显著降低(P<0.05),而PI+C组中BAX表达量则显著增加(P<0.05)。此外,NC+C组以及PO+C组中BCL-2的表达量与其对应对照组相比显著降低(P<0.05),PO组中BCL-2表达量与NC组相比出现显著降低(P<0.05,见图4)。

A:Western blotting检测p53,BAX和Bcl-2的表达量;B:p53表达水平的定量分析;C:Bcl-2表达水平的定量分析;D:BAX表达水平的定量分析;GAPDH作为Western blotting分析的内参(n=3)。*:与相应对照组相比P<0.05;#:与NC组相比P<0.05。图3 Western blotting检测卡博替尼对凋亡相关分子表达水平的影响

A:细胞内p53基因相对表达量;B:细胞内BAX基因相对表达量;C:细胞内Bcl-2基因相对表达量。*:与相应对照组相比P<0.05;#:与NC组相比P<0.05。 图4 qPCR检测卡博替尼对于凋亡相关分子基因水平表达量的影响
2.4 卡博替尼处理后糖代谢相关分子表达水平 卡博替尼处理后,AOC2和SUCLG2的表达水平变化(见图5)。与对应的对照组相比,在NC+C和OP+S组中ACO2的表达显著上升(P<0.05),同时,对比NC组,在PI,PI+P和PO组中ACO2的表达量也呈显著增加(P<0.05)。然而,SUCLG2的表达水平出现不同的趋势。在NC+P,PI+P和PO+P组中,卡博替尼明显的抑制了SUCLG2的表达(P<0.05),而对比NC组,PO和PO+P组中SUCLG2表达量也显著下降(P<0.05)。
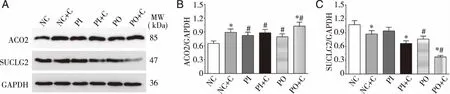
A:ACO2和SUCLG2的Western blot电泳结果;B:ACO2相对定量;C:SUCLG2相对定量。*:与相应对照组相比P<0.05;#:与NC组相比P<0.05。 图5 卡博替尼对于786-O细胞中TCA循环关键酶的影响
3 讨论
RCC是最常见的泌尿系统肿瘤之一,已逐渐上升至第九大癌症病因[9]。在肾细胞癌的3种亚型中,将近95%是透明细胞癌,其5年生存率仅为74%。最近的研究发现,患者的年龄、肿瘤TNM分级与RCC的预后密切相关[10]。此次研究构建了PTEN表达抑制及PTEN过表达的细胞,并且通过实验发现,卡博替尼通过抑制PI3K/AKT/mTOR信号通路和糖代谢来抑制786-O细胞的增殖,从而引起786-O细胞的凋亡最终起到抗肿瘤效应。同时发现,PTEN可能会增强卡博替尼对于透明细胞癌的作用,呈现协同效应。
PTEN是一种肿瘤抑制基因,通过控制细胞磷脂酸酶的活性来调节细胞的增殖从而达到抑制肾细胞癌、乳腺癌和前列腺癌细胞生长的作用[11]。PTEN的磷酸酶活性大部分聚集在其碳端区域,其磷酸化能够改变PTEN的亚细胞定位,而PTEN活性位点的变异以及脂磷酸酶活性丧失与癌症的发生有着密切的关系[12-14]。因此,本次实验针对细胞内PTEN位点进行改造,以观察PTEN对药物治疗作用的影响。PI3K/PTEN/AKT信号通路与细胞的生长密切相关,信号通路的功能紊乱或者异常都会引起细胞的异常生长,最终引起肿瘤的发生[15]。大量癌症细胞中均发现PIK3/AKT信号通路的活化,这一信号通路与癌症细胞的持续生长和不良预后相关。PI3K/AKT的下游分子mTOR的活性与癌症细胞的发展也密切相关。此前的研究发现,抑制mTOR的表达通过抑制细胞中的自噬作用,大大提高药物的抗肿瘤效应[16]。此次研究中,卡博替尼作用细胞后,PI3K/AKT/mTOR信号通路的活性受到明显的抑制,这一趋势在PTEN过表达模型中更加显著,抑制PTEN表达将会削弱这一作用。实验结果表明,卡博替尼通过抑制PI3K/AKT/mTOR信号通路的活性,抑制肿瘤细胞的增殖,从而发挥抗肿瘤作用。PTEN过表达则会进一步增强卡博替尼对肿瘤细胞的抑制作用,发挥协同作用。
Bcl-2家族和p53都是细胞凋亡的重要调节因子,在细胞凋亡的调节过程中有着重要的作用。BAX和Bcl-2都是Bcl-2家族的成员,BAX,Bcl-2和p53也是PIK3/AKT/mTOR信号通路下游分子,在细胞凋亡过程中起到重要的作用。在正常组织中,p53执行多种功能,包括细胞周期调节,细胞稳态维持以及细胞凋亡。但p53的变异会诱导癌症发生,超过50%癌症患者体内的转录因子p53发生了变异。进一步的研究发现,p53的表达在人体癌变组织中经常被抑制[17]。因此,p53被认为是一种抑癌基因。PTEN可以与p53直接相互作用,通过Mdm2抑制p53的降解,进而增强p53的表达[18]。此外,p53可以直接激活PUMA的表达活性,PUMA在Bcl-2同源物3(BH3)域上与Bcl-2或Bcl-XL结合,诱导BAX的表达[19]。此次研究结果显示,卡博替尼处理细胞后会在基因和蛋白水平增加细胞内p53的表达,从而抑制肿瘤细胞的增殖,当PTEN过表达后,会进一步放大这种效应,而PTEN表达抑制后则会减弱这一效应。BAX属于Bcl-2家族,也是一种肿瘤抑制蛋白,在细胞自身凋亡过程中起着重要的作用[20]。BAX定位于线粒体外膜上,在外界促凋亡刺激因子及p53作用下被激活和移位,是诱导细胞凋亡起始的重要环节[21]。BAX可以促进线粒体中细胞色素C的释放,并且活化多种细胞凋亡蛋白酶,诱发肿瘤细胞中的凋亡过程。此次研究结果表明,卡博替尼可以从蛋白和转录水平增加BAX的表达,且过表达PTEN将会增强这一趋势,抑制PTEN将会减弱这一趋势,从而促进肿瘤细胞的凋亡。Bcl-2是Bcl-2家族中抗细胞凋亡蛋白,在人体肿瘤组织中发现Bcl-2家族中例如Bcl-2和Bcl-XL等抗凋亡基因的表达上调[22]。Bcl-2的过表达不仅与肿瘤细胞发生和延续密切相关,同时也与肿瘤细胞对化疗药物的耐药型有着密切的关系[23]。卡博替尼处理后会在蛋白和转录水平降低Bcl-2的表达量, PTEN的过表达则会加强这一效应,进而减弱细胞内的抗凋亡进程,促进肿瘤细胞的凋亡。上述结果表明,卡博替尼可以活化细胞凋亡过程并且抑制抗细胞凋亡相关蛋白的表达,引起肿瘤细胞的凋亡而发挥抗肿瘤作用。PTEN过表达会增强这一作用,而PTEN表达敲低则会减弱这一作用。
快速增殖是肿瘤细胞的基本特征,为了维持肿瘤细胞新陈代谢的需要,新陈代谢过程将会发生变化,加大葡萄糖的摄取和优先利用是其重要的特征之一[24-25]。三羧酸循环是细胞内糖类化合物转换成能量的关键步骤,参与许多生理学进程。近期研究发现,癌细胞中的TCA循环是与正常细胞不同,谷氨酰胺等非糖类化合物均可用来供给能量,以满足其代谢的需求[26]。由此我们推测,卡博替尼的抗肿瘤作用可能与TCA循环相关分子表达量的改变有关,从而影响肿瘤细胞内的有氧氧化过程。ACO2和SUCLG2是TCA循环中的关键酶。ACO2通过中间产物顺乌头酸可逆催化柠檬酸生成异柠檬酸,SUCLG2是琥珀酰辅酶A合成酶的亚基,可以可逆催化琥珀酰辅酶A和琥珀酸酯的形成。卡博替尼对于这两种酶的作用呈现相反的趋势,作用细胞后,出现ACO2的表达的上调和SUCLG2的表达的下调。在PTEN过表达后,上述作用得到进一步增强,而PTEN表达抑制后上述作用则被削弱。上述结果表明,卡博替尼的抗肿瘤作用可能与其抑制肿瘤细胞TCA循环关键酶,进而减少肿瘤细胞的能量供应,诱导细胞的凋亡,发挥抗肿瘤作用,PTEN表达的增加则会增强卡博替尼的抗肿瘤作用。
此次研究中发现,卡博替尼通过抑制肿瘤细胞内PI3K/AKT/mTOR信号通路的活性以及肿瘤细胞内TCA循环关键酶的活性,抑制细胞的有氧氧化过程,减少细胞功能,进而在诱导促凋亡蛋白表达的同时抑制抗凋亡蛋白的表达,最终诱导肿瘤细胞的凋亡,发挥抗肿瘤作用。而PTEN过表达后,卡博替尼的抗肿瘤作用得到了增强,在PTEN表达降低后,卡博替尼的抗肿瘤作用出现了减弱,表明PTEN的表达与卡博替尼的抗肿瘤作用可能存在协同效应,有可能成为未来治疗ccRCC的新策略。
