BiVO4/MOF复合材料的合成及其光催化性能
2019-04-18翟勃银梁宇宁李永超梁宏宝
翟勃银, 陈 颖,*, 梁宇宁, 李永超, 梁宏宝
(1. 东北石油大学 化学化工学院, 石油与天然气化工省重点实验室, 黑龙江 大庆 163318; 2. 东北石油大学 机械科学与工程学院, 黑龙江 大庆 163318)
在过去的几十年中,金属-有机框架(MOFs)作为一种新型的多孔晶体材料引起了研究者的广泛关注[1]。MOFs由金属离子或金属团簇和多功能有机配体自组装而成,具有多活性位点、高孔隙率和高比表面积等特性,使得MOF材料在气体储存与分离、催化、电子器件、药物运输等领域具有广阔的应用前景[2-4]。其中,Fe(Ⅲ)基MOF在可见光照射下对有机染料的降解表现出了优良的光催化活性。MIL-53(Fe)是一种三维多孔晶体材料,由无限一维的-Fe-O-O-Fe-O-Fe-链和双齿对苯二甲酸酯键交联而成;与传统的光催化半导体系统相比,MIL-53(Fe)存在小的Fe-O团簇,有利于推迟光生载流子的复合。因此,这种金属-有机结构可望有更好的光催化活性[5]。所以MIL-53(Fe)作为一种典型的含Fe(Ⅲ)-O团簇的MOF材料得到了前人们的广泛研究[6]。人们为将功能实体引入到这些材料中进行了广泛的研究工作,但制备具有优良光催化性能的MOF材料仍然是一个挑战。到目前为止,已经开发了许多MOF基纳米复合材料,其中,采用后合成修饰(PSM)方法对MOF材料进行改性的方法应用最广。例如,由Wang等[7]制备的In2S3@ MIL-125(Ti)复合材料对废水中的四环素表现出良好的去除性能;Liang等[8]制备的CdS-MIL-68(Fe)纳米复合材料在可见光下高效还原对硝基苯胺制对苯二胺。因此,可使用半导体材料对Fe(Ⅲ)基MOF进行修饰,降低电子空穴的复合速率,拓展其在光催化中的应用。
BiVO4是一种可见光光催化剂,其禁带宽度约为2.40 eV[9]。然而其产生的e-和h+会迅速复合,导致BiVO4的光催化活性降低,从而限制了BiVO4在光催化降解污染物中的实际应用。因此,对于提高BiVO4的可见光催化活性,提高载流子分离效率是一项迫切需要解决的问题[10]。为了抑制载流子复合,简单有效的方法就是设计异质结构。与杂质掺杂方法相比,不同禁带宽度的半导体间形成异质结具有很大的潜力,可以调节复合光催化剂所需的电子性质。此外,异质结结构可有效分离电子空穴对,扩大可见光吸收范围[11]。
经过能级分析可得知,MIL-53(Fe)的导带(CB)上产生的光电子移动到BiVO4的CB上,同时BiVO4的VB上的空穴可以转移到MIL-53(Fe)的VB上,降低光生电荷的复合速率,从而提高复合催化剂降解污染物的性能[12-15]。利用两种半导体材料各自的优异性能,得到BiVO4/MIL-53(Fe)复合材料,来降低光生电子与空穴复合速率。因此,采用简易水热法成功制备了BiVO4/ MIL-53(Fe)光催化剂,在可见光照射下,进行系列BiVO4/MIL-53(Fe)光催化降解RhB实验。为了评价该催化剂的实际应用价值,对其稳定性和可重复使用性进行了测试。并对该体系的光催化机理提出初步设想。
1 实验部分
1.1 催化剂的制备
1.1.1BiVO4的制备
采用水热法制备纯BiVO4[16]。首先将0.005 mol的Bi(NO3)3·5H2O完全溶于20 mL的HNO3(2 mol/L)中形成溶液A,然后将0.005 mol的NH4VO3溶于10 mL的NaOH(2 mol/L)溶液中形成溶液B。将B液缓慢滴加到A液中,磁力搅拌30 min,所得悬浮液用NaOH(1 mol/L) 调pH值为7,搅拌30 min,最后将混合液移至100 mL聚四氟乙烯反应釜中,在453 K下保持12 h,自然冷却至室温,用无水乙醇和水交替冲洗,得到黄色的BiVO4粉末。
1.1.2BiVO4/MIL-53(Fe)的制备
采用简单溶剂热方法合成了不同的BiVO4/MIL-53(Fe)复合材料。称取所制备的BiVO4样品于60 mL DMF中,超声使其均匀分散。再加入等物质量的H2BDC和FeCl3·6H2O,超声搅拌30 min形成均相溶液,转移入釜,150 ℃下保持12 h,泠却至室温,用乙醇多次离心洗涤,353 K下干燥10 h。其中,复合材料中Bi3+∶Fe3+物质的量比分别为1∶2、1∶1、2∶1,将其命名为BF-1、BF-2、BF-3。另外,在不加入BiVO4的情况下,用相同方法制备纯MIL-53(Fe)[17]。图1表示了BiVO4/MIL-53(Fe)复合材料的制备过程。
1.2 催化剂的表征
X射线粉末衍射( XRD) 采用日本理学 D/MAX-2200X 型射线衍射仪,辐射源为Cu 靶,Kα射线,以扫描速率 5(°)/min,5°-80°扫描。扫描电子显微镜( SEM/EDS)由德国卡尔公司SIGMA 500 型场发射扫描电子显微镜拍摄,电压 10 kV,观察催化剂形貌。使用北京彼奥德电子仪器公司 SSA-4300 型孔径比表面积分析仪进行氮气吸附-脱附实验(BET)。红外光谱分析(FT-IR) 使用德国BRUKER公司Tensor27型傅里叶变换红外光谱仪,溴化钾压片法测定。紫外可见漫反射分析使用Shimadzu公司UV-2550型紫外可见分光光度计测定。
1.3 催化剂的评价
取25 mg 所合成的样品,将其分散于RhB水溶液中超声30 min,然后将混合溶液在避光条件下暗反应30 min,使光催化剂与RhB分子达吸附-解吸平衡。将混合溶液置于300 W的氙灯下降解,定时收集1 mL溶液过滤分离,通过紫外可见分光光度计在553 nm测吸光度以确定RhB浓度(Ct),以Ct/C0比来评价催化剂的光催化降解效率。
此外,进行循环实验以探究光催化剂的可循环使用性,该过程与上文光催化实验步骤类似。当光催化剂循环使用后,收集并用去离子水和乙醇进行洗涤以达到去除残留RhB的目的,然后在353 K下进行干燥,以便进行下一步的测试。
2 结果与讨论
2.1 催化剂的表征
2.1.1粒子形貌
图2为BiVO4、MIL-53(Fe)及其复合材料BF-2的SEM照片。由图2(a)可知,纯BiVO4粒子直径为1-3 μm,呈表面光滑的多面体形状,并且暴露出高度活跃的(040)晶面[18]。由图2(b)可知,纯MIL-53(Fe)具有棒状结构,其长度约为几十微米,宽度为4-10 μm,这与以前报道的MIL-53(Fe)的形貌一致[19]。由图2(c)可以观察到MIL-53(Fe)作为载体,BiVO4纳米粒子负载于MIL-53(Fe)的表面,且MIL-53(Fe)形貌并无改变,这表明在MIL-53(Fe)结构未被破坏的情况下,成功合成了BiVO4/MIL-53(Fe)复合材料。通过EDS分析复合材料的微观区域元素分布,如图2(d)所示,EDS谱图中存在Bi、V、O、Fe和C元素的强信号,不存在杂质峰,表明BiVO4/MIL-53(Fe)复合材料的成功制备。

图 2 BiVO4(a)、MIL-53(Fe)(b)、BF-2(c)的SEM照片和BF-2(d)的EDS谱图
2.1.2晶体结构
用X射线衍射(XRD)对合成样品的晶体结构进行分析。图3(a)显示了BiVO4、MIL-53(Fe)和BiVO4/MIL-53(Fe)的XRD谱图。其中,BiVO4具有一系列窄而锐的衍射峰,在15.16°、18.98°、28.94°、30.58°和35.22°处的衍射峰归属于单斜白钨矿型BiVO4(JCPDS 14-0688)的(002)、(110)、(121)、(040)晶面。对于MIL-53(Fe),其晶面衍射与模拟MIL-53(Fe)XRD谱图相匹配[20]。对于BiVO4/MIL-53(Fe)复合材料的衍射峰,其与纯BiVO4没有显著差异,但在5°-18°存在属于MIL-53(Fe)的弱衍射峰,具体见图3(b)。这可能是由于复合材料中MIL-53(Fe)含量低所致[21],且随着Bi3+物质的量的增大,MIL-53(Fe)的峰逐渐变小。

图 3 BiVO4、MIL-53(Fe)及BiVO4/MIL-53(Fe)复合材料的XRD谱图(a)和BiVO4/MIL-53(Fe)在5°-18°的XRD谱图(b)
2.1.3FT-IR谱图
图4为BiVO4、MIL-53(Fe)和BiVO4/MIL-53(Fe)的红外光谱谱图。
其中,MIL-53(Fe)在1400-1700 cm-1所出的峰归属于芳香羧酸的伸缩振动,在1550 cm-1处的峰归属于与金属中心所连接配体的羧基伸缩振动,而在747 cm-1处的特征吸收峰归属于苯环的C-H的伸缩振动。此外,519 cm-1处Fe-O振动吸收峰表明配体的羧基与Fe(Ⅲ)之间形成了金属氧键[22]。对于BiVO4,在742和842 cm-1处的峰可分别归属于VO4单元V3(VO4)的V3不对称伸缩振动和VO4单元V1(VO4)的V1对称伸缩振动[23]。在BiVO4/MIL-53(Fe)(BF-1/2/3)复合材料中,可同时观察到MIL-53(Fe)和BiVO4的吸收峰,表示BiVO4/MIL-53(Fe)光催化剂的形成。
2.1.4比表面积和孔径分布
在77K下,用孔径比表面积分析仪测定合成样品的孔径与比表面积。如图5所示,MIL-53(Fe)的N2吸附-脱附等温线介于Ⅳ型和Ⅰ型吸附等温线,属于介孔和微孔材料[24],而BiVO4以及所有催化剂均表现为Ⅳ型吸附等温线,具有典型的H2型回滞环,表明均为介孔材料。

表 1 不同催化剂样品的比表面积和孔径
表1显示了光催化剂的比表面积和孔径。与BiVO4相比,当MIL-53(Fe)的含量增大时,BiVO4/MIL- 53(Fe)复合材料的比表面积从10.9 m2/g增大到20.5 m2/g,这是由于复合材料中较大比表面积的MIL-53(Fe含量增加所致。同时光催化剂的较大比表面积不仅可以增加催化剂对染料的吸附作用,还能提供更多的活性中心,从而促进光催化性能[25]。因此,与纯BiVO4相比,复合材料比表面积的增大可能有助于提高光催化性能[26]。
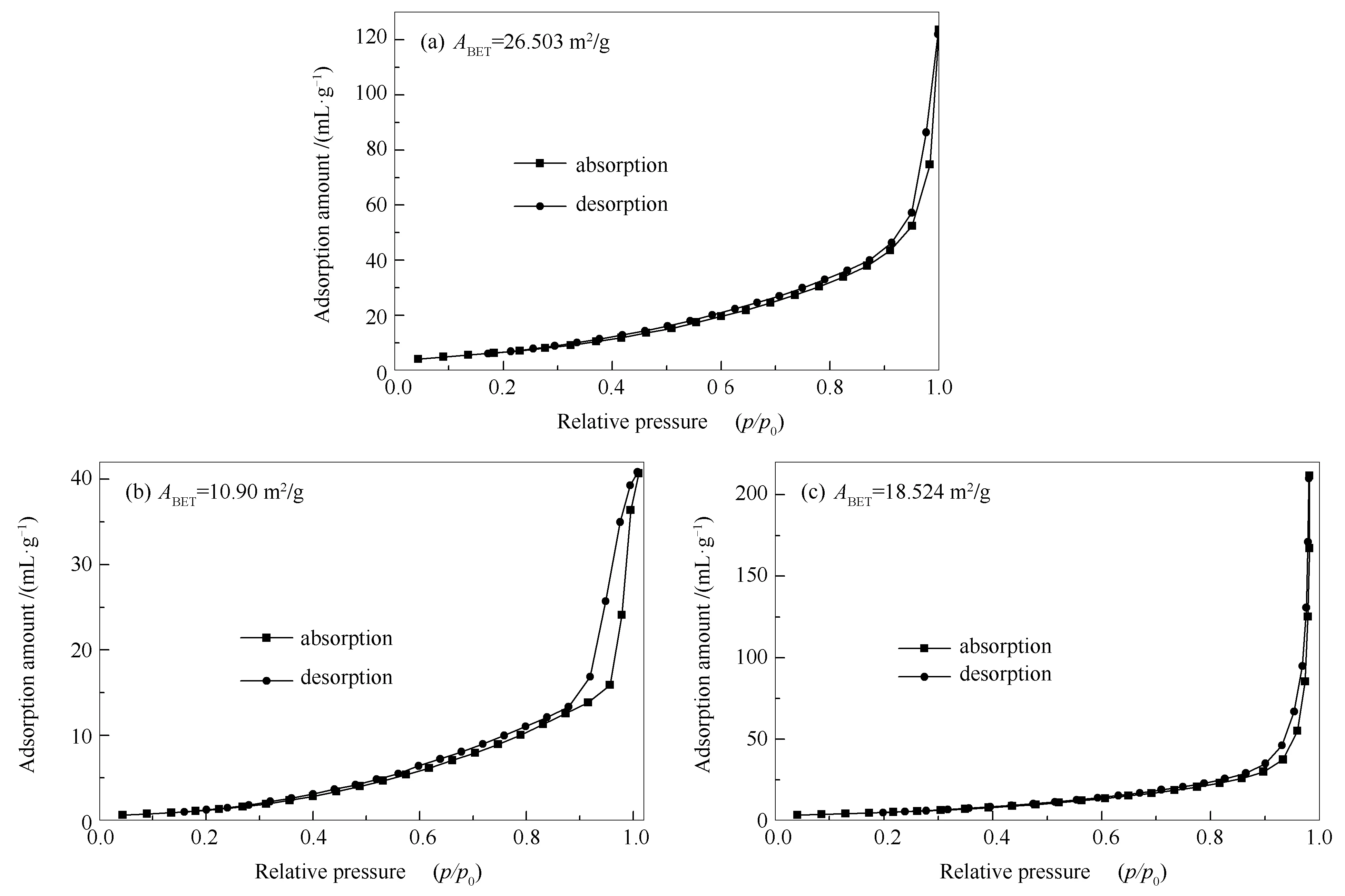
图 5 MIL-53(Fe) (a)、BiVO4 (b)及BF-2复合材料的N2吸附-脱附等温线及孔径分布
2.1.5光吸收性质
图6为BiVO4、MIL-53(Fe)和BiVO4/MIL-53(Fe)光催化剂的紫外-可见漫反射光谱谱图(UV-vis DRS)。

图 6 BiVO4、MIL-53(Fe)及BiVO4/MIL-53(Fe)复合材料的紫外可见漫反射光谱图(a)和(αhv)2与禁带宽度(hv)之间的关系图(b)
催化剂的光响应范围均位于可见光区,MIL-53(Fe)和BiVO4的吸收波长分别为455和 506 nm。由图6可知,BiVO4/MIL-53(Fe)复合材料对光的吸收能力明显高于纯MIL-53(Fe)和BiVO4。 其中,各样品的禁带宽度(Eg)可以按照αhv=k(hv-Eg)1/n进行估算[27]。其中,α、h、v、Eg和k分别表示吸收系数、Plank常数、光频率、禁带宽度和k常数。MIL-53(Fe)、BiVO4和BF-1/2/3的禁带宽度分别为2.72、2.45、2.35、2.39和2.41 eV。结果表明,BiVO4/MIL-53(Fe)复合材料具有纯MIL-53(Fe)和BiVO4混合吸收的特性,随着Bi3+含量的增加,BiVO4/MIL- 53(Fe)纳米复合材料的吸收边逐渐红移,表明材料的光响应范围有所扩大,且对可见光的利用率有所提高,从而有效改善纯BiVO4的光催化性能。
2.2 光催化活性评价
2.2.1催化剂对光催化降解RhB性能的影响
催化剂的实用性能取决于它们的光催化活性和稳定性。如图7(a)所示。在可见光照射下,BiVO4、MIL-53(Fe)、BF-1、BF-2和BF-3对RhB的降解率分别达到32%、43%、78%、93%、86%。其中,BF-2的光降解效率较高,这可归因于BiVO4/MIL-53(Fe)复合材料的形成促进了光生电子空穴对的有效分离,增强了催化剂的光催化活性[28]。采用伪一阶法对催化剂的光催化性能进行量化,具体见图7(b)。ln(C0/Ct)=kt为降解RhB的伪一阶模型。其中,C0和Ct表示RhB在0时和t时的浓度,k表示t时的伪一级速率常数。在相同条件下,BF-2的伪一阶反应动力学速率常数(k=0.02167),分别是纯MIL-53(Fe) (k=0.00418)和BiVO4(k=0.00267)的5.2倍和8.1倍。显然,与MIL-53(Fe)和BiVO4相比,BF-2具有更好的光催化性能,说明有效的电子转移可以降低电子空穴对的复合可能性,即光生载流子的迅速转移和光吸收能力的增强对提高光催化效率起着重要的作用。其中,k值、线性相关系数以及相应的半衰期t1/2见表2。
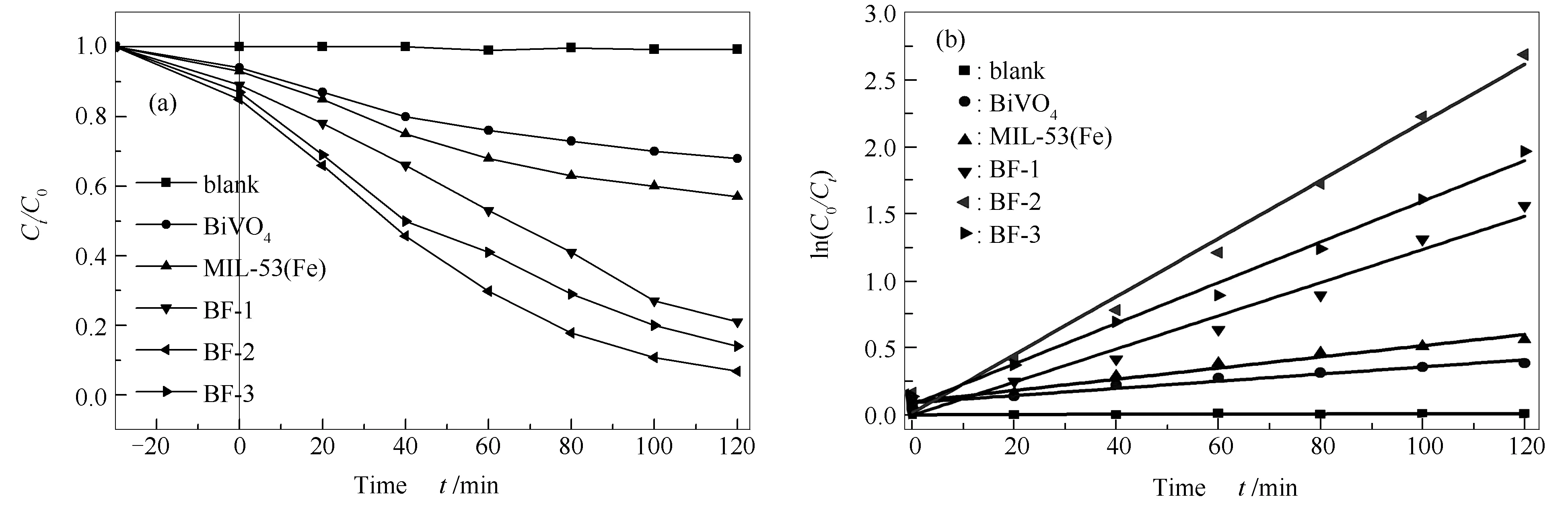
图 7 不同催化剂的光催化活性比较(a)和不同催化剂下光催化降解RhB的伪一阶动力学(b)
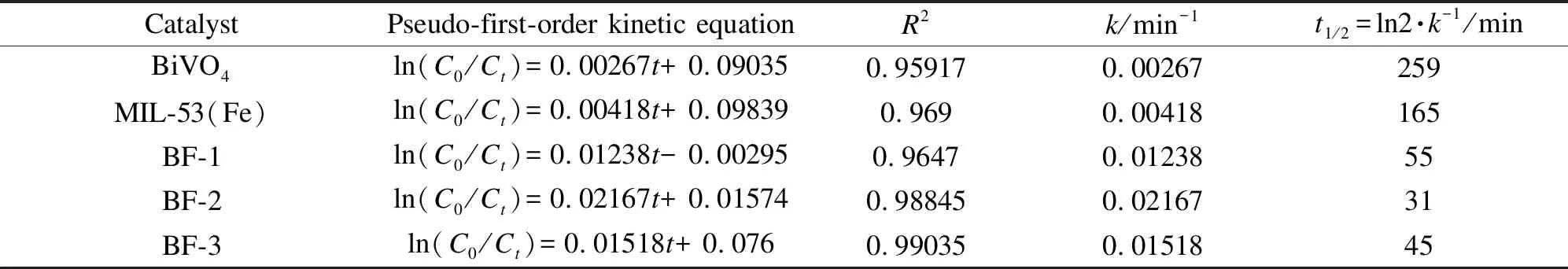
表 2 不同材料光降解RhB的伪一级动力学参数
2.2.2不同RhB初始浓度对催化剂光催化降解性能的影响
图8(a)为不同初始RhB浓度对催化剂光降解性能的影响。由图8(a)可知,随着RhB浓度从45 mg/L增加到50 mg/L,RhB降解率显著增加,这可能是因为在溶液中每个体积单位的RhB分子数量增加,因此,增大了活性自由基与RhB分子之间的有效接触。然而,随着初始RhB浓度进一步增加到60 mg/L,降解效率和降解速率都下降,这可能是由于RhB的摩尔消光系数较大,导致光在溶液中不能较好的渗透,从而降低了光利用效率[29],也可能是由于染料废水浓度过大,催化剂表面的活性位被染料分子占据,减少了活性基团的产生,导致降解效率下降。图8(b)显示BF-2光催化降解不同RhB浓度的伪一阶速率方程,其中,k值、线性相关系数以及相应的半衰期t1/2见表3,数据显示拟合图线性相关度较高,由此可得BF-2光催化降解RhB的反应符合一级反应特征。
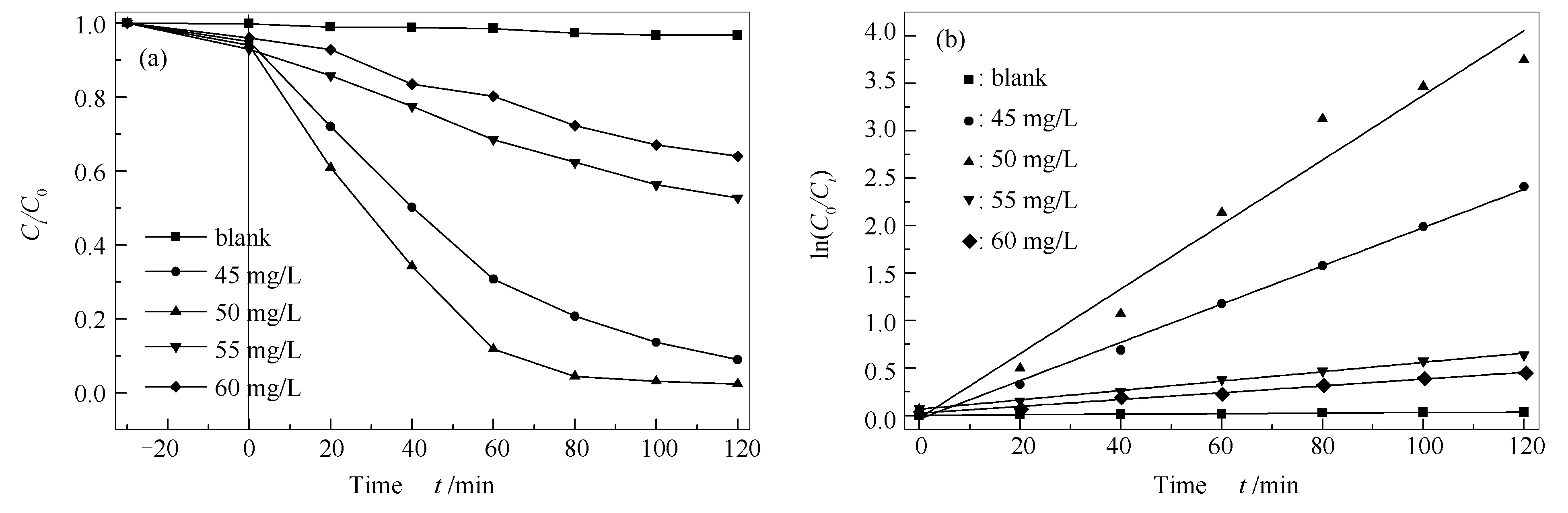
图 8 不同RhB浓度对光降解性能的影响(a)和降解不同RhB浓度的伪一阶动力学(b)
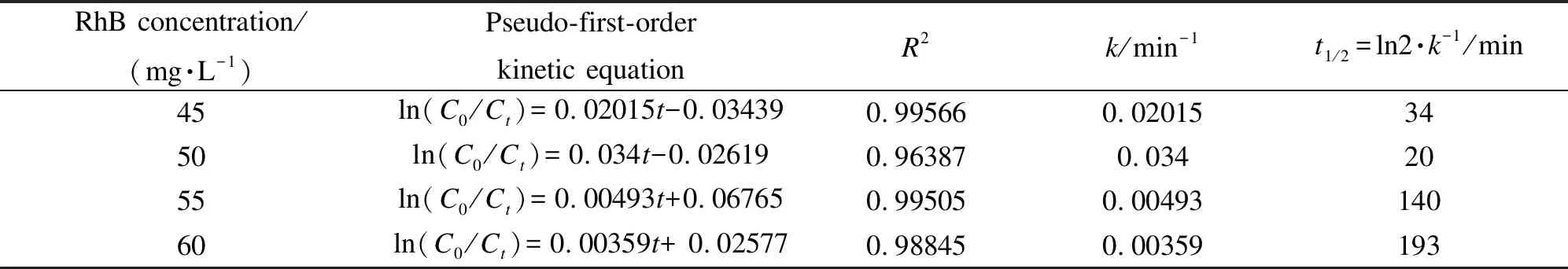
表 3 BF-2光降解不同RhB浓度的伪一级动力学参数
2.2.3再生和可重复使用性
在实际应用中,光催化剂的重复使用性和稳定性是鉴别其好坏的重要因素。为了评价催化剂的实际应用价值,研究了BF-2的可重复使用性和稳定性。如图9(a)所示,BF-2四次循环降解50 mg/L RhB溶液后的光催化活性并没有明显下降,表明BF-2样品具有较高的稳定性,可用于重复处理染料废水。
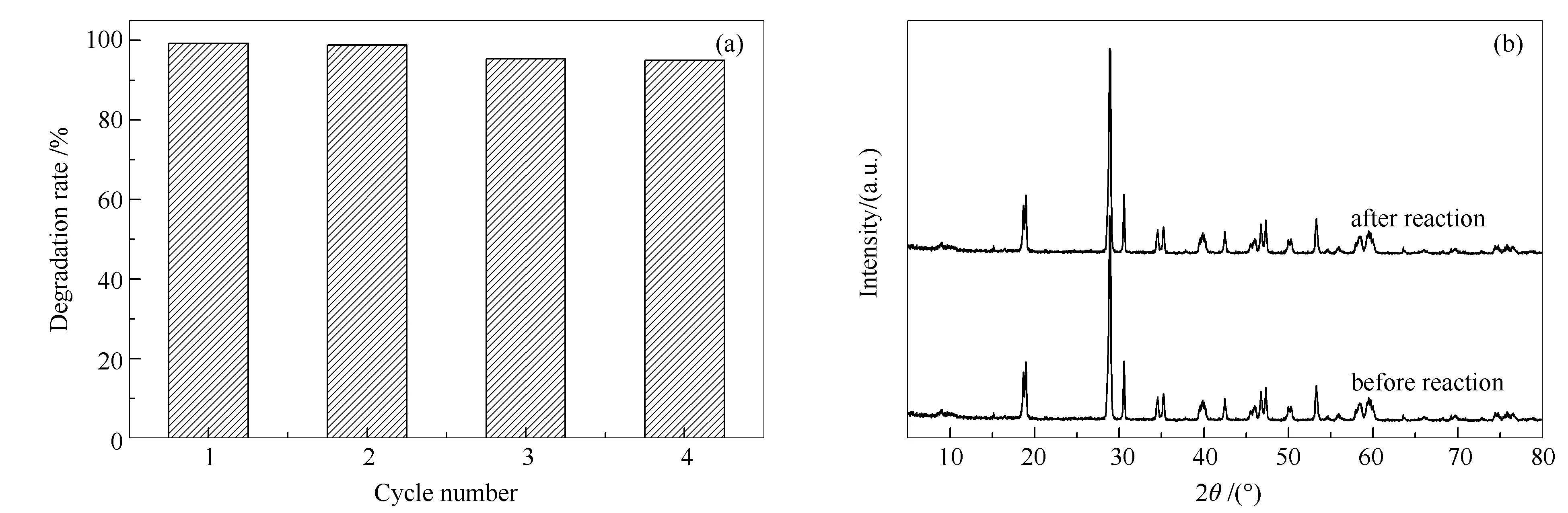
图 9 BF-2光降解RhB的使用寿命(a)和反应前后的XRD谱图(b)
图9(b)表示反应前后的BF-2的XRD谱图,这表明即使经过四次循环,BF-2的晶体结构仍保持稳定。综合考虑,在光催化过程中,BF-2复合材料是一种可循环利用、稳定性好的催化剂。
2.2.4机理初探
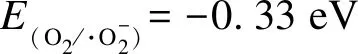
MIL-53(Fe)+hv→MIL-53(Fe)(e-+h+)
(1)
RhB+hv→RhB*/RhB+·+ e-
(2)
BiVO4+e-→BiVO4(e-+ h+)
(3)

(4)
(5)
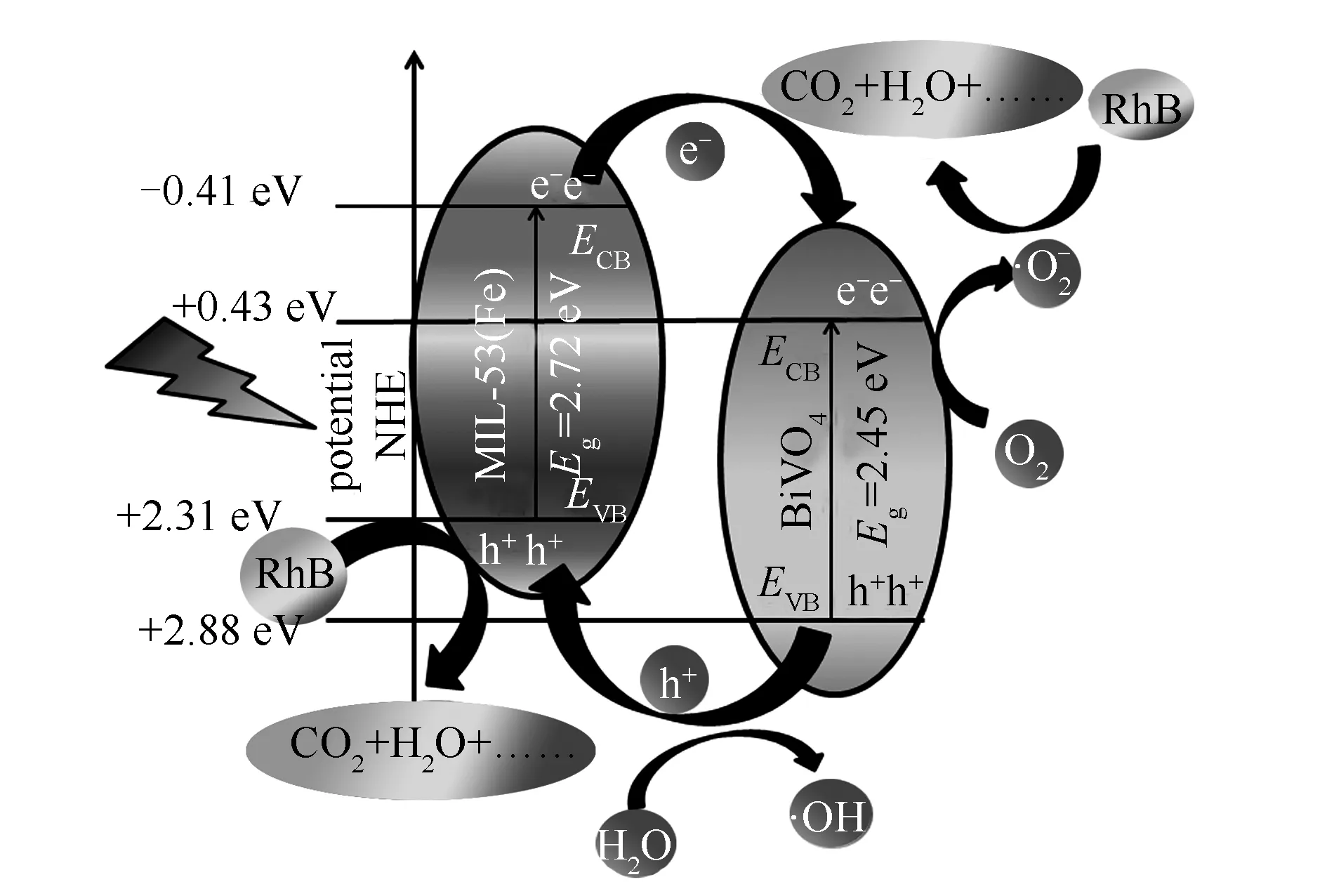
图 10 可见光照射下BiVO4/MIL-53(Fe)复合材料降解RhB的示意图Figure 10 A schematic illustration of the RhB degradation over BiVO4/MIL-53(Fe) composite under visible light irradiation
3 结 论
采用一种简易水热法成功制备了新型BiVO4/MIL-53(Fe)光催化剂。研究表明,BiVO4的加入量对该复合材料的光学性能、光催化降解RhB的性能有显著的影响,其中, BF-2复合材料的光催化活性最高,为纯MIL-53(Fe)和BiVO4的5.2倍和8.1倍。这可归因于复合材料结构的稳定性和能级匹配,降低了电子与空穴的复合速率,从而增强了催化剂的光催化活性。循环实验表明,BiVO4/MIL-53(Fe)光催化剂具有良好的可重复使用性和稳定性,进一步为开发高效率的半导体/MOFs光催化剂奠定了基础。
