创伤弧菌浸泡感染对孔雀鱼的影响
2019-04-17陈秀霞池洪树许斌福陈晨汐方冬兰
陈秀霞 池洪树 许斌福 陈晨汐 方冬兰 龚 晖
(福建省农业科学院生物技术研究所 福州 350003)
创伤弧菌(Vibrio vulnificus)是海水鱼的主要致病菌,可导致鲆鲽鱼、军曹鱼、石斑鱼以及养殖在含盐水体中的鳗鲡、罗非鱼等鱼类发病[1-5],研究该菌与宿主的互作关系,是研发创伤弧菌病防控技术的关键。由于养殖的宿主鱼个体差异大,基因背景未完全明晰,且常有创伤弧菌感染的背景,用养殖的宿主鱼为对象开展研究,得到的结果未必可靠,因此,有必要通过基因背景明晰的模式鱼开展相关研究。
孔雀鱼(Poecilia reticulate,Guppy)隶属于硬骨鱼纲 (Class Actinopterygi)、形目 (Order Cyprinodontiformes)、 花科 (Family Poecili dae)、 花属(Genus Poecilia)。孔雀鱼对盐度具有广适性,可适应海水和淡水[6],近年来,孔雀鱼的全基因组测序已完成[7],因此,孔雀鱼具有同时作为海水和淡水病原菌实验模型的潜力。目前还鲜见将其用于水产病原学和免疫学的研究报道。
本研究将创伤弧菌以浸泡的方式感染孔雀鱼,评价其对孔雀鱼的致病力,同时,对感染后孔雀鱼鳃免疫相关因子的表达情况进行分析,以期建立以孔雀鱼为模式动物的海水病原菌感染模型和免疫研究模型。
1 材料与方法
1.1 材料 孔雀鱼(1.0±0.2 g)来源于天津水产养殖基地,购自福州市花鸟市场。创伤弧菌FJ03-5X由福建省农业科学院生物技术研究所分离保藏[8]。
1.2 孔雀鱼的饲养 孔雀鱼用淡水暂养于水体体积为200 L的PVC桶中,水温25.0±0.5℃,溶氧6.0±0.3 mg/L,pH 值 7.5±0.3, 每天采用商品化饵料(Sera vipan staple diet D52518)投喂2次,投饵率1%。经过2周暂养后,添加人工海盐,使其盐度为15‰,再经1周暂养,添加海盐,使其盐度达到30‰。
1.3 感染试验
1.3.1 感染鱼分组 孔雀鱼在盐度为30‰的水体中暂养1周后,随机分成4组,每组60尾,分别暂养于水体体积为100 L的PVC桶中,再经1周暂养,用于感染试验。
1.3.2 菌株培养 将创伤弧菌FZ03-5X接种于TSA培养基,于28℃培养12 h后,挑取单菌落,接种于10 mL TSB培养液,于28℃、160 r/min培养12 h后,取1 mL接种于100 mL TSB培养液;160 r/min培养 12 h后,28℃培养 12 h,以5 000 r/min转速离心,弃上清,沉淀用0.75%生理盐水洗涤2次后,采用平板计数结合MeFarland比浊法,将菌用0.75%生理盐水重悬至1.0×109CFU/mL,备用。
1.3.3 浸泡感染 将创伤弧菌FZ03-5X菌液用生理盐水稀释,将孔雀鱼在3 L、盐度为30‰的水体中以不同浓度的菌液进行浸泡感染5 h,之后补充水体体积至100 L,持续观察。各组的浸泡浓度见表1。
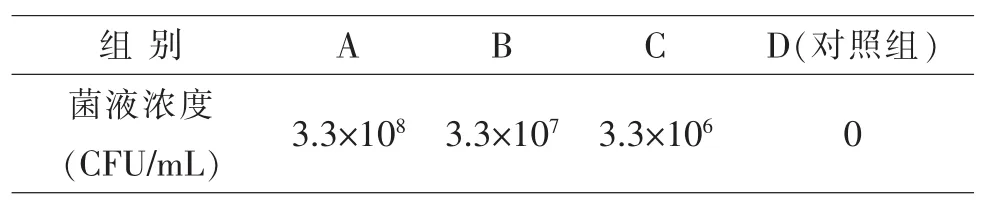
表1 各浸泡组菌液浓度
1.4 创伤弧菌感染后相关基因的表达分析
1.4.1 样品采集 在浸泡感染15 d后,将菌液浓度为3.3×107CFU/mL的浸泡组和生理盐水对照组的孔雀鱼各取7尾,采集鳃丝用于相关基因的表达分析。
1.4.2 总RNA的提取与反转录 采用Trizol Reagent(Invitrogen)试剂盒,按说明书提取鳃丝总RNA,反转录反应按试剂盒PrimeScript RT reagent Kit(Takara)说明书操作,产物cDNA置于-20℃保存。
1.4.3 荧光定量PCR 采用甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GPDH)基因为内参基因,检测C3补体、肿瘤坏死因子(tumor necrosis factor,TNF)、白介素 10(Interleukin 10,IL-10)、 白介素 1 (Interleukin 1,IL-1)、Mx 蛋白(Mx-like)、超氧化物歧化酶(superoxide dismutase,SOD)、凋亡因子FAS和含半胱氨酸的天冬氨酸蛋白水解酶(cysteinyl aspartate specific proteinase,caspase)的表达情况,根据NCBI已报道的相关序列设计引物。引物由上海生工生物有限公司合成,序列见表2。内参基因与目的基因各设3个平行反应管。

表2 用于qPCR的引物
反应体系为 25 μL,其中 12.5 μL SYBR Premix Ex Taq(Takara),上下游引物各 0.5 μL,稀释 10 倍的cDNA 4 μL,加水至25 μL。实时荧光定量PCR在Bio-Rad公司的CFX-96上完成。反应条件为95 ℃、90 s 后 ,95 ℃、5 s,60 ℃、15 s,72 ℃、20 s,40个循环,用比较 CT 方法(2-△△CTmethod)分析基因表达情况。
2 结果与分析
2.1 创伤弧菌FZ03-5X对孔雀鱼的致病力 试验鱼死亡集中在浸泡后的前4 d,4 d后试验鱼趋于平稳,未再出现死亡。至感染后第15 d,菌液浓度为3.3×108CFU/mL的试验组死亡率为40%,菌液浓度为3.3×107CFU/mL的试验组死亡率为18.33% ,菌液浓度为3.3×106CFU/mL的试验组死亡率为13.33%,对照组死亡率为6.67%。说明创伤弧菌以浸泡的方式感染孔雀鱼可导致孔雀鱼致病。具体结果见图1。

图1 创伤弧菌FZ03-5X浸泡感染后各组鱼的死亡曲线
2.2 创伤弧菌FZ03-5X感染后相关基因的表达情况 浓度为3.3×107CFU/mL的创伤弧菌浸泡组在感染15 d后,与免疫相关的肿瘤坏死因子(TNF),Mx因子表达水平均显著高于生理盐水对照组 (P<0.05),白介素 10(IL-10)的表达水平与生理盐水对照组无明显差异 (P>0.05),而超氧化物歧化酶(SOD)、白介素1(IL-1)的表达水平显著低于生理盐水对照组(P<0.05),与细胞凋亡相关的凋亡因子FAS和含半胱氨酸的天冬氨酸蛋白水解酶(caspase)的表达水平高于对照组(P<0.05)。见图2。
3 讨 论
水体是水产病原传播的主要媒介,将病原以浸泡的方式感染宿主鱼所获得的数据能较真实地反映出临床的实际情况。郭羿等用杀鲑气单胞菌以创伤浸泡的方式感染大菱鲆致病,对体长10~15 cm的大菱鲆LD50为6.3×104CFU/mL[9]。许斌福等用恶臭假单胞菌浸泡感染大黄鱼,可使大黄鱼致病,感染鱼的肝、脾等内脏器官出现了与临床一致的白色结节,但单纯的浸泡不易使鱼致病[10]。本研究直接用创伤弧菌浸泡感染可使孔雀鱼致病,说明创伤弧菌对孔雀鱼具有较强的致病力。
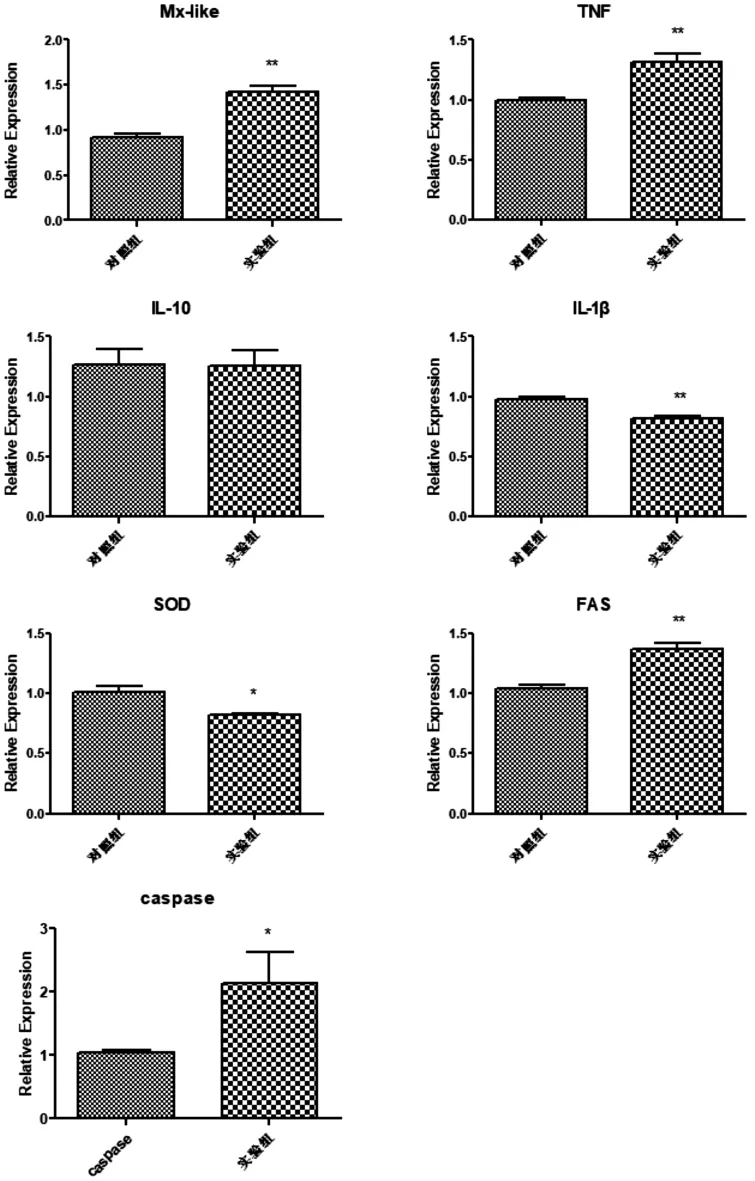
图2 浸泡感染后相关因子的表达情况
养殖水体中水产病原菌含量不高,且细菌性疾病发病时的临床表现非急性,因此,本研究在创伤弧菌浸泡感染孔雀鱼15 d后对较低浓度感染组与对照组的免疫及细胞凋亡相关基因表达水平进行比较,以期能获得接近临床的数据,为进一步开展创伤弧菌与宿主鱼的互作关系提供依据。
鳃是鱼对外进行物质交换的主要器官,鳃是病原侵染的主要部位,同时鳃在鱼类的非特异性免疫和特异性免疫中也发挥着重要作用[11]。陈营等用绿色荧光蛋白标记的嗜水气单胞菌示踪异育银鲫对颗粒性菌体抗原的吸收途径,结果表明鳃对抗原的吸收率高于体表和肠道[12]。Moore J D等用BSA乳胶颗粒浸泡虹鳟,发现鳃上抗原颗粒主要是由吞噬细胞摄取的,摄取的抗原在鳃中至少滞留24 d,并可向头肾和脾脏转移[13]。鱼类的鳃存在由巨噬细胞、粒细胞、淋巴细胞组成的黏膜相关淋巴组织[14],可独立完成免疫应答。因此,基于鳃的重要性,本研究以鳃为研究对象,对创伤弧菌侵染后相关因子的表达水平进行分析。在感染15 d后,肿瘤坏死因子(TNF)、Mx因子、与细胞凋亡相关的凋亡因子FAS和含半胱氨酸的天冬氨酸蛋白水解酶(caspase)的表达水平高于生理盐水对照组,说明在感染15 d后,感染鱼仍存在炎症反应。炎症反应之所以能维持15 d,可能与创伤弧菌的持续感染有关。
本研究建立了创伤弧菌对孔雀鱼的浸泡感染模型,掌握了创伤弧菌浸泡感染对孔雀鱼的致病力数据,初步了解了创伤弧菌浸泡感染对鳃免疫及凋亡因子表达的影响,为今后进一步开展创伤弧菌与宿主鱼的互作关系研究提供了理论依据,同时为开展其他水产病原相关的研究提供了参考。
