脱细胞生物材料样品的细胞毒控制技术研究
2019-04-17杨利霞谢美娜王云泽于月欣樊立涛杨国峰
杨利霞,谢美娜,王云泽,于月欣,樊立涛,杨国峰,李 晶*
(1.河北爱能生物科技股份有限公司研发部,中国河北石家庄050092;2.南开大学-河北爱能生物科技股份有限公司生物医学材料联合实验室,中国河北石家庄050092)
细胞毒性试验是指应用体外细胞培养的方法,通过检测材料本身或者其浸提液对细胞形态、数量等生长情况的影响来评价材料毒性,可以直观地看到外来因素作用后细胞形态和结构的改变以及细胞增殖与死亡的情况,是检测生物相容性的一种快速、价廉、重复性好的方法[1]。细胞毒检测是最敏感的生物学试验之一,也是动物源性医用材料生物安全性评价的一个基本指标。
动物源性生物材料本身含有的多种生物大分子和加工过程中所使用化学助剂的残留等均有可能导致最终样品的细胞毒性升高。所有植入类的生物材料样品必须通过细胞毒试验来初步评价其生物安全性。为此,国家出台了《医疗器械生物学评价》标准[2],使试验结果具有规范性、可比性。但此标准仅给出了细胞毒试验的标准操作过程,针对不同种类的生物材料尤其是动物源性生物材料,未明确指出该如何降低材料的细胞毒水平。
动物源性生物材料最常用的原材料有猪皮、猪心包膜、猪小肠黏膜下层以及牛心包、牛皮等组织,脱细胞是该类材料制备过程中的关键步骤之一。由于制备过程工序复杂、使用的加工助剂较多等,虽然在脱细胞技术制备工艺中已经过大量磷酸盐缓冲液的多次洗涤,但微量的分子残留所带来的批间差异仍可能是导致批间细胞毒不稳定的原因之一。因此,样品的细胞毒是制备过程中的重点监测对象,也是评判样品质量的关键指标之一。为进一步提高并稳定脱细胞样品的细胞毒水平,我们增加并优化了酒精处理工艺,最终实现将脱细胞样品的细胞毒水平稳定在Ⅰ级的目标。
1 材料与方法
1.1 材料和试剂
猪脊背皮购自石家庄双鸽食品有限责任公司。表皮完整无破损,无明显猪毛残留,长度20±5 cm,宽度 10±3 cm,厚度 3±0.5 mm。
其他主要材料和试剂有胰蛋白酶(Solarbio公司,美国);十二烷基硫酸钠(SDS,北京鼎国昌盛生物科技有限责任公司);无水乙醇(石家庄新宇三阳实业有限公司);二甲基亚砜(DMSO,美国Sigma公司);台盼蓝(Solarbio公司,美国);EDTA 试剂(Sigma公司,美国);DNA提取试剂盒(Qiagen公司,德国);DNA荧光定量试剂盒(上海翊圣生物科技有限公司);MEM培养基(Gibco公司,美国);新生牛血清(Gibco公司,美国);MTT(Sigma公司,美国);异丙醇(天津科密欧化学试剂有限公司);L929小鼠成纤维细胞(河北医科大学免疫研究室);高密度聚乙烯(河北医科大学免疫研究室)。
1.2 试验仪器
ZWY-100H/240恒温培养振荡器(上海智城分析仪器制造有限公司);Mettler-Toledo TCS-250型电子台秤(梅特勒-托利多(上海)称重设备系统有限公司);KD-2268型轮转切片机(浙江省金华市科迪仪器设备公司);KD-TS3D型生物组织脱水机(浙江省金华市科迪仪器设备公司);KD-BMI石蜡包埋机(浙江省金华市科迪仪器设备公司);KDTHIII型摊烤片机(浙江省金华市科迪仪器设备公司);CX21/CKX53型奥林巴斯显微镜(奥林巴斯(中国)有限公司);XDS-1B倒置生物显微镜(重庆光电仪器有限公司);TA.XTPlus物性测试仪(Stable Micro System公司,英国);Invitrogen细胞计数仪(赛默飞世尔科技(中国)有限公司);酶标仪(美谷分子仪器(上海)有限公司)。
1.3 样品制备
取剥下的猪脊背全厚皮,用取皮鼓切取厚度为0.65~0.85 mm的断层皮片,PBS溶液振荡清洗去除表面和皮内血渍。将样品置于2%的新洁尔灭溶液中振荡清洗0.5 h,随后转移至含有0.25%胰蛋白酶的EDTA溶液中,10℃振荡过夜以进行脱细胞处理。反应终止后,用纯化水振荡漂洗6次,每次30 min。在样品中加入5%的SDS反应液,常温振荡10 h以进行二次脱细胞处理,随后PBS充分漂洗以去除残留的各种试剂及细胞碎片,最后将样品裁剪成50 mm×80 mm大小备用。
1.4 试验分组
试验共分为两组,第一组是观察不同酒精浓度在相同处理时间内对样品细胞毒的影响。将上述方法制备的样品按照质量平均分为5组(A1、A2、A3、A4、A5),分别用相同体积的 0%、10%、30%、60%、90%酒精溶液振荡清洗,每组清洗6次,每次30 min,每组设置5个重复样品。酒精振荡清洗后用纯水振荡清洗6次,每次30 min,以除去酒精残留,辐照灭菌,即为待检样品。
第二组观察同一酒精浓度处理不同时间对样品细胞毒的影响。根据第一组样品的细胞毒检测结果,选取细胞毒最低组别对应的酒精浓度为最优酒精浓度。重新取1.3中制备的样品,按照质量等分为 5 组(B1、B2、B3、B4、B5),每组均使用等体积的最优浓度酒精清洗样品,清洗时间依次为6 h、12 h、24 h、36 h、48 h,在各组清洗时间内均等清洗6次,每组设5个重复。酒精振荡清洗后用纯水清洗6次,每次30 min,辐照灭菌,即为待检样品。
1.5 组织学观察
制备石蜡切片,HE染色后,置于倒置显微镜下观察,材料中的细胞被苏木精染成蓝紫色,胶原纤维被伊红染成粉红色[3]。
1.6 细胞毒评价
根据国家医疗器械生物学评价标准GB/T 16886.5—2017/ISO 10993-5:2009,采用 MTT法对制备的脱细胞真皮基质进行毒理学风险评估。
浸提液的制备:按3 cm2/mL的浸提比例将样品浸入含10%新生牛血清的MEM培养基中,于37℃下浸提24 h,即得浸提液。
细胞培养及分组:该部分试验分为3组,即试验组(材料浸提液)、阳性对照组(10%DMSO溶液)、阴性对照组(高密度聚乙烯,按每0.2 g阴性对照加1 mL细胞培养液的比例,37℃浸提24 h)。采用96孔培养板,加入0.1 mL细胞密度为1×105/mL的L929小鼠成纤维细胞悬浮液,置于5%CO2、37℃细胞培养箱中培养至半融合状态,吸出原培养基。3组分别加入0.1 mL待试液,48 h后在显微镜下观察每孔的细胞形态,培养72 h后移除培养液。
MTT法检测细胞活性:每孔加入0.05 mL质量浓度为1 mg/mL的MTT溶液,继续培养2 h后弃孔内液体,加入0.1 mL异丙醇,振荡混匀后采用酶标仪检测570 nm波长下的吸光值。按照如下公式评价细胞毒性:相对细胞增殖率(%)=样品试验组吸光值/阴性对照组吸光值×100%。
1.7 细胞活率检测
参照方法1.6,在L929小鼠成纤维细胞悬浮液中加入待试液后,共孵育24 h。每孔取20 μL细胞悬液,台盼蓝染色后混匀加入细胞计数板,避免产生气泡,于细胞计数仪中检测小鼠成纤维细胞的活率。
1.8 样品残留DNA的提取与检测
取待检样品10 mg(干重),剪碎研磨,按照DNeasy®Blood&Tissue Kit试剂盒中的操作步骤提取DNA,并按照dsDNA HS Assay Kit for Qubit®荧光定量试剂盒说明书于酶标仪中定量检测DNA含量,通过外标法计算DNA浓度,DNA残留(μg/g)=DNA浓度×反应体积/待检样品干重。
1.9 数据统计与分析
试验数据用SPSS 10.0软件进行方差分析和t检验,结果以平均值±标准差±s)表示。
2 结果与分析
2.1 样品制备
脱细胞真皮基质的外观为白色或乳白色,色泽均匀,厚度为1.0~1.5 mm,无肉眼可见杂质,无毛发残留,表面平整,触感柔软(图1)。

图1 脱细胞样品大体外观Fig.1 General appearance of the sample
2.2 脱细胞样品的组织学观察

图2 HE染色结果(A)脱细胞前(×100);(B)脱细胞后(×100);(C)脱细胞前(×400);(D)脱细胞后(×400)。Fig.2 HE staining results(A)Before decellularization(×100);(B)After decellularization(×100);(C)Before decellularization(×400);(D)After decellularization(×400).
异种细胞属于抗原性很强的成分,异种细胞越多,细胞毒试验中L929小鼠成纤维细胞受到的伤害越大,即样品的细胞毒性越强。因此,高效脱细胞是保证细胞毒性合格的前提,也是研究酒精对脱细胞真皮基质样品细胞毒影响的基础。组织学观察可以比较直观地评价样品脱细胞的效果是否彻底,脱细胞前的HE染色结果显示原料皮中表皮层完整,细胞外基质中含有较多细胞,导致表皮及真皮层存在大面积的蓝染(图2A,C);而经过含有0.25%胰蛋白酶的EDTA溶液脱细胞处理后,HE染色结果几乎无蓝色,放大后亦未见蓝染细胞核或细胞碎片,说明异种细胞成分已经基本去除(图 2B,D)。
2.3 不同酒精浓度处理的样品细胞毒试验结果
不同酒精浓度处理所得样品的浸提液与L929小鼠成纤维细胞共孵育24 h后,以台盼蓝染色法检测细胞活率。不同组别因清洗的酒精浓度不同而导致样品浸提液不同,在与细胞共培养时,对细胞活率也会产生不同的影响(表1)。当酒精浓度小于30%时,细胞活率均较低,尤其是A1组,细胞活率只有68%±6%,但随着酒精浓度的增加细胞活率明显升高,A2组的细胞活率提升至82%±4%;当酒精浓度超过30%时,细胞活率略有降低但基本上趋于平稳,A4、A5组与A3组的细胞活率差异不大。因此,采用30%的酒精清洗样品,其浸提液对细胞生长的影响较小,细胞活性最高。
在细胞毒试验中我们也观察到类似的结果。按照细胞毒性反应分级(表2)[4],当酒精浓度低于30%时,制备样品的细胞毒为Ⅲ~Ⅱ级水平,但随着酒精浓度的升高,A1~A3组的细胞增殖率逐渐升高,A3组中部分样品的细胞毒性甚至可以达到0级水平(表3)。倒置相差显微镜观察结果显示:A1组细胞皱缩、边界不明显,细胞透明度低,细胞融合状态差;A2组较A1组的细胞状态有所改善,细胞透明度升高,融合度上升,显微镜下约能铺满半个视野;A3组的细胞呈现饱满的梭型,透明度和融合度均达到最佳状态,显微镜下细胞可铺满整个视野(图3)。当采用60%浓度的酒精处理样品时(A4组),细胞毒试验结果中细胞的相对增殖率与A3组差别不大,细胞毒基本上可以维持在Ⅰ级水平,倒置相差显微镜下细胞也能铺满整个视野,但细胞融合度明显不如A3组。当处理的酒精浓度进一步升高至90%时(A5组),对应结果中细胞的增殖率有所下降,部分样品的细胞毒也降至Ⅱ级水平,而且倒置相差显微镜下观察到的细胞状态与A2组类似。
综上可知,样品处理时所选用的酒精浓度不同,其最终的细胞毒性也不同,酒精浓度过低(如A1组)会导致样品中细胞残渣、有机大分子等可能会引起细胞毒的物质清洗不彻底,而浓度太高会在后续的纯水清洗步骤中出现酒精本身清除不彻底的现象。这两种情况均可能导致试验细胞的损伤。因此,选择合适的酒精浓度进行清洗是提高并稳定样品细胞毒水平的重要保证。
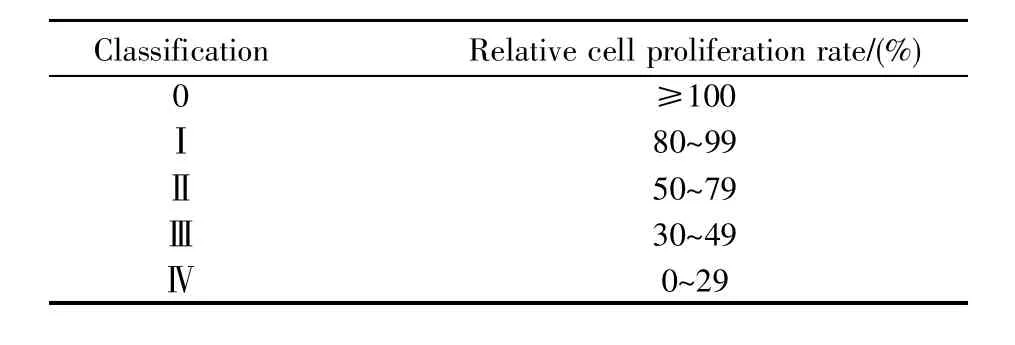
表2 细胞毒性反应分级[4]Table 2 Classification of cytotoxic reactions[4]
以DNA分子残留为例,进一步验证酒精对大分子物质的清除作用。文中采用荧光定量法检测各组样品中的DNA残留量(表4)。结果显示:A3组的DNA残留量最少,与之相比,未用酒精清洗的样品(A1组)DNA残留较高,二者有显著性差异。采用低浓度的酒精清洗(A2组)时,DNA残留有所下降,与A3组相比,无显著差异;而采用较高浓度的酒精清洗(A4组)时,DNA残留反而有升高的现象,且结果与A3组差异显著;进一步增加酒精浓度(A5组),DNA残留量与A4组相比变化不明显。以上信息说明只有浓度适宜的酒精才更有利于样品中DNA分子的清除,酒精浓度过低或者过高均不利于DNA分子清除,这一变化趋势与样品的细胞毒变化趋势类似。
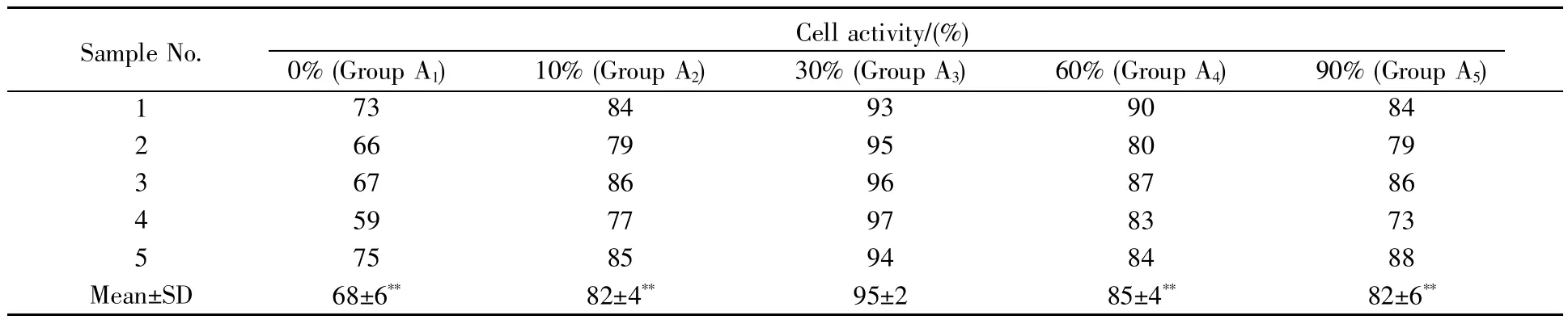
表1 不同酒精浓度处理后的样品浸提液对细胞活性的影响Table 1 The effect of sample extracts treated with different alcohol concentrations on cell activity
DNA分子在不同物种之间的特异性较强,是细胞毒性增高的原因之一。高浓度酒精会降低DNA分子的溶解度,样品可能会因为清洗不彻底而导致大量DNA残留。此外,纯水虽然可以高效清洗样品表面,但对样品内部的渗透性清洗不如酒精溶液好,这可能是低浓度酒精比纯水清洗效果更好的原因之一。
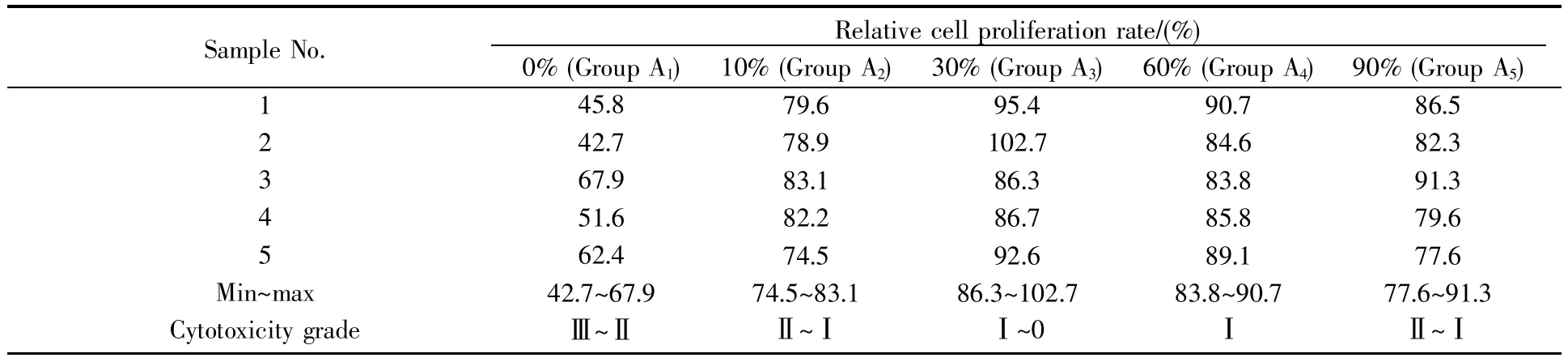
表3 不同酒精浓度处理后的样品浸提液对细胞毒的影响Table 3 The effect of sample extracts treated with different alcohol concentrations on cytotoxicity
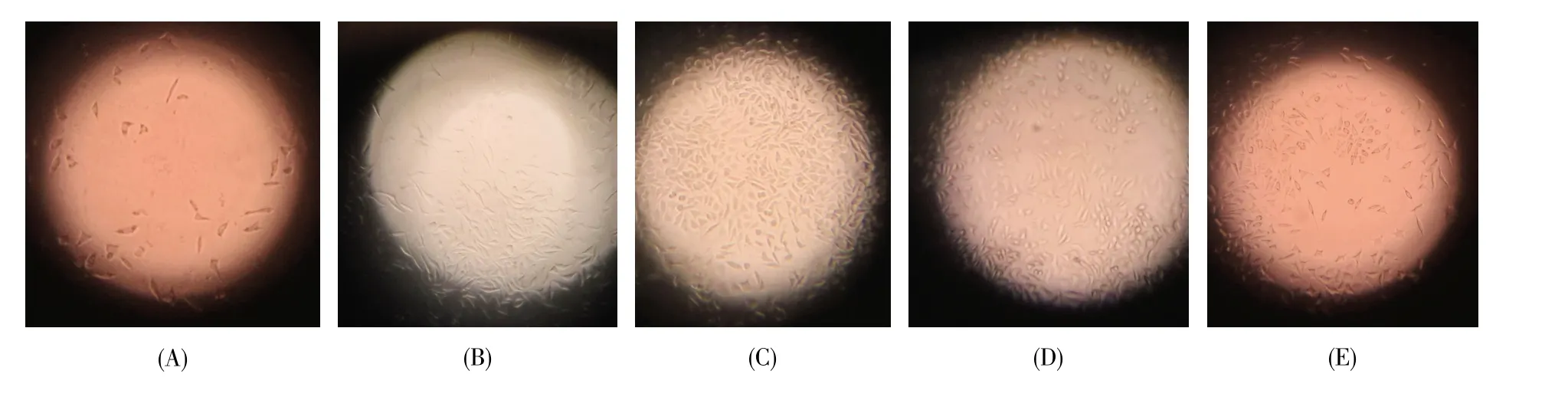
图3 与不同酒精浓度处理后的样品浸提液共孵育48 h后的细胞形态(×100)(A)A1组,细胞毒Ⅲ级;(B)A2组,细胞毒Ⅱ级;(C)A3组,细胞毒0级;(D)A4组,细胞毒Ⅰ级;(E)A5组,细胞毒Ⅰ级。Fig.3 Cell morphologies after 48 h incubation with sample extracts treated by different alcohol concentrations(×100)(A)Group A1,cytotoxic classⅢ;(B)Group A2,cytotoxic classⅡ;(C)Group A3,cytotoxic class 0;(D)Group A4,cytotoxic classⅠ;(E)Group A5,cytotoxic classⅠ.
2.4 以30%的酒精处理不同时间所制备样品的细胞毒试验结果
基于以上结果,选取30%的酒精浓度为优选浓度,按照不同振荡清洗时间设置5个试验组,各组样品的浸提液与L929小鼠成纤维细胞共孵育24 h,检测并记录小鼠成纤维细胞的活率。结果如表5所示,随着处理时间的延长,细胞活性呈现逐渐增强的趋势,但趋势平稳,细胞活率变化无显著性差异,均能达到88%以上。
从表6可知,以30%的酒精振荡清洗所制备样品的细胞毒基本可以达到Ⅱ级以上水平。振荡清洗6 h时,细胞的相对增殖率最高可达82.2%(B1组),样品的细胞毒最高可以达到Ⅰ级水平。从B2~B5组的数据可以看出,当振荡清洗时间延长至12 h以上时,细胞的相对增殖率基本可以稳定在90%以上,样品的细胞毒性较B1组低;但随着振荡清洗时间的延长,组内各细胞的相对增殖率差异增大,如B5组内细胞相对增殖率最低83.6%,最高102.5%,相差超过20%。这说明在30%的酒精浓度条件下,随着清洗时间的延长,虽然样品的细胞毒整体上趋于平稳,但组内不同细胞的相对增殖率差异开始增大。因此,使用30%的酒精清洗样品时,只有合理控制清洗时间,样品的细胞毒性才能更加稳定。综合考虑样品的细胞毒性和制备过程的经济性,我们认为以30%的酒精振荡清洗至少12 h就可以将脱细胞样品的细胞毒稳定在Ⅰ级水平。

表4 不同酒精浓度处理后的样品DNA残留情况Table 4 DNA residues of samples treated with different alcohol concentrations

表5 经30%的酒精处理不同时间后的样品浸提液对细胞活性的影响Table 5 The effect of sample extracts treated with 30%alcohol for different processing time on cell activity
3 讨论
脱细胞生物材料具有低免疫原性、良好的生物相容性和生物可降解性等特点,逐渐成为天然生物医用材料研究的热点。人源材料因价格较高、来源有限,且存在病毒传播风险,在临床应用中受到限制[5]。而动物源性材料因取材范围及数量可不受限制备受青睐。目前,以猪心包膜[6]、猪小肠黏膜下层[7~8]以及牛心包[9~10]等组织制备的脱细胞材料的研究已经比较深入,但材料本身及加工过程的复杂性导致样品细胞毒批间差异比较大,甚至部分批次细胞毒超过限定标准。
脱细胞生物材料经过特殊工艺处理后,可完全除去细胞成分,只留下以胶原蛋白为主要成分的细胞外基质[11~12]。这可以明显降低由细胞膜表面抗原及细胞分泌物引起的组织排异反应。人和猪的细胞外基质在支架结构、胶原排列和胶原组成等方面具有很强的同源性;细胞外基质成分保守,细胞毒性低,猪皮经过去细胞、降低免疫反应等处理后有可能替代同种无细胞真皮基质应用于临床[13~14]。但因物种的差异,动物源性材料中残留的一些生物大分子、加工助剂等物质,在植入人体后,可能会加重炎症、免疫反应等,因此,为进一步确保植入材料的安全性,有必要改进制备工艺,加强对生物大分子、加工助剂等可能引起或加重细胞毒性物质的清除,以达到降低动物源性医用材料细胞毒性,提高应用安全性的目的。
酒精分子结构特殊,能与水以任意比互溶,既能溶解无机盐等无机物,又可以溶解脂类等有机物。酒精振荡清洗可以减少脱细胞基质中加工助剂、细胞碎片、生物大分子等有毒有害物质的残留,但酒精清洗过后,即便是多次纯水清洗,也不可避免地会有酒精残留,且在相同清洗条件下使用酒精浓度越高最终的酒精残留也越多。相关研究报道微量酒精虽然在某种程度上可以促进细胞生长[15],但浓度超过一定限度时会有细胞毒性,酒精可以自由扩散出入细胞膜影响细胞膜通透性,而且其代谢产物含有醛基,残留过量可能会对受体细胞产生一定的毒害作用,高浓度的酒精还可以使细胞内蛋白质脱水变性。基于这一原理,有研究者应用酒精诱导加快细胞凋亡[16],临床上也用高浓度的酒精治疗卵巢囊肿类疾病[17~18]。此外,有研究报道当酒精浓度超过一定限度时,血细胞遭到破坏的程度会随着酒精浓度的增加逐渐增强[19]。因此,选择恰当的酒精处理浓度,对降低植入材料的细胞毒至关重要。
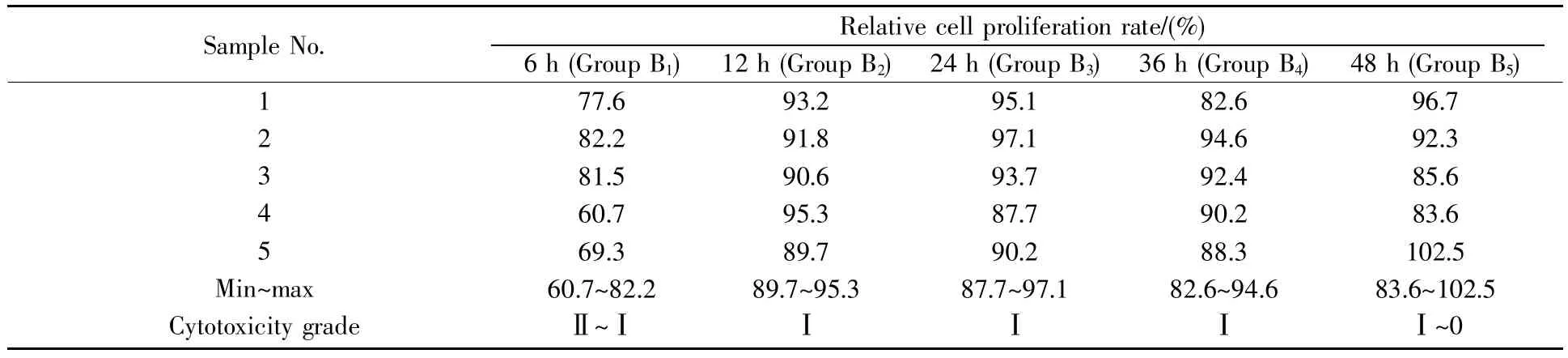
表6 经30%的酒精处理不同时间后的样品浸提液对细胞毒的影响Table 6 The effect of sample extracts treated with 30%alcohol for different processing time on cytotoxicity
总的来讲,只有适度的酒精振荡处理才有利于降低脱细胞材料的细胞毒性。本研究证实采用30%的酒精振荡清洗脱细胞样品12 h,可将脱细胞真皮基质材料的细胞毒性稳定在Ⅰ级水平。这有利于提高脱细胞材料的生物相容性和应用安全性,但该结论还需要动物试验再验证。
