Fisetin对H2O2诱导细胞内ROS的清除作用及机制探讨
2019-04-17张妍薇杨人贵陈静芳向晓婧陈继华
张妍薇,郑 皖,3,杨人贵,陈静芳,向晓婧,陈继华*
(1.中南大学湘雅公共卫生学院,中国湖南长沙410078;2.长沙市疾病预防控制中心,中国湖南长沙410002;3.遂宁市中心医院,中国四川遂宁629099;4.长沙市中心医院神经内科,中国湖南长沙410018)
随着社会经济的发展,人民生活节奏加快,以心血管疾病、癌症、慢性呼吸系统疾病和糖尿病为主的慢性病取代了传染病的主要地位,成为了加重居民经济负担,降低生活质量的重要公共卫生问题[1]。
大量研究表明,慢性病的发生发展与活性氧(reactive oxygen species,ROS)的过量紧密相关[2~3]。ROS是含氧化学反应分子,包括超氧阴离子(O2-·)、羟基自由基(·OH)及过氧化氢(H2O2)等。适量的ROS具有积极作用,包括参与杀死入侵的病原体、伤口愈合和修复过程。当机体受到紫外线、环境毒物、高氧、低氧等外界刺激时,细胞内会产生大量的ROS,过量的ROS在不同的器官中如若不能被有效清除,则会造成积聚,此时高浓度的ROS会通过DNA损伤、脂质过氧化或蛋白质破坏等方式,对细胞造成持续性的破坏,引起氧化应激损伤,造成机体生理功能紊乱,从而导致疾病[4]。研究报道,在非酒精性脂肪肝的发生发展中,过量的ROS可抑制体内抗氧化酶的活性,引起炎症和细胞死亡,并对脂肪变性产生重要作用[5]。
非瑟酮(3,3′,4′,7-四羟基黄酮,fisetin)是一种广泛存在于蔬菜水果中的黄酮类化合物。研究表明,fisetin具有抗氧化、抗炎、抗肿瘤、保护心血管等多种生物学作用[6]。Seo等[7]发现,fisetin可以通过诱导PI3K/AKT/Nrf2介导的血红素加氧酶-1(heme oxygenase-1,HO-1)的表达,抑制人角质形成细胞HaCaT中TNF-α诱导的炎症作用和H2O2诱导的氧化损伤。Sakai等[8]报道,fisetin可通过上调Nrf2介导的II期抗氧化酶的表达水平,阻断核因子κB受体激活蛋白配体(receptor activator of nuclear factor-κB ligand,RANKL)介导的 ROS 产生,继而抑制破骨细胞(osteoclasts,OCL)分化。然而,fisetin对HepG2细胞的氧化损伤保护作用及其机制尚不清楚。
核因子E2相关因子2(nuclear factor erythroid 2-related factor 2,Nrf2)是调节细胞内抗氧化反应的关键转录因子,在维持细胞内氧化还原稳态中起着至关重要的作用[9]。大量关于Kelch样ECH相关蛋白1(Kelch-like ECH-associated protein 1,Keap1)/Nrf2/抗氧化反应元件(antioxidant response element,ARE)通路的研究认为,在正常生理状态下,Nrf2与Keap1相结合,经泛素-蛋白酶体介导的调控机制,使Nrf2处于非游离及不断降解的非活性状态;在氧化应激条件下,Keap1对Nrf2的泛素化和降解能力减弱,Nrf2转运至细胞核内,与ARE结合后可诱导下游二相解毒酶及抗氧化蛋白如醌氧化还原酶1(NAD(P)H quinone oxidoreductase 1,NQO1)、HO-1等的表达,从而清除ROS,发挥其抗氧化作用[10]。已有研究表明,Nrf2所介导的细胞防御系统对氧化应激所诱发的疾病如癌症[11]、糖尿病[12~13]、呼吸系统疾病[14]、慢性炎症[15~16]、心血管疾病[17~18]以及神经退行性疾病[19~20]等具有保护性作用。因此,Nrf2介导的抗氧化防御系统的激活是预防和治疗这些疾病的有效策略。
本研究希望通过观察fisetin对H2O2诱导的HepG2细胞存活率及细胞内ROS的影响,探究fisetin对H2O2诱导的HepG2细胞的保护作用及其对ROS的清除效果;同时根据fisetin对Nrf2、Keap1、Ⅱ相酶表达水平的调控作用,探讨fisetin对H2O2诱导的HepG2细胞可能的保护机制。
1 材料与方法
1.1 实验对象
人肝癌细胞HepG2来自中南大学肿瘤研究所。
1.2 实验仪器与主要试剂
CO2细胞培养箱(Binder公司,德国);超净工作台(苏州苏洁净化设备有限公司);倒置显微镜AE2000(麦克奥迪实业集团有限公司);垂直电泳槽BE-240及转膜仪BE-320(BioCraft公司,日本);全自动化学发光成像系统(上海天能科技有限公司)。
Fisetin(Selleck公司,美国);DMSO(Sigma公司,美国);RPMI1640 培养基(Gibco公司,美国);胎牛血清(Gibco公司,美国);MTT试剂盒(Sigma公司,美国);活性氧检测试剂盒(上海碧云天生物技术有限公司);ROS荧光探针-DHE(威格拉斯生物技术有限公司);RIPA裂解液(强)(上海碧云天生物技术有限公司);Lipofectamine 3000试剂(Thermo Fisher Scientific公司,美国);双标记慢病毒载体GV248(上海吉凯基因化学技术有限公司);胰酶(Genview公司,美国);sh-Con质粒(阴性对照,NC)、sh-Nrf2质粒(上海吉凯基因化学技术有限公司);PVDF 膜(Immobilon-P 公司,美国);α-tubulin抗体(武汉爱博泰克生物科技有限公司);Nrf2抗体(Abcam公司,英国);Keap1抗体、HO-1抗体、NQO1抗体、GCLC抗体(Santa Cruz公司,美国);辣根酶标记的山羊抗兔IgG、辣根酶标记的山羊抗小鼠IgG(北京鼎国昌盛生物技术有限责任公司)。
1.3 实验方法
1.3.1 细胞培养
将HepG2细胞置于37℃、5%CO2培养箱中,用含有10%胎牛血清的RPMI1640培养基进行培养。
1.3.2 实验分组
将HepG2细胞随机分为空白对照组(control)、溶剂对照组(solvent control,培养基中加入体积分数为1‰的DMSO)、H2O2模型组(H2O2model group,培养基中加入 500 μmol/L H2O2处理 30 min)、fisetin干预组(培养基中先分别加入 10 μmol/L、20 μmol/L、30 μmol/L fisetin 处理 5.5 h,再加入 500 μmol/L H2O2处理30 min)、fisetin单独处理组(培养基中加入30 μmol/L fisetin处理6 h)。实验重复3次。
1.3.3 Nrf2敲低细胞系的构建
委托上海吉凯基因化学技术有限公司设计3条以Nrf2为靶点的shRNAs,依据该公司提供的定量PCR实验结果筛选出相较于其他两条敲低效率高(92.1%)的shRNA(ccggacTGACAGAAGTTGACAATTActcgagTAATTGTCAACTTCTGTCAgttttttg),认为其为有效靶点,并将其克隆到双标记慢病毒载体GV248中。用Lipofectamine 3000将sh-Con(阴性对照)、sh-Nrf2质粒转染至HepG2细胞中,两天后加入嘌呤霉素,杀死未转染的细胞。于湘雅医院医学科学研究中心采用流式细胞仪分选带有绿色荧光的强阳性细胞。提取所分选的细胞蛋白质,通过Western-blot检测Nrf2的表达情况,从而鉴定Nrf2敲低细胞系是否构建成功。
1.3.4 MTT实验
取对数生长期的HepG2细胞,以5×103个/孔接种于96孔板中,培养24 h,期间按1.3.2分组方法处理细胞,随后换液加入MTT试剂(5 mg/mL)继续孵育4 h。吸弃废液,每孔加入150 μL DMSO使紫色结晶完全溶解,之后用酶标仪在490 nm波长下检测吸光度值(OD值)。细胞存活率r=(ODs/ODd)×100%,式中,ODs与ODd分别为处理组与对照组的吸光度值。
1.3.5 ROS检测
取对数生长期的HepG2细胞,以5×103个/孔接种于96孔板中,培养24 h,期间按1.3.2分组方法处理细胞,随后换液,加入2′,7′-二氯荧光黄双乙酸盐(2′,7′-dichlorofluorescein diacetate,DCFHDA)(10 μmol/L)反应 30 min。PBS 清洗一遍后,使用488 nm激发波长,525 nm发射波长,检测细胞内ROS的水平。
1.3.6 Western-blot检测
取对数生长期的HepG2细胞,以1×106个/碟接种于6 cm培养皿中,培养24 h,期间按1.3.2分组方法处理细胞,随后每碟加入200 μL RIPA裂解液,用刮刀刮下细胞,充分裂解后离心提取细胞总蛋白质,并用BCA法定量。根据定量结果统一浓度至10 μg/μL 后,加入 5× loading buffer混匀,100℃加热10 min。用回收的蛋白质进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),蛋白质上样量为30~50 μg,电泳参数设为恒压80 V、2 h。切取含有目的蛋白的胶进行转膜,参数设为恒压80 V、1 h 30 min。5%脱脂牛奶封闭1 h后用1×TBST 洗涤 3 次;加入 Nrf2(1∶2 500)、Keap1(1∶1 000)、HO-1(1∶1 000)、GCLC(1∶1 000)、GCLM(1∶1 000)、NQO1(1∶1 000)抗体 4 ℃过夜;1×TBST洗涤3次;加入二抗(1∶2 000)室温孵育1 h;1×TBST洗涤3次;ECL化学发光液显色;采用Tanon全自动化学发光成像系统观察和拍照,并用Tanon Gel Image System软件对蛋白质条带进行定量分析。
1.3.7 统计学处理
数据资料用平均值±标准差(x±s)表示,应用SPSS 18.0软件进行统计学处理,各组均数之间的比较采用单因素方差分析(one-way ANOVA),以Dunnettt检验比较各组间均数的差异,以P<0.05为有统计学意义。
2 实验结果
2.1 Fisetin和H2O2对HepG2细胞存活率的影响
课题组前期实验结果显示:用不同浓度的fisetin处理细胞24 h时,随着fisetin浓度的增加,细胞存活率下降;当fisetin浓度为45.98 μmol/L时,细胞存活率为50%[9]。因此,本次实验选用的fisetin 浓度为 10 μmol/L、20 μmol/L、30 μmol/L。为了探究fisetin对H2O2诱导的HepG2细胞氧化损伤的保护作用,我们检测了不同处理组细胞的存活率大小。结果如表1所示,与空白对照组相比,溶剂对照组的细胞存活率无明显差异(100%&99.66%±0.34%,P>0.05),fisetin单独处理组的细胞存活率也无明显差异(100%&98.67%±0.86%,P>0.05),但H2O2模型组的细胞存活率显著下降(100%&48.72%±1.19%,P<0.05);与 H2O2模型组相比,fisetin干预组的细胞存活率显著上升(48.72%±1.19%&53.71%±1.51%,54.84%±1.59%,51.28%±0.20%,P<0.05)。以上结果说明,在一定浓度范围内,fisetin能够对H2O2诱导的HepG2细胞氧化损伤起到保护性作用。
2.2 Fisetin对H2O2诱导的HepG2细胞内ROS的影响
为了进一步探究fisetin对H2O2诱导的Hep-G2细胞氧化损伤的保护作用,我们选用DCFHDA探针法检测细胞内ROS的水平。DCFH-DA本身没有荧光,可以自由穿过细胞膜,其进入细胞后,可以被细胞内的酯酶水解生成DCFH。细胞内的活性氧可以氧化无荧光的DCFH生成有荧光的 7′-二氯荧光素(7′-dichlorofluorescein,DCF)。因此,检测DCF的荧光就可以知道细胞内活性氧的水平。图1结果显示,与空白对照组相比,H2O2模型组、fisetin单独处理组中ROS的水平分别上升了约0.8、0.3 倍(P<0.05);与 H2O2模型组相比,fisetin干预组中ROS的水平分别下降了约7.1%、23.4%、30.5%(P<0.05)。以上结果说明,在一定浓度范围内,fisetin能够抑制H2O2诱导的HepG2细胞内ROS的产生。
表1 Fisetin对H2O2诱导的HepG2细胞存活率的影响Table 1 Effect of fisetin on the survival rate of HepG2 cells induced by H2O2±s,n=3)
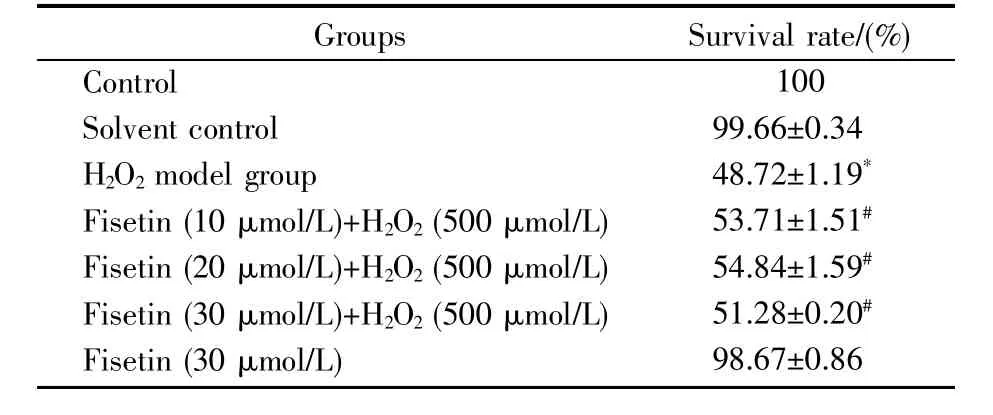
表1 Fisetin对H2O2诱导的HepG2细胞存活率的影响Table 1 Effect of fisetin on the survival rate of HepG2 cells induced by H2O2±s,n=3)
注:*表示与空白对照组相比P<0.05,#表示与H2O2模型组相比P<0.05,图1~3的统计分析相同。Notes:*P<0.05,compared with the control group;#P<0.05,compared with the H2O2model group.These are the same in the following Figs.1~3.
images/BZ_14_1282_568_2201_622.pngControl Solvent control H2O2model group Fisetin(10 μmol/L)+H2O2(500 μmol/L)Fisetin(20 μmol/L)+H2O2(500 μmol/L)Fisetin(30 μmol/L)+H2O2(500 μmol/L)Fisetin(30 μmol/L)100 99.66±0.34 48.72±1.19*53.71±1.51#54.84±1.59#51.28±0.20#98.67±0.86
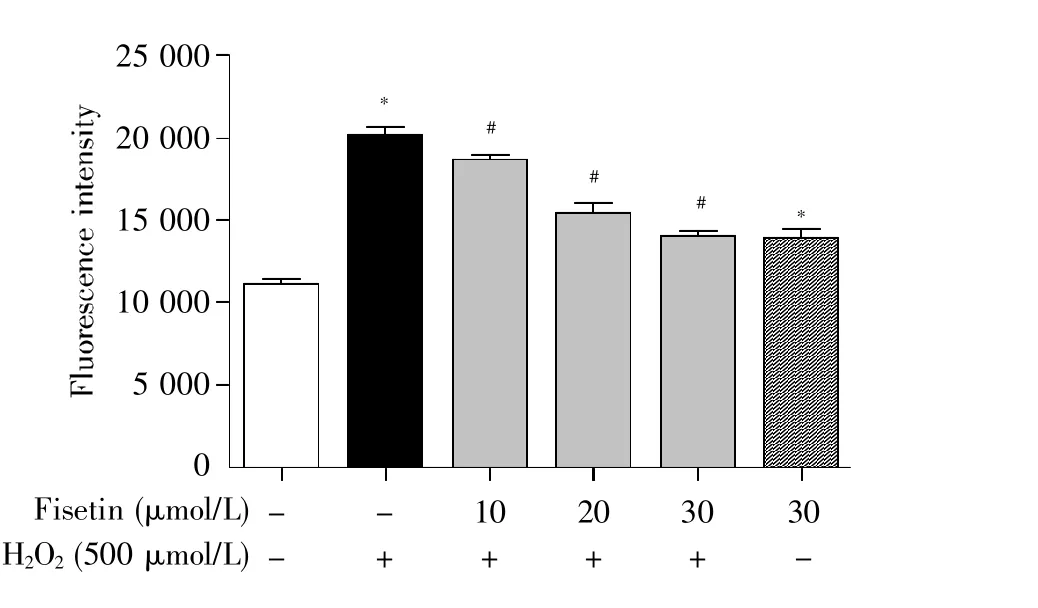
图1 Fisetin对H2O2诱导的HepG2细胞内ROS水平的影响Fig.1 Effect of fisetin on ROS in HepG2 cells induced by H2O2
2.3 Fisetin对Ⅱ相酶表达水平的影响
HO-1、GCLC、GCLM、NQO1是Ⅱ相抗氧化酶,能够清除ROS,调控细胞内的氧化还原稳态。为了探究fisetin对Ⅱ相抗氧化酶表达水平的影响,本研究检测了 HO-1、GCLC、GCLM、NQO1蛋白的表达。图2结果显示,与空白对照组相比,用fisetin单独处理后HO-1蛋白的表达水平显著增加了约2.1倍(P<0.05);与H2O2模型组相比,fisetin干预组中HO-1蛋白的表达水平分别增加了约2.3、2.0、1.6 倍(P<0.05)。然而,GCLC、GCLM、NQO1的表达水平在各组中并无明显差异(P>0.05)。
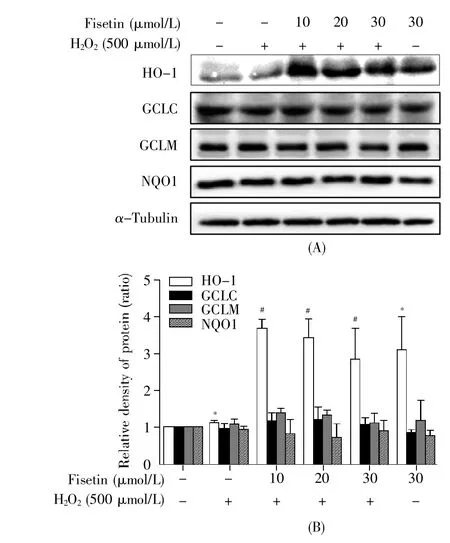
图2 Fisetin对Ⅱ相酶表达水平的影响Fig.2 Effect of fisetin on phaseⅡenzyme expression
2.4 Fisetin对Nrf2、Keap1蛋白表达的影响
Nrf2是 HO-1、GCLC、GCLM、NQO1的上游转录因子,同时也是调节细胞内抗氧化反应的关键转录因子。而Keap1被广泛认为是Nrf2激活的中枢负调节剂。为了探讨fisetin是否通过影响Nrf2/Keap1信号通路来发挥其抗氧化保护作用,我们通过Western-blot进一步检测了Nrf2、Keap1蛋白的表达。图3结果显示,与空白对照组相比,H2O2模型组和fisetin单独处理组中Keap1蛋白的表达水平分别下降了约16.6%、59.7%(P<0.05),且fisetin单独处理组中Nrf2蛋白的表达水平增加了约1.5倍(P<0.05);与H2O2模型组相比,干预组在20 μmol/L、30 μmol/L fisetin 处理时其 Nrf2 水平分别增加了 0.8、1.0倍(P<0.05),在10 μmol/L、20 μmol/L、30 μmol/L fisetin处理时其Keap1水平分别下降了21.2%、23.6%、43.9%(P<0.05)。以上结果说明,fisetin能够增加Nrf2蛋白的表达水平,同时降低Keap1蛋白的表达水平。
2.5 Nrf2在fisetin清除ROS过程中的作用
上述结果显示fisetin对HepG2细胞内ROS的清除作用可能是通过增加Nrf2蛋白,激活Nrf2-ARE通路,诱导Ⅱ相酶表达等途径发挥的。为了进一步验证Nrf2在fisetin清除ROS过程中的作用,我们通过转染sh-Nrf2质粒,敲低了HepG2细胞中Nrf2的表达,并对细胞内ROS的含量进行了测定。
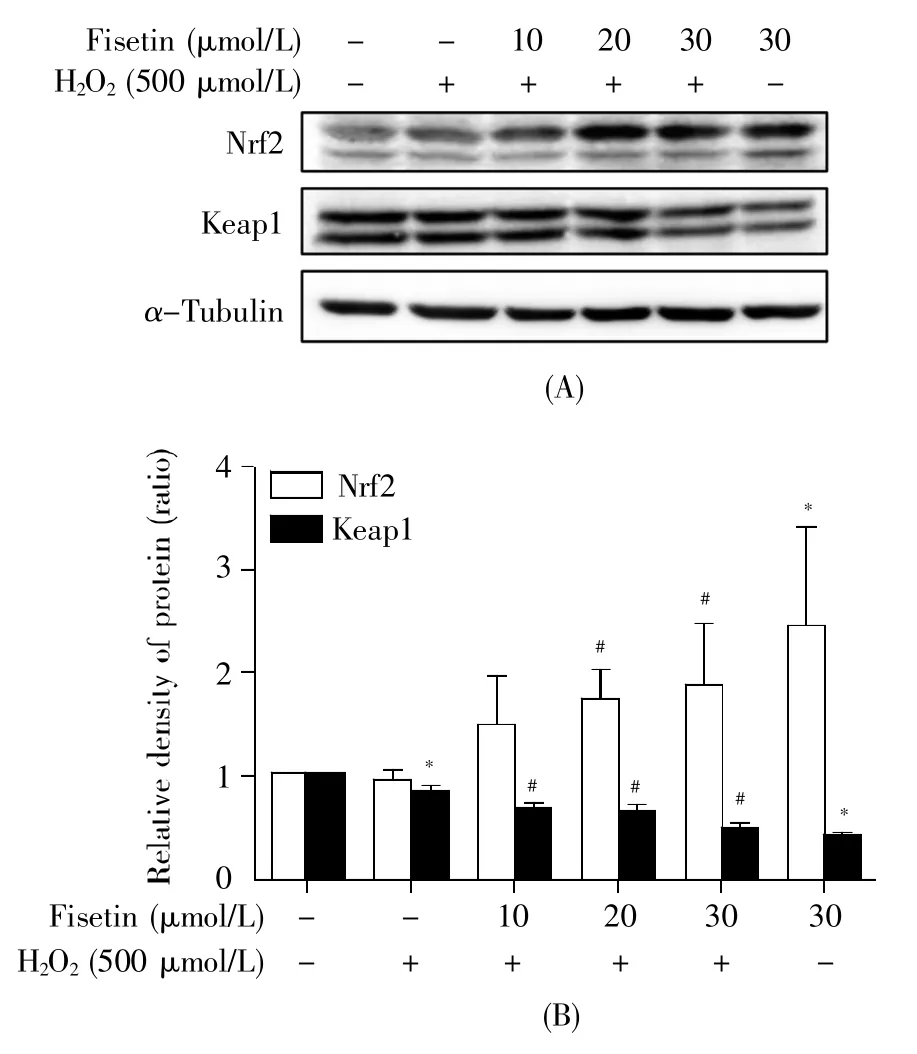
图3 Fisetin对Nrf2、Keap1蛋白表达水平的影响Fig.3 Effect of fisetin on Nrf2 and Keap1 expression
图4A、4B结果显示,与阴性对照组(sh-Con)相比,sh-Nrf2组中Nrf2蛋白的表达水平明显下降,差异具有统计学意义(P<0.01);而Keap1蛋白的表达水平变化不显著,这说明Nrf2低表达细胞系构建成功,可以进行后续实验。图4C结果显示,两种细胞系的荧光值在对照组之间无统计学差异(P>0.05);H2O2模型组与对照组相比,两种细胞系中的荧光强度均显著增加(P<0.01),其中sh-Con细胞系的荧光值增加了约0.8倍,sh-Nrf2细胞系的荧光值增加了约1.9倍;在H2O2模型组中,sh-Nrf2细胞系的荧光值显著高于sh-Con细胞系的荧光值,差异具有统计学意义(P<0.01);与H2O2模型组相比,20 μmol/L fisetin干预组中两种细胞系的荧光值均显著降低(P<0.01),其中sh-Con细胞系的荧光强度降低了24.2%,sh-Nrf2细胞系的荧光强度仅降低了11.8%。这些结果说明,Nrf2缺失时H2O2诱导产生的ROS水平增加;Nrf2在fisetin清除细胞内ROS的过程中起到关键性作用。
3 讨论
慢性病具有难以治愈的特征,它不仅会降低人们的劳动能力与生活质量,还会加重家庭与社会的经济负担。据报道,ROS与超过200种临床疾病的早期发生相关,心血管疾病、癌症、糖尿病和非酒精性脂肪肝等重大疾病均涵括其中[2]。因此,寻找一种能够降低细胞内ROS水平的物质,对疾病的预防具有重要意义。
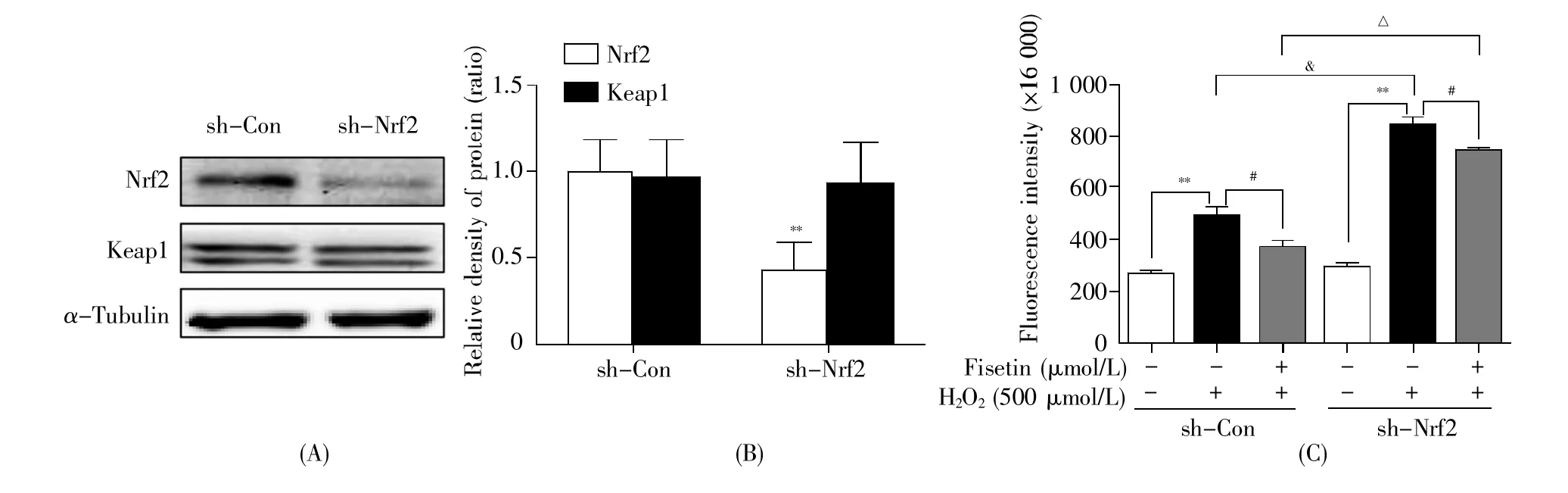
图4 Nrf2在fisetin清除ROS过程中的作用(A~B)sh-Nrf2细胞系中Nrf2蛋白的表达:(C)Fisetin对sh-Nrf2细胞中ROS的清除效果。**表示与空白对照组相比,P<0.01;#表示与H2O2模型组相比,P<0.01;&表示sh-Nrf2细胞H2O2模型组与sh-Con细胞H2O2模型组相比,P<0.01;△表示sh-Nrf2细胞fisetin处理组与sh-Con细胞fisetin处理组相比,P<0.01。Fig.4 The role of Nrf2 in scavening ROS by fisetin(A~B)Expression of Nrf2 in sh-Nrf2 cells;(C)Scavenging effect of fisetin on ROS in sh-Nrf2 cells.**P<0.01,compared with the control group;#P<0.01,compared with the H2O2model group;&P<0.01,when the H2O2model group of sh-Nrf2 cells was compared with that of sh-Con cells;△ P<0.01,when the fisetin treatment group of sh-Nrf2 cells was compared with that of sh-Con cells.
本研究将细胞暴露于H2O2中以增加ROS水平。H2O2是一种重要的活性氧分子,能够引起细胞内ROS产生增多并造成细胞氧化损伤[21]。Ma等[22]选用 200 μmol/L H2O2作为 HepG2 细胞氧化应激与细胞毒性的诱导物,处理4 h后细胞存活率较空白对照组下降约49%。本研究结果表明,HepG2细胞经500 μmol/L H2O2处理30 min后,细胞存活率较空白对照组下降约51%,且细胞内ROS增加。将fisetin干预组与H2O2模型组进行比较,发现fisetin能够提高细胞存活率并抑制细胞内 ROS 的产生(表 1、图 1)。Yen 等[23]发现,fisetin(<20 μmol/L)可恢复细胞活力并抑制衣霉素(tunicamycin,TM)处理引起的细胞凋亡、自噬和ROS产生。这与我们的研究结果相一致。然而,本研究发现单独用fisetin(30 μmol/L)处理时,ROS水平高于空白对照组,这可能与高浓度的fisetin诱导ROS产生有关。相关报道称,高浓度的fisetin(50 μmol/L)在人口腔癌细胞SCC-4中能够诱导产生大量的ROS,降低线粒体膜电位,引起细胞凋亡[24]。此外,高浓度的fisetin(50 μmol/L)可抑制人胃癌细胞AGS和SUN-1的增殖,并诱导其ROS生成增加,产生细胞毒性[25]。因此,将来对于fisetin的开发利用仍需更多的体内外实验进行深入探究。
现有研究表明,多种黄酮类化合物如槲皮素[26]、白藜芦醇[27]、黄腐酚[28]等都是 Nrf2 的激活剂,可对Nrf2及Keap1的表达起调控作用。Zhang等[9]的研究发现fisetin可通过转录后水平抑制Nrf2的降解,使其发生核易位,并上调下游HO-1的表达。这为fisetin作为Nrf2激活剂的研究提供了理论依据。Nrf2/Keap1信号通路是机体内重要的抗氧化通路之一,该通路的激活能够诱导多种Ⅱ相抗氧化酶的表达。目前,关于Nrf2/Keap1途径的机制学说有很多,基本可以分为两种,即Keap1依赖性和Keap1非依赖性。在Keap1依赖性调节Nrf2-ARE途径的学说中,Keap1被广泛认为是Nrf2激活的中枢负调节剂[29]。在我们的研究中,fisetin能够上调Nrf2的表达,而下调Keap1的表达(图3);通过在Nrf2敲低细胞系中验证fisetin对ROS的清除效果发现,Nrf2在fisetin清除细胞内ROS的过程中具有关键性作用(图4C);同时,在一定浓度范围内,GCLC、GCLM、NQO1的表达水平在各组中虽并无明显差异,但HO-1蛋白的表达水平有显著增加(图2),提示fisetin在HepG2细胞中可通过激活Keap1/Nrf2/ARE通路来促进HO-1的表达,从而降低细胞内ROS的水平。
综上所述,fisetin可通过激活Keap1/Nrf2/ARE通路来诱导HO-1的表达,降低细胞内ROS水平,从而在抗氧化损伤过程中发挥细胞保护作用。
